Вступ
Актуальність проблеми ротавірусної інфекції (РВІ) в дитячій інфектології та педіатрії визначається безупинним зростання захворюваності. За даними ВООЗ, у світі щорічно реєструється до 180 млн діарейних захворювань ротавірусної етіології. Щороку 25 млн людей звертаються по медичну допомогу з приводу РВІ, 2 млн з них госпіталізують; 111 млн лікуються самостійно. У США захворюваність на РВІ дітей віком < 5 років становить 274, у Польщі — 310, у Фінляндії — 610, в Австралії — 750–870 на 100 тис. [1, 2]. Щороку у світі реєструється близько 3 млн випадків дитячої смертності, 440 тисяч з них припадає на РВІ [3].
В Україні частота ротавірусного гастроентериту в загальній структурі кишкових інфекцій різної етіології становить від 23 до 50 %, а серед дітей до 3 років — перевищує 60 % [4]. Починаючи з 2006 року в Україні збільшилась кількість дітей, хворих на РВІ. Якщо раніше показник захворюваності становив 0,93–3,18 на 100 тис. населення, то на сьогодні — 14,4 випадку на 100 тис. населення, що обумовлено покращенням методів діагностики даної хвороби й безупинним зростанням захворюваності на РВІ.
Крім того, актуальність РВІ пояснюється розвитком тяжких форм даної інфекції, особливо в дітей раннього віку. Доведено, що до 3–5-річного віку всі діти переносять РВІ хоча б один раз, а кожен наступний епізод захворювання перебігає легше, ніж попередній. Це пояснюється формуванням перехресного імунітету до різних серотипів вірусу [4]. Встановлено, що серед дітей, які хворіють на гострі кишкові й гострі респіраторні вірусні інфекції, позитивні результати обстеження на ротавіруси становлять 39,7 і 13,0 % відповідно [5].
Отже, проблема РВІ є дуже актуальною як у світі, так і в Україні.
Патогенез РВІ складний і не до кінця вивчений, особливо метаболічні й біохімічні процеси, що відбуваються в кишечнику й призводять до розвитку діарейного синдрому в дітей. На сьогодні виділяють декілька фаз патогенезу ротавірусної діареї: ентеротоксигенну, а саме кишкову секрецію, стимульовану дією неструктурного пептиду NSP4 (ентеротоксину); ентеронейрогенну й осмотичну — вторинну мальабсорбцію в результаті дії NSP4 [6–8].
Останніми роками доведено, що саме білок NSP4 ротавірусу є специфічним ентеротоксином, здатним викликати секреторну діарею і запускати механізми розвитку дисахаридазної недостатності. Причому дисахаридазна недостатність обумовлена не загибеллю зрілих ентероцитів, а блокадою функціонування SGLT1 (strong inhibition of both Na(+)-d-glucose) залежного симпорту Na+-d-глюкози, що веде до зменшення всмоктування дисахаридів і реабсорбції води з кишечника [9, 10]. NSP4 зумовлює порушення щільних контактів клітин, що супроводжується збільшенням парацелюлярної проникності й посиленням відтоку води з міжклітинного простору в люмен кишечника [7]. Також показано, що саме протеїн NSP4 викликає дефіцит ферменту лактази-флоризингідролази за рахунок пригнічення активності його вивільнення з ентероцитів, при цьому виникає вторинна лактазна недостатність [11]. Ще однією ланкою патогенезу діарейного синдрому є активація ентеральної нервової системи. Було підраховано, що близько 67 % секреції рідини й електролітів при РВІ в експериментах з мишами було пов’язано саме з активацією ентеральної нервової системи. Шлунково-кишкова нервова система функціонує доволі незалежно від центральної нервової системи, доведено, що ентеральна нервова система містить приблизно стільки ж нейронів, як і спинний мозок, і представлена двома основними нервовими сплетеннями, що знаходяться між круговими й поздовжніми м’язовими волокнами власної пластинки слизової оболонки та взаємозв’язані між собою і підслизовим прошарком. Вважається, що ентеротоксини збудників кишкових інфекцій, зокрема NSP4 ротавірусу, через їх вплив на внутрішньоклітинні вторинні месенджери викликають вивільнення амінів і пептидів з ендокринних клітин кишкового епітелію. Вивільнення 5-гідрокситриптаміну (5-НТ) із даних клітин активує рецептори 5-НТ2 слизової оболонки або 5-HT3/4-рецептори нейроендокринних клітин. Це викликає вивільнення вазоактивного кишкового пептиду й серотоніну, що приводить до збільшення секреції рідини в просвіт кишечника через активацію Cl- або HCO3-секреторних каналів [12].
Іншим механізмом активації ентеральної нервової системи є вивільнення біологічно активних речовин, таких як цитокіни, простагландини й оксид азоту, внаслідок дії ротавірусу [13, 14]. Ці сполуки беруть участь у запальній відповіді й призводять до порушення процесів абсорбції в кишечнику.
Показано, що ротавірус стимулює синтез хемокінів, таких як інтерлейкін-8 [14, 15], кишковими епітеліальними клітинами. Iнтерлейкін-8 є відомим потужним хемоатрактантом для поліморфноядерних лейкоцитів, що посилюють запальний каскад і пошкодження слизової оболонки шляхом виділення активних форм кисню. Енкефаліни, що утворюються в процесі активації ентеральної нервової системи, взаємодіють з антисекреторними δ-рецепторами, унаслідок чого знижується активність цАМФ і, відповідно, залежна від цАМФ секреція аніонів. При ротавірусній інфекції відбувається руйнування енкефалінів завдяки ферменту енкефаліназа, унаслідок чого вони не здатні виконувати свою фізіологічну антисекреторну функцію. Цей фермент сприяє як гідролізу екзогенних, так і розщепленню ендогенних пептидів, таких як енкефаліни.
Клінічне спостереження, що доводить безпосередню участь ентеральної нервової системи в патогенезі діарейного синдрому при ротавірусній інфекції, базується на застосуванні інгібіторів енкефалінази. Дане дослідження демонструє зменшення тривалості діарейного синдрому з 48 до 24 годин після надходження в стаціонар і доводить роль ентеральної нервової системи в процесах секреції і реабсорбції рідини при РВІ [16].
Отже, патогенез діарейного синдрому при РВІ є складним і поєднує порушення осмотичних процесів унаслідок дисахаридазної недостатності, активацію ентеральної нервової системи й блокаду симпортних іонних каналів через дію ротавірусного ентеротоксину — NSP4-протеїну.
Тому метою нашого дослідження було дослідити вплив інгібітору енкефалінази — препарату рацекадотрил на вираженість діарейного синдрому при РВІ у дітей. Рацекадотрил — це проліки, що потребують гідролізу для утворення активного метаболіту тіорфану, який є інгібітором енкефалінази, пептидази клітинних мембран, що знаходиться в різних тканинах, особливо в епітелії тонкого кишечника. Отже, рацекадотрил захищає ендогенні енкефаліни, фізіологічно активні на рівні травного тракту, подовжуючи їх антисекреторну функцію.
Матеріали та методи
Дослідження проводилось кафедрою дитячих інфекційних хвороб ВНМУ ім. М.І. Пирогова на базі Вінницької обласної клінічної дитячої інфекційної лікарні (головний лікар — Л.М. Бровінська). Критеріями включення в дослідження були діти віком до 5 років з діагнозом РВІ, які мали синдром секреторної діареї і проходили стаціонарне лікування в умовах інфекційного відділення. За період із вересня до грудня 2018 року під спостереженням перебували 40 хворих, які відповідали критеріям включення.
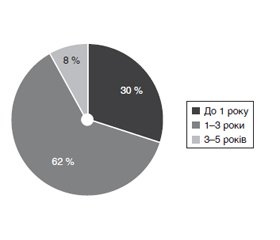
За віком досліджувана група дітей розподілилась так: переважну кількість хворих — 25 (62 %) становили діти віком від 1 до 3 років, 12 дітей (30 %) — першого року життя, і лише 3 хворих (8 %) — діти віком 3 до 5 років (рис. 1).
Щодо статевого поліморфізму, то кількість хлопчиків і дівчаток, які брали участь у дослідженні, була майже однаковою.
Щодо рівня ураження шлунково-кишкового тракту, то серед обстежених хворих у 27 дітей (67,5 %) РВІ перебігала у вигляді гастроентериту, у 8 хворих (20 %) мала місце гастроентероколітична форма інфекції, у 4 дітей (10 %) відмічався ентерит і в 1 хворого (2,5 %) — ентероколіт.
Усім дітям проводився комплекс загальнолабораторних досліджень (загальний аналіз крові, сечі, копроцитограма, біохімічні дослідження). Для встановлення етіологічного чинника застосовувався імунохроматографічний аналіз випорожнень (СITO TEST ROTA, «Фармаско») для виявлення ротавірусного антигену, проводилося бактеріологічне дослідження випорожнень на наявність Salmonella, Shigella, E.coli й умовно-патогенної мікрофлори (Klebsiella spp., Proteus spp., Enterobacter, Citrobacter spp.).
Комплексне лікування дітей із РВІ включало призначення базисної терапії згідно з протоколом лікування: дієтотерапії (виключення з раціону харчування складних цукрів і продуктів, що викликають посилене бродіння), застосування препаратів для пероральної регідратації (регідрон оптім, БіоГая ОРС, хумана електроліт), ентеросорбентів (смекта, атоксіл), еубіотиків (ацидолак, према кідс, БіоГая).
Під час дослідження діти були розподілені на дві репрезентативні групи. До основної групи увійшли діти (n = 20), які крім базисної терапії отримували рацекадотрил (препарат Гідрасек у саше 10 і 30 мг). Доза розраховувалась за масою тіла — 1,5 мг/кг на прийом і застосовувалась перорально (табл. 1).
Максимальна добова доза становила 6 мг/кг на добу. Тривалість лікування не перевищувала 7 діб.
Контрольну групу (n = 20) становили діти, які отримували лише базисну терапію РВІ.
Оцінка ефективності схем лікування із застосуванням рацекадотрилу проводилась на основі аналізу основної клінічної симптоматики й даних лабораторних досліджень.
Статистичну обробку отриманих даних проводили загальноприйнятими методами варіаційної статистики. Під час статистичної обробки визначали такі показники: середня арифметична (М), середня помилка (m), рівень відмінностей між двома середніми величинами (довірча ймовірність — р), при цьому використовували персональний комп’ютер HPENVY з процесором Intel Core i5-3317U, CPU 1,70 GHz, 8,0 GB RAM, Intel HD Graphics 4000 у рамках статистичного пакета програми Statistica 10.0.
Результати та обговорення
Ротавірусна інфекція характеризувалась поєднанням інтоксикаційного, гастроінтестинального й катарального синдромів, але на перший план, звичайно, виходив гастроінтестинальний синдром у дітей як основної, так і контрольної групи.
В обох досліджуваних групах пацієнтів мав місце гострий початок захворювання зі швидким прогресуванням основних симптомів хвороби.
Інтоксикаційний синдром при РВІ характеризувався гіпертермією, загальною слабкістю, млявістю, зниженням апетиту.
Лихоманка, як неспецифічна захисна реакція, була присутня в 36 (90 %) хворих, при цьому відзначалось коливання температури в діапазоні від 37,2 до 39 °С.
Серед дітей основної групи, які отримували препарат рацекадотрил, фебрильна лихоманка відзначалась у 12 (60 %) пацієнтів, у контрольній групі дітей частка хворих з фебрильною температурою тіла була більшою — 16 хворих — 80 % (табл. 2).
Блювання, як один з кардинальних симптомів хвороби, мало місце в 14 (70 %) хворих основної групи і 17 (85 %) хворих контрольної групи. Тривале й багаторазове блювання швидко приводить до розвитку ексикозу, особливо в дітей раннього віку. Серед дітей, які отримували рацекадотрил, у 10 (71 %) пацієнтів блювання відмічалось лише в першу добу захворювання й було одноразовим у 6 (43 %) дітей. У дітей контрольної групи блювання тривало довше: у 6 (35,3 %) дітей блювання відмічалось на 2-гу добу, а у 2 (11,8 %) хворих тривалість блювання становила 3 доби та більше, причому в 5 (29,4 %) дітей групи контролю реєструвалось багаторазове блювання (максимально до 15 разів за добу) (табл. 2).
Діарея, як правило, виникала в першу добу захворювання в обох групах дітей і мала вигляд частих розріджених випорожнень, з пінистими й слабко забарвленими фекаліями, без патологічних домішок або з незначними домішками слизу та з різким кислим запахом. Тривалість діареї становила від 1 до 7 днів. У групі дітей, які отримували рацекадотрил у відповідному дозуванні, у половини хворих (10 дітей — 50 %) діарея тривала від 4 до 6 днів, у 8 дітей (40 %) діарейний синдром тривав 2–4 дні, і не було жодної дитини, у якої рідкі випорожнення зберігались понад 6 днів. На противагу цьому в контрольній групі, у якій діти отримували лише базисну терапію, у 6 хворих (30 %) діарейний синдром тривав понад 6 діб (табл. 2).
Характерною особливістю ротавірусної інфекції є висока частота розвитку метеоризму, що проявляється здуттям живота, підвищеним газоутворенням, флатуленцією та іноді больовим синдромом. При обстеженні основної групи явища метеоризму спостерігались у 15 хворих (75 %), тоді як у контрольній групі прояви цього синдрому відмічали в 19 дітей, що становило 95 % (табл. 2).
Найбільш часте ускладнення РВІ — це розвиток ексикозу, що збільшує термін перебування хворого в стаціонарі у зв’язку з необхідністю проведення тривалої регідратаційної терапії. Розвиток ексикозу І ступеня серед дітей, які отримували рацекадотрил, реєструвався лише у 8 дітей (40 %), у той час як у контрольній групі цей показник був значно вищий — 16 (80 %) хворих (табл. 2).
Катаральний синдром мав місце в 14 (35 %) хворих із загального числа дітей із ротавірусною інфекцією, які перебували під спостереженням, і характеризувався помірною гіперемією задньої стінки глотки й незначними слизовими виділеннями з носа.
Проаналізувавши частоту виникнення основних клінічних синдромів при РВІ, ми визначили їх тривалість (табл. 3).
Отже, застосування рацекадотрилу вірогідно скорочувало тривалість блювання й діарейного синдрому, що, відповідно, скоротило перебування дітей у стаціонарі. Хворі контрольної групи перебували в стаціонарі 7,35 ± 1,20 днів, тоді як діти основної групи перебували на стаціонарному лікуванні в середньому 5,85 ± 1,40 дня. Використання даного препарату дало змогу скоротити термін стаціонарного лікування в середньому на 1,2 доби, що є показником ефективності лікування.
Аналіз основних клінічних симптомів доводить, що застосування протидіарейного засобу рацекадотрилу, що діє виключно на рівні слизової оболонки кишечника й знижує кишкову гіперсекрецію води й електролітів, не впливаючи на базальну секреторну активність, швидко чинить протидіарейну дію, не змінюючи тривалості шлунково-кишкового транзиту, що відображається в ранньому припиненні блювання й діареї в дітей в основній групі, що, у свою чергу, значно зменшує ризик розвитку ексикозу.
Після аналізу перебігу клінічних проявів у дітей з РВІ ми провели аналіз лабораторних показників — гемограми й копроцитограми в дітей основної та контрольної груп.
У периферичній крові в усіх дітей із РВІ в період розпалу показники білої та червоної крові залишались у межах нормативних значень, лише у 6 дітей (30 %) з основної групи й 8 (40 %) — з контрольної відмічались запальні зміни у вигляді нейтрофільного лейкоцитозу.
Провівши аналіз копроцитограми, виявили функціональні порушення переважно верхніх відділів шлунково-кишкового тракту. Ці зміни характеризувались наявністю в калі в переважної більшості дітей неперетравлених решток їжі у вигляді нейтрального жиру й клітковини (табл. 4).
Запальні зміни в більшості дітей були відсутні або незначно виражені. Рівень лейкоцитів не перевищував 15–20 у полі зору в 3 (15 %) хворих контрольної групи і 2 (10 %) дітей основної групи, еритроцити були відсутні, епітеліальні клітини не визначались або були в невеликій кількості. При цьому в більшої частини хворих як в основній — 15 (75 %), так і в контрольній групі — 13 (65 %) у копроцитограмі визначалась велика кількість прозорого слабозабарвленого слизу (табл. 4). Результати копрограми свідчили про порушення перетравлення жирів і вуглеводів, що відображає функціональні порушення підшлункової залози й недостатність жовчовиділення при РВІ.
Підсумовуючи вищевикладене, можна дійти висновку, що скорочення тривалості блювання, швидка нормалізація консистенції випорожнень і зменшення тривалості діарейного синдрому серед дітей основної групи, які отримували рацекадотрил у складі комплексної терапії РВІ, значно зменшили ризик розвитку ексикозу, що дало змогу уникнути парентеральної регідратаційної терапії в більшості хворих і скоротити терміни їх перебування в стаціонарі.
Використання препарату рацекадотрил демонструвало добру переносимість: під час його застосування в жодному випадку не відмічалось алергічних чи інших побічних реакцій.
Висновки
1. Ротавірусна інфекція є найбільш поширеною причиною вірусних діарей у дітей віком до 5 років і найбільш часто спричиняє розвиток ексикозу.
2. Призначення препарату Гідрасек прискорює ліквідацію основних клінічних симптомів у дітей з РВІ: статистично значимо зменшує тривалість діареї і прискорює нормалізацію консистенції випорожнень; сприяє зменшенню блювання.
3. Тривалість діарейного синдрому понад 6 днів на фоні прийому лише базисної терапії РВІ має місце в 3 рази частіше, ніж у групі дітей, яким додатково призначається рацекадотрил. У групі дітей, які приймали рацекадотрил, у 90 % випадків діарея тривала менше за 6 днів, у 40 % випадків — менше за 4 дні.
4. Використання рацекадотрилу дає змогу зменшити ризик розвитку ексикозу, уникнути парентеральної регідратаційної терапії в більшості хворих і скоротити термін стаціонарного лікування дітей із РВІ в середньому на 1,2 доби, що є показником ефективності лікування.
5. Препарат Гідрасек у саше 10 і 30 мг є зручним і простим у використанні, він може призначатися дітям раннього віку.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Glass R.I., Parashar U.D., Bresee J.S. et al. Rotavirus vaccines: current prospects and future challenges. Lancet. 2006. 22. 368(9532). Р. 323-32.
2. Исломов Н.Д., Рахматов Н.А. Клинико-лабораторная и эпидемиологическая характеристика ротавирусной инфекции у детей. Изв. Акад. наук Республики Таджикистан. 2009. № 1(166). С. 36-41.
3. Асилова М.У., Мусабаев Э.И., Убайдуллаева Г.Б. Вирусные диареи в структуре острых кишечных инфекций у детей. Журн. инфектологии. 2011. № 3(3). С. 56-59.
4. Забігайло Ю.Ю. Особливості ротавірусної інфекції, що перебігає з дисахаридазною недостатністю, у дітей: автореф. дис... канд. мед. наук: спец. 14.01.10 «педіатрія». Запоріжжя, 2015. 21 с.
5. Бобровицкая А.И., Голубова Т.Ф., Беломеря Т.А. и др. Некоторые клинико-эпидемиологические аспекты ротавирусной инфекции на современном этапе. Актуальная инфектология. 2013. № 1. С. 61-64.
6. Денисюк Н.Б., Каган Ю.Д. Клинико-патогенетические аспекты ротавирусной инфекции у детей раннего возраста. Эпидемиология и инфекционные болезни. 2011. № 3. С. 18-21.
7. Tafazoli F., Zeng C.Q., Estes M.K. et al. NSP4 enterotoxin of rotavirus induces paracellular leakage in polarized epithelial cells. J. Virol. 2001. Vol. 75 (3). P. 1540-1546.
8. Surendran S. Rotavirus infection: molecular changes and pathophysiology. EXCLI J. 2008. Vol. 7. P. 154-162.
9. Magnuson B., Ekim B., Fingar D. Regulation and function of ribosomal protein S6 kinaze within mTOR signaling networks. Biochem. J. 2012. Vol. 441. № 1. P. 1-21.
10. Ball J.M., Mitchell D.M., Gibbons T.F., Parr R.D. Rotavirus NSP4: a multifunctional viral enterotoxin. Viral Immunol. 2005. Vol. 18(1). P. 27-40.
11. Beau I., Cotte-Laffitte J., Geniteau-Legendre M. et al. An NSP4-dependant mechanism by which rotavirus impairs lactase enzymatic activity in brush border of human enterocyte-like Caco-2 cells. Cell Microbiol. 2007. Vol. 9(9). P. 2254-2266.
12. Boshuizen J.A. Pathogenesis of Rotavirus Infection. Thesis, Erasmus University Rotterdam. Rotterdam, 2005.
13. Farthing M.J. Pathophysiology of infective diarrhoea. Eur. J. Gastroenterol. Hepatol. 1993. № 5. Р. 796-807.
14. Rollo E.E., Kumar K.P., Reich N.C. The epithelial cell response to rotavirus infection. J. Immunol. 1999. № 163. Р. 4442-52.
15. Casola A., Estes M.K., Crawford S.E. Rotavirus infection of cultured intestinal epithelial cells induces secretion of CXC and CC chemokines. Gastroenterology. 1998. № 114. Р. 947-55.
16. Salazar-Lindo E., Santisteban-Ponce J., Chea-Woo E. Racecadotril in thetreatment of acute watery diarrhea in children. N. Engl. J. Med. 2000. № 343. Р.463-7.
/35.jpg)
/35_2.jpg)

/36.jpg)
/37.jpg)