Введение
Воспалительные заболевания лор-органов у детей являются актуальной проблемой не только отоларингологов, но и педиатров. Это связано с их высокой распространенностью, а также способностью провоцировать и поддерживать заболевания других органов и систем организма [7]. Среди патологий верхних дыхательных путей у детей ведущее место занимают тонзиллиты [9]. В настоящее время в отечественных работах идет активное обсуждение проекта нового клинического протокола лечения воспалительных заболеваний небных миндалин «Тонзиллит». Согласно современным рекомендациям следует избегать термина «хронический тонзиллит», поскольку это влечет за собой ошибочное представление о его патофизиологии [10]. Этот термин также отсутствует в рубрике «CA26 Chronic diseases of tonsils or adenoids» проекта МКБ-11 [9]. Миндалины в рамках своей функции находятся в состоянии постоянного, так называемого физиологического воспалительного процесса, который морфологически определяется даже у клинически здорового человека. Патологию миндалин следует констатировать тогда, когда у пациента возникает сочетание признаков воспаления с наличием клинических симптомов заболевания (боль в горле и/или нарушение глотания и лихорадка). Считается, что термин «рекуррентный тонзиллит» (РТ) наиболее точно соответствует сущности патофизиологического процесса и разграничивает клинические состояния, при которых следует проводить медицинское вмешательство. «Рекуррентный тонзиллит» в переводе с английского определяется как «любое персистирующее (т.е. сверх физиологического) или рекуррентное воспаление, которое влияет на кругло-овальную массу лимфоидной ткани латеральной стенки глотки (небные миндалины) или скопления лимфоидных гранул задней стенки глотки и купола носоглотки (аденоиды)» [9, 10].
Рекуррентный тонзиллит (РТ) распространен во всех возрастных группах, но наибольшая заболеваемость отмечается в детской популяции (до 63 %), что объясняется морфологической незрелостью небных миндалин и возрастной незавершенностью иммунологических функций детского организма [2].
Среди бактериальных возбудителей РТ наибольшее значение имеет Streptococcus pyogenes. Этот грамположительный факультативно-анаэробный микроорганизм обладает высокой патогенностью, продуцируя ряд биологически активных экстрацеллюлярных веществ (экзотоксинов), таких как О- и S-стрептолизины, стрептокиназа, ДНКаза Б, стрептогиалуронидаза. Эти экзотоксины вызывают деструкцию клеток макроорганизма и запускают продукцию большого количества цитокинов (фактора некроза опухоли (ФНО-γ и -β), интерлейкина-1 и -6), которые блокируют фагоцитарные реакции в очаге повреждения [2]. Большое значение в патогенезе РТ принадлежит также Staphylococcus aureus. Его обнаруживают на миндалинах в 36–51 % случаев, что зависит от индивидуальных особенностей организма. Среди других патогенов обнаруживают пневмококки, вирус Эпштейна — Барр, различные анаэробы, хламидии и микоплазмы, простейшие, грибы [2].
Streptococcus pyogenes — единственный возбудитель, при выделении которого показано назначение антибактериальной терапии у детей с РТ [8, 14]. Однако рост в последние годы резистентности микроорганизма ко многим антибиотикам является одной из основных причин неэффективности терапии РТ, что в конечном итоге приводит к более частой хронизации патологического процесса и развитию осложнений со стороны внутренних органов [4, 7]. Кроме того, гораздо более глобальным по последствиям феноменом является формирование устойчивости не только бактерий — возбудителей инфекционных заболеваний, но и представителей сапрофитной микрофлоры (так называемый сопутствующий ущерб антибактериальной терапии). Установлено, что распространение антибиотикорезистентных микроорганизмов находится в прямой зависимости от количества назначаемых антибиотиков и широты их антимикробного спектра [3].
Неэффективная терапия стрептококкового тонзиллита зачастую приводит к развитию серьезных осложнений. К возможным осложнениям стрептококкового тонзиллита относятся ранние гнойные (паратонзиллярный абсцесс, шейный лимфаденит, острый средний отит, мастоидит, острый синусит) и поздние негнойные (острая ревматическая лихорадка, острый постстрептококковый гломерулонефрит, ревматическая болезнь сердца и постстрептококковый реактивный артрит) [8, 15].
Наиболее перспективным направлением в терапии РТ на сегодняшний день является использование комменсалов ротовой полости (оральных пробиотиков), которые ингибируют Streptococcus pyogenes. Считается, что ключевыми свойствами идеального орального пробиотика должны быть отсутствие патогенных свойств и наличие мощной ингибирующей активности in vitro и in vivo в отношении патогенов, вызывающих заболевания полости рта и лор-органов. Именно таким штаммом и является Streptococcus salivarius [1, 13]. Streptococcus salivarius — это микроорганизм, который одним из первых колонизирует полость рта человека и сохраняется там в качестве доминирующего представителя нормальной микробиоты на протяжении всей жизни [6, 11]. Многие штаммы являются продуцентами бактериоциноподобных ингибирующих субстанций (bacteriocin-like inhibitory substances — BLIS), которые играют важную роль как в стабилизации состава микробиома полости рта, так и в профилактике избыточного роста потенциальных патогенов и развития инфекционных заболеваний. Саливарицин А — первый описанный бактериоцин, вырабатываемый Streptococcus salivarius, который in vitro ингибирует рост S.pyogenes [1, 13].
В настоящее время опубликованы результаты ряда исследований, подтверждающих эффективность Streptococcus salivarius K12 (SsK12), в первую очередь для профилактики инфекций верхних дыхательных путей и лор-органов [5, 6, 11, 12]. Следует отметить, что особо тщательно в исследованиях оценивалась безопасность штамма SsK12. Было подтверждено отсутствие у SsK12 известных факторов вирулентности стрептококка и детерминант антибиотикорезистентности; установлена низкая предрасположенность к мутагенности; проведены исследования острой и подострой токсичности у крыс; изучено использование высоких доз штамма у человека. Результаты этих штаммоспецифичных исследований, наряду с признанием безопасности, присущей данному виду, позволили в США присвоить штамму S.salivarius K12 GRAS-статус [1, 11, 13].
Цель исследования — изучение эффективности применения респираторного пробиотика Streptococcus salivarius K12 (Бактоблис) в комплексном лечении детей с рекуррентными тонзиллитами.
Материалы и методы
Для достижения поставленной цели было проведено комплексное обследование 35 детей в возрасте от 5 до 15 лет (средний возраст пациентов составил 9,2 ± 2,9 года). В зависимости от выбранной схемы лечения все пациенты были разделены на две группы. Пациенты группы сравнения (15 человек) получали общепринятую терапию (по стандартным показаниям — антибиотики, нестероидные противовоспалительные средства, местные антисептики) во время обострений рекуррентного тонзиллита. Пациенты основной группы (20 человек) получали дополнительно респираторный пробиотик Бактоблис (Streptococcus salivarius K12) по схеме, указанной в инструкции (по 1 таблетке 1 раз в день, рассасывая в полости рта непосредственно перед сном), в течение 30 дней.
Исследование включало детальный сбор анамнеза, объективное обследование, орофарингоскопию и лабораторное исследование (общий анализ крови, общий анализ мочи, мазок со слизистой оболочки глотки для выявления возбудителя дифтерии). Для ранней диагностики стрепто–кокковой инфекции использовали экспресс-тест «Streptatest» (Dectra Pharm, Франция), механизм действия которого базируется на принципе иммуно–хромато–графического анализа и заключается в выявлении антигенов β-гемоли–тического стрептококка группы А в мазках с поверхности миндалин и/или задней стенки глотки. Параллельно с экспресс-тестом всем детям проведено также бактериологическое исследование биоматериала из зева с определением видовой принадлежности выделенных штаммов бактерий и чувствительности к антибиотикам. В пользу этиологической значимости выделенного микроорганизма свидетельствовало наличие ІІІ (более 104 КОЕ/мл) или IV степени роста (105 КОЕ/мл).
Для статистической обработки полученных результатов использовалась программа Statistica 6.1 (серийный номер — AGAR909E415822FA). Оценивались количественные и качественные показатели. При нормальном распределении значений параметров определяли среднеарифметическое значение (М) и его стандартную ошибку (SD). Достоверность различий количественных признаков определяли с помощью парного t-критерия Стьюдента для зависимых совокупностей. Результаты считали статистически значимыми при значениях р < 0,05.
Результаты и обсуждение
Ведущими жалобами на момент осмотра у детей с РТ были боль и ощущение инородного тела в горле, повышение температуры тела, слабость. Исследование лор-статуса выявило, что наиболее часто у пациентов определялись: гипертрофия небных миндалин и слизистой задней стенки глотки, наличие гнойных пробок или гноя в лакунах, увеличение и болезненность регионарных лимфоузлов.
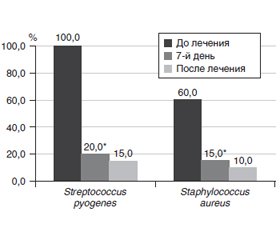
Результаты микробиологического исследования (рис. 1) показали, что у детей с РТ преобладала колонизация верхних дыхательных путей преимущественно грамположительными микроорганизмами, среди которых наиболее часто встречались Streptococcus pyogenes (100 %) и Staphylococcus aureus (60 %). Дрожжеподобные грибы Candida albicans были выделены у 11,4 % пациентов, что может быть связано с часто назначаемой антибактериальной терапией у данной категории пациентов.
Оценка чувствительности Streptococcus pyogenes и Staphylococcus aureus к действию антибактериальных препаратов показала их высокий уровень резистентности к пенициллину (100 и 61 % соответственно), оксациллину (65,7 и 57,1 % соответственно). Резистентность к эритромицину проявляли 62,8 % штаммов Streptococcus pyogenes и 33,3 % штаммов Staphylococcus aureus.
Применение препарата Бактоблис (Streptococcus salivarius K12) в составе комплексной терапии РТ у обследуемых детей характеризовалось более быстрым (р < 0,05) купированием как местных (отек и гиперемия миндалин), так и общих (субфебрилитет, увеличение и болезненность подчелюстных шейных лимфоузлов при пальпации) проявлений РТ. Обнаружена существенная разница в продолжительности жалоб у пациентов, которые получали средства стандартной терапии, и тех, кто дополнительно получал Streptococcus salivarius K12 (табл. 1). У пациентов основной группы достоверно быстрее купировались боли и ощущение инородного тела в горле (р < 0,05). Большинство неприятных ощущений в горле и зеве после приема Streptococcus salivarius K12 исчезли полностью уже после 5–7 дней лечения. В случае использования только базисной терапии субъективные проявления заболевания сохранялись почти у половины больных еще на 7–8-й день лечения.
/28_2.jpg)
Кроме того, дополнительное применение Streptococcus salivarius K12 (Бактоблис) в течение месяца у пациентов основной группы способствовало существенному улучшению микробиома верхних дыхательных путей, который характеризовался достоверным уменьшением колонизации их Streptococcus pyogenes и Staphylococcus aureus на 7-й день лечения с сохранением этого эффекта к концу месяца (рис. 1).
Во время лечения ни у одного из пациентов, получающих Streptococcus salivarius K12, не отмечалось аллергических реакций и других побочных эффектов, что свидетельствует о его высоком профиле безопасности. Однократное применение и хорошие органолептические свойства объясняют высокий комплайенс пациентов к терапии.
Таким образом, Streptococcus salivarius K12 (Бактоблис) является высокоэффективным и безопасным респираторным пробиотиком, который может применяться в составе комплексной терапии рекуррентного тонзиллита у детей. Препарат демонстрирует выраженное положительное действие как на купирование местных признаков тонзиллита, так и на улучшение общего состояния пациентов с тонзиллярной патологией. Кроме того, благодаря своему механизму действия уже на 3-й день приема Streptococcus salivarius K12 способствует вытеснению патогенной микрофлоры и восстановлению естественного микробиома слизистых оболочек ротовой полости, играющего важную роль в защите организма от патогенных и условно-патогенных бактерий. Причем данный эффект сохраняется длительный период после приема последней дозы [1, 13]. Быстрая элиминация из ротоглотки Streptococcus pyogenes снижает частоту развития местных и общих постстрептококковых осложнений [8]. Следует ожидать, что профилактическое применение Streptococcus salivarius K12 у детей, имеющих в анамнезе стрептококковый тонзиллофарингит, приведет к значительному уменьшению количества эпизодов как стрептококковой, так и вирусной инфекции, сократит потребность в использовании антибактериальных препаратов, а следовательно, снизит риск развития антибиотикорезистентности.
Выводы
1. Применение Streptococcus salivarius K12 (Бактоблис) одновременно с общепринятой терапией рекуррентного тонзиллита у детей существенно сокращает продолжительность и выраженность субъективной симптоматики и объективных изменений со стороны слизистых оболочек верхних дыхательных путей и регионарных лимфатических узлов.
2. Ежедневное применение пробиотика Streptococcus salivarius K12 (Бактоблис) в течение 30 дней у детей с рекуррентными тонзиллитами способствует улучшению микробиоценоза верхних дыхательных путей, снижению потребности в приеме системных антибактериальных препаратов, что предупреждает развитие антибиотикорезистентности.
3. Полученные положительные результаты свидетельствуют о рациональности применения Streptococcus salivarius K12 (Бактоблис) для профилактики рецидивов рекуррентного тонзиллита и снижения частоты развития местных и общих постстрептококковых осложнений у данной категории пациентов.
Конфликт интересов. Не заявлен.
Список литературы
1. Андреева И.В., Стецюк О.У. Новый пробиотический штамм Streptococcus salivarius K12 в клинической практике. Клиническая микробиология и антимикробная химиотерапия. 2019. Т. 21. № 2. С. 92-99. DOI: 10.36488/cmac.2019.2.92-99.
2. Годована О.І., Бежук Ю.А. Перебіг тонзилярної інфекції та захворювань пародонту в світлі окремих аспектів етіології та патогенезу (огляд літератури). Вісник проблем біології і медицини. 2019. Вип. 2. Т. 2 (151). С. 24-29. doi: 10.29254/2077-4214-2019-2-2-151-24-29.
3. Заплатников А.Л., Гирина А.А., Леписева И.В. К вопросу о рациональной терапии острых респираторных инфекций у детей в условиях растущей антибиотикорезистентности. Педиатрия. Consilium Medicum. 2018. № 4. С. 37-41. doi: 10.26442/24138460.2018.4.180133.
4. Катосова Л.К., Лазарева А.В., Хохлова Т.А., Пономаренко О.А., Алябьева Н.М. Распространенность и механизмы устойчивости к макролидам Streptococcus pyogenes, выделенных у детей. Антибиотики и химиотерапия. 2016. № 61. С. 23-29.
5. Крамарев С.А., Евтушенко В.В. Бактоблис® (Streptococcus salivarius K12) — инновационная терапия и профилактика острых респираторных инфекций и их осложнений. Актуальная инфектология. 2019. Т. 7. № 1. С. 39-41.
6. Крючко Т.О., Ткаченко О.Я. Клінічний досвід застосування Streptococcus salivarius K12 у профілактиці фаринготонзилітів і респіраторних інфекцій у дітей. Здоровье ребенка. 2018. Т. 13. № 7. С. 629-634.
7. Леженко Г.О., Пашкова О.Є. Раціональний вибір етіотропної терапії при запальних захворюваннях лор-органів у дітей. Современная педиатрия. 2016. № 1 (73). С. 44-48.
8. Машейко А.М., Макаренко О.В., Маврутенков В.В., Слатвицький В.Г. Огляд сучасних аспектів ведення дітей та підлітків, хворих на стрептококовий тонзилофарингіт. Дитячий лікар. 2016. № 1 (46). C. 1-8.
9. Попович В.И. Новые подходы к классификации и терапии острых тонзиллитов. Здоров’я України 21-го сторіччя. 2016. № 24 (397). С. 41.
10. Пухлик С.М., Тагунова И.К., Андреев А.В. Роль грибковой инфекции при хроническом воспалении небных миндалин и возможности лечения. Журнал вушних, носових і горлових хвороб. 2016. № 5. С. 74-81.
11. Bertuccioli A. et al. Streptococcus salivarius K12 in pharyngotonsillitis and acute otitis media — a meta-analysis. Nutrafoods. 2019. № 2. Р. 80-88. doi: 10.17470/NF-019-0011.
12. Di Pierro F. Assessment of Efficacy of BLIS-Producing Probiotic K12 for the Prevention of Group A Streptococcus Pharyngitis: a Short Communication. Probiotics and Antimicrobial Proteins. 2019. Vol. 11. P. 332-334. doi: https://doi.org/10.1007/s12602-018-9398-7.
13. Di Pierro F. et al. Use of Streptococcus salivarius K12 to reduce the incidence of pharyngo-tonsillitis and acute otitis media in children: a retrospective analysis in not-recurrent pediatric subjects. Minerva Pediatrica. 2018. № 70 (3). Р. 240-245. doi: 10.23736/S0026-4946.18.05182-4.
14. Munck H., Jørgensen A.W., Klug T.E. Antibiotics for recurrent acute pharyngo-tonsillitis: systematic review. European Journal of Clinical Microbiology & Infectious Diseases. 2018. Vol. 37, Is. 7. P. 1221-1230.
15. Weber R. Pharyngitis. Primary Care: Clinics in Office Practice. 2014. Vol. 41. № 1. Р. 91-98.
/28.jpg)

/28_2.jpg)