Журнал «Актуальная инфектология» Том 7, №5-6, 2019
Вернуться к номеру
Аналіз клінічних випадків мембранозного фарингіту, асоційованого з Corynebacterium ulcerans
Авторы: Шостакович-Корецька Л.Р., Маврутенков В.В., Будаєва І.В., Ревенко Г.О.
ДЗ «Дніпропетровська медична академія МОЗ України», м. Дніпро, Україна
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
У роботі наведені 4 клінічні випадки мембранозного фарингіту, спричиненого Corynebacterium ulcerans, в осіб 27, 32, 44 та 46 років із детальним аналізом. Показана роль зоонозного збудника Corynebacterium ulcerans у виникненні захворювання, подібного до класичної дифтерії. Наголошено на важливості вакцинопрофілактики дифтерії з метою запобігання захворюваності на зоонозну інфекцію, що викликана Corynebacterium ulcerans.
В работе представлены 4 клинических случая мембранозного фарингита, вызванного Corynebacterium ulcerans, у лиц 27, 32, 44 и 46 лет с детальным анализом. Показана роль зоонозного возбудителя Corynebacterium ulcerans в возникновении заболевания, подобного классической дифтерии. Отмечена важность вакцинопрофилактики дифтерии с целью предотвращения заболеваемости зоонозной инфекцией, вызванной Corynebacterium ulcerans.
The paper presents 4 clinical cases of membranous pharyngitis caused by Corynebacterium ulcerans in subjects aged 27, 32, 44 and 46 years, with detailed analysis. The role of the zoonotic pathogen Corynebacterium ulcerans in the emergence of a disease similar to classic diphtheria is shown. The importance of vaccination against diphtheria is emphasized in order to prevent the incidence of zoonotic infection caused by Corynebacterium ulcerans.
Corynebacterium ulcerans; фарингіт; дифтерія; вакцинація; клінічний випадок
Corynebacterium ulcerans; фарингит; дифтерия; вакцинация; клинический случай
Corynebacterium ulcerans; pharyngitis; diphtheria; vaccination; clinical case
Вступ
Дифтерія — гостре інфекційне захворювання, запобігти якому можна лише вакцинацією. Традиційним етіологічним агентом є Corynebacterium diphtheriae (C. diphtheriae). Дифтерія частіше проявляється як інфекція верхніх дихальних шляхів, рідко — шкіри, очей. Може спостерігатися безсимптомне носійство.
У 1994 році ВООЗ запропонувала програму ліквідації дифтерії в Європейському регіоні до 2000 року на основі масової вакцинації [1]. І хоча мета могла бути цілком реалізована, раптово в нових незалежних країнах, що виникли після розпаду Радянського Союзу, розвинулася епідемія дифтерії, пік якої припав на 1995–1996 рр. У цей період у Європейському регіоні ВООЗ було зареєстровано понад 50 000 випадків захворювання. Надалі завдяки стратегії інтенсивної вакцинації в більшості країн хворобу вдалося взяти під контроль, але ендемічна передача, як і раніше, триває. Дослідження серопревалентності показали, що багато дорослих в деяких країнах мають рівні імунітету, нижчі від захисного порога. Прогалини в імунітеті в дорослого населення сприяли відродженню дифтерії в Східній Європі в 1990-х роках [2].
Для збереження популяційного антитоксичного імунітету ВООЗ рекомендує вводити додаткові дози дифтерійного анатоксину кожні 10 років протягом усього життя [1].
У даний час дифтерійна інфекція вважається недостатньо вивченим захворюванням. Точне висловлювання N.R. Adler, A. Mahony, N.D. Friedman (початок ХIX століття): «Diphtheria: forgotten, but not gone» — про дифтерію як про забуту, але не зниклу хворобу найкраще підкреслює актуальність існуючої проблеми. З кінця 1990-х років у медичній періодиці почали з’являтися повідомлення про випадки дифтерії, що асоційована з C. ulcerans. Наприклад, епідеміологічний аналіз випадків дифтерії, проведений у Великій Британії протягом 12 років (1986–2008 рр.), показав, що зі 102 випадків клінічно встановленої дифтерії 43 пацієнти мали як збудник токсигенні коринебактерії дифтерії, у 59 хворих виділялася токсиноутворююча C. ulcerans, що було пов’язано з контактом з тваринами. Відзначається, що частота і тяжкість людських інфекцій, пов’язаних із C. ulcerans, зростають протягом останніх 20 років, і останнім часом C. ulcerans визнана новим людським патогеном [3].
Вважалося, що даний збудник викликає переважно легкі плівчасті фарингіти, що клінічно імітують дифтерію. Але у 2000 р. офіційно була зареєстрована смерть пацієнтки від плівчастого фарингіту, викликаного C. ulcerans [3–5]. Надалі й інші автори відзначали поодинокі летальні випадки від токсичних форм мембранозних фарингітів, асоційованих із C. ulcerans. При тяжкому перебігу мембранозного фарингіту потрібне обов’язкове введення протидифтерійного антитоксину. У тих випадках, коли при тяжкому перебігу мембранозного фарингіту або мембранозного трахеобронхіту, викликаних C. ulcerans, обмежувалися призначенням антибіотиків (пеніциліну), хворі гинули на 3-тю — 5-ту добу від токсичного шоку (фарингіт) або асфіксії (трахеобронхіт) [4].
В епідеміологічному плані передбачається, що основним джерелом зараження зазначеною інфекцією є тварини, із якими контактує людина. Роль людини в епідпроцесі можливої передачі інфекції піддається сумніву й залишається на сьогодні дискутабельною. Уперше можливість передачі C. ulcerans від тварини до людини було доведена в 1999 р. [6]. C. ulcerans є коменсалом у тварин, в основному відома як бактерія, що викликає мастит у великої рогатої худоби [7]. На сьогодні список тварин, які можуть бути можливими джерелами C. ulcerans, розширився. Доведена здатність передачі токсиноутворюючих C. ulcerans від домашніх собак і котів, диких або домашніх птахів, які є безсимптомними носіями. Титр захисних антитоксичних антитіл у таких тварин досягає значного рівня. Коти й собаки визнані важливими джерелами інфекції C. ulcerans у людей [8–10].
С. ulcerans, уперше виділена в 1926–1927 рр. R. Gilbert і F.C. Stewart, у «Визначнику бактерій» Bergey’s (1974) описана як підвид С. diphtheriae, проміжний між видами С. diphtheriae і С. pseudotuberculosis (ovis). За культуральними ознаками (зброджування цукрів) С. ulcerans подібна до С. diphtheriae var. gravis, але відрізняється тим, що розріджує желатин, слабо ферментує трегалозу й не редукує нітрати в нітрити. С. ulcerans виробляє в ранні терміни культивування цистиназу, уреазу, фосфатазу, чутлива до вірусів. Штами цього виду були виділені з носоглотки здорових осіб (безсимптомні носії) і хворих на клінічну дифтерію. Сучасні методи молекулярної діагностики включають можливість ідентифікації збудника з визначенням ДНК (ПЛР) [11, 12].
Патогенні штами C. ulcerans здатні виділяти екзотоксин. Доведено, що за своїми молекулярно-біологічними властивостями токсин, який виділяє С. ulcerans, ідентичний до дифтерійного токсину. Це пояснюється наявністю в хромосомі збудника генів помірного β-профага, що несе оперон дифтерійного токсину. Фаг зі штаму PW-8 здатний індукувати в нетоксигенних штамів С. ulcerans токсигенність. С. ulcerans продукує два види токсину: перший — токсин, подібний до токсину С. ovis (C. pseudotuberculosis), другий — подібний до токсину С. diphtheriae, який здатний нейтралізуватися протидифтерійною сироваткою [3, 12, 13]. Сучасна наука, на жаль, не має точних знань щодо «інтимних» механізмів реверсії коринебактерий різних представників із нетоксигенних штамів у токсигенні, які відбуваються в природних умовах [10].
У 90-ті роки токсигенність визначалася з використанням фенотипового тесту Elek. У даний час для визначення токсигенності ізоляту використовують такі методи: 1) виявлення гена, що кодує синтез дифтерійного токсину, аналіз вестерн-блот із використанням антитіл проти дифтерійного токсину (DT); 2) тест клітинної цитотоксичності Vero, що пригнічується анти-DT-антитілом Vero [14].
За МКХ-10 не передбачено виділення окремого обліку мембранозних фарингітів, викликаних C. ulcerans. Їх так само можна віднести в рубрику G03.8 — гострі тонзиліти, викликані іншими збудниками, або А36.8 — інша дифтерія. Можливо, назріла необхідність переглянути точку зору на дифтерію як виключно моноетіологічне захворювання та виключно антропонозне захворювання.
Підводячи підсумки наведеної інформації, можна визначити кілька аспектів клініко-епідеміологічної ситуації, що склалася навколо мембранозних фарингітів, викликаних С. ulcerans:
1. Токсигенні штами С. ulcerans і C. diphtheriae виділяють ідентичні токсини, що доведено молекулярно-генетичними дослідженнями й підтверджується клінічною практикою повного одужання при застосуванні протидифтерійного антитоксину при мембранозних фарингитах, асоційованих з С. ulce–rans.
2. Можна припустити, що поява епідеміологічної ніші мембранозних фарингітів, викликаних С. ulcerans, пов’язана з можливою передачею фагами, що кодують ген токсигенності, від токсигенних штамів C. diphtheriae нетоксигенним штамам.
3. З іншого боку, з огляду на морфологічну й імунологічну схожість токсинів зазначених збудників, можна припустити, що виникнення мембранозних фарингітів, причиною яких є С. ulcerans, пов’язане з ослабленням або втратою антитоксичного імунітету до вакцинального дифтерійного анатоксину в людських популяціях, що доведено виникненням локальних спалахів даної інфекції.
Мета роботи — провести аналіз клінічного спостереження пацієнтів, що надійшли з клінікою мембранозного (плівчастого) фарингіту, викликаного С. ulcerans.
Матеріали та методи
На базі Дніпровської міської клінічної лікарні № 21 ім. проф. Є.Г. Попкової було проаналізовано 4 випадки мембранозного фарингіту в Дніпропетровській області, викликаних С. ulcerans, за останні 8 років (2011–2018 рр.). Усі пацієнти були дорослими (27, 32, 44, 46 років). Двоє з них мешкали в сільській місцевості і мали безпосередній контакт із тваринами (тримали власних корів), інші двоє — в місті, один із них регулярно вживав термічно не–оброблене парне молоко. І один хворий заперечував будь-який контакт із тваринами або хворими людьми. Обстеження контактних осіб у жодному випадку не дало позитивних результатів на предмет виділення будь-яких коринебактерій. Фарингоскопічний огляд дозволив констатувати дві форми мембранозних тонзилофарингітів: поширена плівчаста та локалізована острівчаста. Двоє хворих із поширеною формою фарингіту надійшли на другу добу хвороби, хворі з локалізованою формою — на 3-тю і 4-ту добу захворювання. Клінічний діагноз «дифтерія» був установлений тільки у хворих із поширеною формою мембранозного фарингіту, саме цим хворим був призначений протидифтерійний антитоксин. Хворим з острівчастою формою був встановлений діагноз «гострий тонзиліт».
Результати
Мембранозні фарингіти у всіх хворих за своїм перебігом не відрізнялися від клінічної картини класичної дифтерії. Захворювання у всіх хворих починалося гостро, з підвищення температури до 37,5–38,5 °С, появи слабкості, гіпорексії, помірного болю в горлі, незначного та малоболючого тонзилярного лімфаденіту без набряку шиї.
Якщо користуватися клінічною класифікацією дифтерії, то можна відзначити, що у двох хворих спостерігалася локалізована острівчаста форма фарингіту, у двох — поширена плівчаста. Тяжкість захворювання розцінювалася при острівчастій формі як легка, при поширеній — як середньотяжка. Фарингоскопічна картина характеризувалася у всіх хворих помірною гіперемією ротоглотки, помірним збільшенням розмірів мигдаликів за рахунок невеликого набряку і наявністю щільних, спаяних зі слизовою мигдаликів білуватих нашарувань, що не знімалися шпателем. У всіх хворих спостерігався помірний тонзилярний лімфаденіт (збільшувалися верхні передньошийні лімфовузли до 1,5 см, були безболісними та не спаяні з навколишніми тканинами), набряку шийної клітковини не спостерігалося.
У гемограмі у всіх хворих відзначався нейтрофільоз без зсуву ліворуч, помірно збільшена ШОЕ (до 15–18 мм/год), у двох хворих з поширеною формою фарингіту спостерігалася слідова протеїнурія при надходженні на висоті інтоксикації.
У жодного хворого не відзначено появи будь-яких специфічних для дифтерії ускладнень.
У всіх хворих етіологічна розшифровка захворювання здійснена на підставі позитивних результатів бактеріологічного дослідження: виділена культура С. ulcerans, токсигенний штам. Дані дослідження були отримані на 5-ту добу від моменту взяття аналізів, мали ретроспективний характер.
Клінічний діагноз «дифтерія» був установлений тільки двом хворим із поширеною формою захворювання у першу добу госпіталізації на підставі клінічної підказки у вигляді поширення мембранозних нашарувань на дужки, м’яке піднебіння та язичок. Саме цим хворим у першу добу захворювання був уведений протидифтерійний антитоксин. Як відомо, рання специфічна терапія має вирішальне значення. Введення сироватки в обох випадках було в дозі 90 тис. ОД одноразово. У подальшому повторне введення сироватки не проводилося, тому що повне зникнення нашарувань і поліпшення загального самопочуття у двох хворих із поширеною формою дифтерії спостерігалось у наступні дві доби. Як антибактеріальна терапія був призначений азитроміцин (0,5 г на добу упродовж 5 діб).
Хворі з острівчастою формою дифтерії не отримували протидифтерійного антитоксину, пройшли курс антибактеріальної терапії у вигляді цефтріаксону (2,0 г на добу впродовж 7 діб), оскільки спочатку їм було встановлено діагноз «гострий тонзиліт». У цих хворих захворювання закінчилося повним одужанням без ускладнень.
Наводимо детальне клінічне спостереження пацієнтки з мембранозним фарингітом, викликаним С. ulcerans.
Хвора О., 27 років, надійшла в інфекційну лікарню зі скаргами на підвищення температури тіла до 37,5–38 °С протягом 2 діб, помірну болючість при ковтанні, зниження апетиту.
Епідеміологічний анамнез: проживає в сільській місцевості, має власну корову, вживає парне молоко.
Анамнез життя. На диспансерному обліку не перебуває. З інфекційних захворювань перенесла вітряну віспу в 3 роки, кілька разів — гострий тонзиліт. Травм, операцій не було. Алергологічний і гематологічний анамнез невідомий. Профілактичну вакцинацію проти будь-яких захворювань за останні 10 років не отримувала.
Анамнез захворювання. Захворіла гостро, 2 дні тому, коли підвищилась температура тіла до 38 °С, з’явилася болючість при ковтанні, загальна слабкість, лікувалася самостійно: парацетамол по 0,2 г 2–3 рази на день, тепле пиття, полоскання горла содовим розчином 4 рази на день. До лікаря звернулася на 2-гу добу, при огляді ротоглотки виявлено нашарування на мигдаликах плівчастого характеру, лікар відразу ж направив хвору в стаціонар із діагнозом: «лакунарна ангіна. Дифтерія мигдаликів?».
Стан при надходженні. Загальний стан хворої при надходженні середньої тяжкості, помірно млява, апетит відсутній. Правильної статури, задовільного харчування, шкірні покриви чисті, сухі. Пальпуються по обидва боки верхні передньошийні лімфовузли, більше праворуч, в діаметрі 1,0–1,5 см, безболісні, щільноеластичної консистенції, не спаяні з оточуючими тканинами. Дихання везикулярне, тони серця ритмічні, тахікардії й патологічних шумів не виявлено. Печінка і селезінка не збільшені. Випорожнення й сечовиділення не порушені.
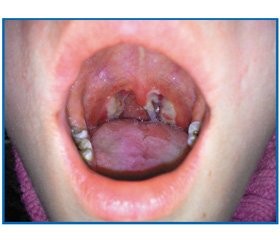
Status localis. У ротоглотці відзначається помірна гіперемія слизової дужок і мигдаликів. Мигдалики гіпертрофовані до ІІ ступеня, рельєф їх помірно згладжений. На поверхні обох мигдаликів, на м’якому піднебінні та задній стінці глотки є щільні, блідо-сірі плівки (рис. 1). При спробі зняти плівку з верхнього полюса правого мигдалика відшарувався шматочок плівки, підлеглі тканини мигдалика, що кровлять. Знята плівка фібринозного характеру. Язик обкладений білуватим нальотом.
Лабораторні дані
Загальний аналіз крові: еритроцити — 4,9 × 1012/л; гемоглобін —120 г/л; лейкоцити — 12,2 × 109/л; паличкоядерні нейтрофіли — 6 %; сегментоядерні нейтрофіли — 68 %; лімфоцити — 22 %; моноцити — 4 %; швидкість осідання еритроцитів — 15 мм/год.
Загальний аналіз сечі: колір — світло-жовтий; питома вага — 1012; лейкоцити — 1–2 в полі зору, епітелій плоский — 1–3 в полі зору, білок — 1,1 г/л.
Бактеріологічне дослідження мазка з ротоглотки й носа — через 48 годин дав зростання С. ulcerans, через 96 годин виявлена здатність зазначеного збудника виділяти дифтерійний токсин.
Бактеріоскопічне дослідження мазка ротоглотки й носа — результат негативний.
РПГА з еритроцитарним діагностикумом — у розведенні 1 : 80 (у 1-шу добу госпіталізації до введення протидифтерійного антитоксину).
Клінічний діагноз. Основний: мембранозний фарингіт, викликаний С. ulcerans, поширена форма, середнього ступеня тяжкості.
Супутні захворювання: немає.
Ускладнення: немає.
При надходженні хворiй був установлений первинний клінічний діагноз «дифтерія поширена, середньотяжка форма», у зв’язку з чим у першу добу госпіталізації був уведений протидифтерійний антитоксин одноразово в дозі 90 тис. ОД, призначений цефтріаксон (2,0 г добу протягом 7 днів). Через 2 доби мигдалики повністю очистилися від нашарувань, зменшилися тонзилярні лімфовузли, покращилося самопочуття. Реконвалесценція перебігала сприятливо, без розвитку ускладнень. Після закінчення антибіотикотерапії й отримання двох негативних бактеріологічних досліджень на коринебактерії хвора була виписана в задовільному стані.
Висновки
Таким чином, аналіз наведених випадків дозволяє зробити такі висновки:
1. С. ulcerans є одним із збудників мембранозного фарингіту, клінічно схожим із проявами різних морфологічних форм дифтерії.
2. Клінічна ефективність терапевтичного застосування протидифтерійного антитоксину при мембранозному фарингіті, викликаному С. ulcerans, підтверджує ідентичність токсинів даної коринебактерии і C. diphtheriae.
3. Захворюваність на зоонозну інфекцію С. ulcerans можна ліквідувати за умови своєчасної масової вакцинації дифтерійним анатоксином всіх верств населення.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
- Swart EM, van Gageldonk PGM, de Melker HE, van der Klis FR, Berbers GAM, Mollema L. Long-term protection against diphtheria in the Netherlands after 50 years of vaccination: results from a seroepidemiological study. PLoS One. 2016;11(2):e0148605. doi:10.1371/journal.pone.0148605.
- Wagner KS, White JM, Lucenko I, et al. Diphtheria in the Postepidemic Period, Europe, 2000–2009. Emerg Infect Dis. 2012;18(2):217–25. doi: 10.3201/eid1802.110987.
- Hacker E, Antunes CA, Mattos-Guaraldi AL, Burkovski A, Tauch A.
- Corynebacterium ulcerans, an emerging human pathogen. Future Microbiol. 2016;11:1191-208. doi: 10.2217/fmb-2016-0085.
- Otsuji K, Fukuda K, Endo T, et al. The first fatal case of Corynebacterium ulcerans infection in Japan. JMM Case Rep. 2017;4(8):e005106. doi: 10.1099/jmmcr.0.005106.
- Both L, Collins S, de Zoysa A, White J, Mandal S, Efstratiou A. Molecular and Epidemiological Review of Toxigenic Diphtheria Infections in England between 2007 and 2013. J Clin Microbiol. 2015;53(2):567-72. doi: 10.1128/JCM.03398-14.
- Bonnet JM, Begg NT. Control of diphtheria: guidance for consultants in communicable disease control. World Health Organization. Commun Dis Public Health. 1999;2(4):242-9.
- Hahne J, Kloster T, Rathmann S, Weber M. Isolation and characterization of Corynebacterium spp. from bulk tank raw cow's milk of different dairy farms in Germany. PLoS One. 2018;13(4):e0194365. doi: 10.1371/journal.pone.0194365
- Detemmerman L, Rousseaux D, Efstratiou A, et al. Toxigenic Corynebacterium ulcerans in human and non-toxigenic Corynebacterium diphtheria in cat. New Microbes New Infect. 2013;1(1):18–19. doi: 10.1002/2052-2975.9.
- Oliveira A, Oliveira LC, Aburjaile F, et al. Insight of Genus Corynebacterium: Ascertaining the Role of Pathogenic and Non-pathogenic Species. Front Microbiol. 2017;8:1937. doi: 10.3389/fmicb.2017.01937.
- Katsukawa C, Komiya T, Umeda K, et al. Toxigenic Corynebacterium ulcerans isolated from a hunting dog and its diphtheria toxin antibody titer. Microbiol Immunol. 2016;60(3):177-86. doi: 10.1111/1348-0421.12364.
- Meinel DM, Margos G, Konrad R, Krebs S, Blum H, Sing A. Next generation sequencing analysis of nine Corynebacterium ulcerans isolates reveals zoonotic transmission and a novel putative diphtheria toxin-encoding pathogenicity island.Genome Med. 2014;6(11):113. doi: 10.1186/s13073-014-0113-3.
- Subedi R, Kolodkina V, Sutcliffe IC, et al. Genomic analyses reveal two distinct lineages of Corynebacterium ulcerans strains. New Microbes New Infect. 2018;25:7-13. doi: 10.1016/j.nmni.2018.05.005.
- Eisenberg T, Kutzer P, Peters M, Sing A, Contzen M, Rau J. Nontoxigenic tox-bearing Corynebacterium ulcerans infection among Game Animals, Germany. Emerging Infectious Diseases. 2014;20(3):448-52. doi: 10.3201/eid2003.130423.
- Umata T, Mekada E. Diphtheria toxin translocation across endosome membranes. A novel cell permeabilization assay reveals new diphtheria toxin fragments in endocytic vesicles. J Biol Chem. 1998;273(14): 8351-9. doi: 10.1074/jbc.273.14.8351.

/271-1.jpg)