Введение
Заболеваемость острыми кишечными инфекциями (ОКИ) остается на высоком уровне [1, 2]. Несмотря на значительные достижения в изучении клиники и патогенеза ОКИ, вызванных патогенными возбудителями (дизентерия, сальмонеллез, иерсиниоз, эшерихиоз), 50–80 % случаев диареи до настоящего времени остаются этиологически не расшифрованными, что приводит к ошибкам в диагностике и лечении [3, 4]. В инфекционной патологии детского возраста все большую значимость приобретает условно-патогенная флора (УПФ), такая как протей, синегнойная палочка, цитробактер, клебсиеллы, энтеробактер и др. [5, 6]. УПФ проявляет вирулентные свойства только при определенных условиях (при снижении иммунологической резистентности организма, нарушении структурно-функциональной целостности естественных защитных барьеров и пр.) [7, 8]. Этиологическая структура спорадической заболеваемости ОКИ, вызванными УПФ, не является постоянной: в различные периоды времени и в разных регионах она может варьировать [9]. До настоящего времени не установлена роль ряда условно-патогенных микробов в этиологии кишечных заболеваний у детей, недостаточно полно изучены клинические аспекты диарей, вызванных УПФ, зависимость особенностей клиники от состояния преморбидного фона, возраста пациентов [10]. Внимание к изучению острых кишечных инфекций клебсиеллезной этиологии было привлечено их тяжестью и склонностью к поражению детей ранней возрастной группы [11]. Возрастание частоты клебсиеллеза, схожесть местных изменений желудочно-кишечного тракта с другими кишечными инфекциями делает значимым изучение данной патологии [11, 12].
Цель работы — изучение этиологических факторов, сезонного распределения, клинико-лабораторных особенностей клебсиеллезной кишечной инфекции у детей.
Материалы и методы
Материалом данного исследования стали 56 пациентов в возрасте от 1 месяца до 14 лет с подтвержденной клебсиеллезной инфекцией, находившихся на стационарном лечении в отделении детских кишечных инфекций Гродненской областной инфекционной клинической больницы (ГОИКБ) на протяжении 2008–2017 годов и выписанных с клиническим выздоровлением. У всех пациентов диагноз был подтвержден выделением возбудителей. У 22 детей выделена Klebsiella pneumoniae, у 18 — Klebsiella oxytoca и у 16 — Klebsiella fridlendery. Стандартный алгоритм обследования пациентов включал общеклинические и биохимические исследования. Для расшифровки этиологического диагноза проводилось комплексное лабораторное обследование, включающее посев испражнений на кишечную группу бактерий, ПЦР-диагностику фекалий на наличие РНК вирусов. Диагноз клебсиеллезной инфекции устанавливали на основании тщательного изучения анамнеза, совокупности клинико-эпидемиологических и лабораторных данных. Обследование проводилось согласно клиническим протоколам, утвержденным Министерством здравоохранения Республики Беларусь. Статистическую обработку полученных данных проводили по общепринятым критериям вариационной статистики. При сравнении двух независимых групп использовали t-критерий Стьюдента, а трех независимых групп — метод ANOVA. Достоверными считали различия в группах при уровне значимости p < 0,05.
Результаты и обсуждение
Как показали исследования, за последние годы в этиологической структуре бактериальных ОКИ возрос удельный вес УПФ (стафилококк, протей, клебсиелла, цитробактер, энтеробактер). Так, если в 2008 году среди пациентов, госпитализированных в детское отделение ГОИКБ, на долю ОКИ, вызванных УПФ, приходилось до 6,9 % от числа бактериологически подтвержденных кишечных инфекций, то в 2017 году их доля увеличилась до 17,9 %.
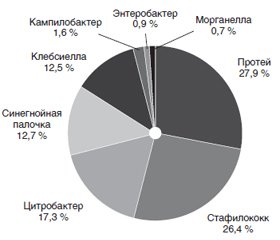
Удельный вес клебсиеллезной инфекции в структуре острых кишечных инфекций, согласно данным литературы, невелик и составляет от 3 до 7 % [11, 12]. При анализе структуры расшифрованных ОКИ у детей (рис. 1) установлено, что клебсиеллезная инфекция составила 12,5 % от числа подтвержденных кишечных инфекций, вызванных УПФ. В 2008 году на долю клебсиеллезной инфекции у детей, госпитализированных в ГОИКБ, приходилось только 3,2 % от числа бактериологически подтвержденных кишечных инфекций, в 2017-м их доля увеличилась до 12,5 %. Распределение пациентов по этиологии возбудителей УПФ представлено на рис. 1.
/34.jpg)
Согласно приведенным данным, в составе ОКИ, вызванных УПФ, наибольшим был удельный вес ОКИ протейной этиологии. Среди детей, перенесших ОКИ, вызванную УПФ, за исследуемый период протеоз выявлен в 27,9 % случаев; стафилококковая кишечная инфекция отмечалась в 26,4 % случаев. ОКИ цитробактерной этиологии (Citrobacter freundii) — у 17,3 % пациентов, ОКИ, вызванная синегнойной палочкой (Pseudomonas aeruginosa), регистрировалась у 12,7 % больных. На долю клебсиеллезной инфекции приходилось 12,5 % случаев. ОКИ, вызванные Campylobacter jejuni, — у 1,6 % пациентов; ОКИ, вызванная Enterobacter aerogenes, — у 0,9 % пациентов; ОКИ, вызванная Morganella morganii, — в 0,7 % случаев. Причиной роста удельного веса ОКИ, вызванных УПФ, может быть не только увеличение ежегодного числа заболевших этими инфекциями и реальный рост заболеваемости, но и расширение возможностей, улучшение лабораторной диагностики, а также увеличение числа лабораторно обследованных лиц, главным образом детей в возрасте до 3 лет. Распределение пациентов с клебсиеллезной инфекцией по полу, степени тяжести и характеру занятости (организованности) представлено в табл. 1.
/34_2.jpg)
Согласно табл. 1, среди госпитализированных детей с клебсиеллезной инфекцией существенных различий по полу не отмечено, преобладала среднетяжелая форма клебсиеллезной инфекции. Доля детей, посещающих детские дошкольные учреждения, составила 37,5 %, не посещающих детские дошкольные учреждения — 62,5 %. Вероятно, это связано с тем, что дети первых лет жизни менее часто посещают детские организованные коллективы и контактируют с окружающими людьми. По нашим данным, совпадающим с данными городского центра гигиены и эпидемиологии, дети, не посещающие детские коллективы, болеют чаще, чем организованные дети. Это соотношение сохраняется в течение всего анализируемого периода. На основании того, что дети до 2 лет находятся в семье и менее часто контактируют с окружающими людьми, можно предположить, что преимущественное заражение детей раннего возраста происходит в домашних очагах алиментарным путем через продукты питания, а также контактным путем через предметы ухода при недостаточном соблюдении гигиенических правил.
При анализе возрастной структуры пациентов с клебсиеллезной инфекцией установлено, что данная инфекция отмечалась среди всех возрастных групп. В возрасте от 1 месяца до 1 года был 31 (55,4 %) пациент; от 1 до 3 лет — 18 (32,1 %) пациентов; от 4 до 6 лет — 5 (8,9 %) пациентов. В возрасте от 7 до 14 лет было только 2 (3,6 %) пациента. Заболеваемость клебсиеллезной инфекцией у детей за последние 10 лет имеет тенденцию к росту. Среди пациентов, заболевших данной инфекцией за анализируемый период, удельный вес детей в возрасте 0–14 лет составил 100 %. Максимальное количество случаев зарегистрировано в возрастной группе 0–3 года (87,5 %). Доля детей в возрасте старше 7 лет среди пациентов с установленной клебсиеллезной инфекцией была минимальной и составила всего 3,6 %. Таким образом, наиболее уязвимой является группа детей первых трех лет жизни, где случаи клебсиеллезной инфекции отмечались более чем в 87 %. С меньшей частотой клебсиеллезная инфекция выявлялась в возрастных группах детей старше 3 лет.
Нами не отмечено сезонности в динамике заболеваемости клебсиеллезной инфекцией. Случаи клебсиеллеза регистрировались равномерно в течение года. Клебсиеллезная инфекция в основном протекала в виде моноинфекции у 52 (92,9 %), сочетанная инфекция отмечена у 4 (7,1 %) пациентов: наблюдалось сочетанное выделение клебсиеллы со стафилококками.
Дети поступали в стационар в первые дни от начала заболевания в состоянии средней тяжести или ближе к тяжелому. В большинстве случаев заболевание протекало по типу энтероколита у 43 (76,8 %) пациентов, реже топическим диагнозом был гастроэнтероколит — у 13 (23,2 %).
По данным табл. 2, начало заболевания в 87,5 % случаев было острым. Клебсиеллезная инфекция начиналась остро с появления срыгивания, вялости, метеоризма, изменения характера и кратности стула, повышения температуры. Наблюдалось снижение массы тела, жидкий стул с примесью слизи. При поступлении в стационар у пациентов были выражены слабость, жажда, мраморность кожных покровов, поведение ребенка менялось, отмечалось беспокойство, тахикардия. В первые 3 дня заболевания поступили 48 (85,7 %) пациентов, в более поздние сроки — 8 (14,3 %).
Фебрильная лихорадка отмечена у 28 (50,0 %) пациентов, субфебрильная температура — у 21 (37,5 %) пациента, у 7 (12,5 %) пациентов температура тела оставалась нормальной. У 19 (33,9 %) детей первого года жизни диагностирован токсикоз с эксикозом I–II степени; снижение массы тела достигало 6–8 %.
Рвота была отмечена у 13 (23,2 %) пациентов 1–3 раза в сутки, преимущественно у детей первого года жизни (табл. 2). У детей старше года наблюдалась клиника энтероколита. Доминировало поражение толстого кишечника. Стул учащался до 6–8 раз в сутки, имел энтероколитный характер (жидкий, с примесью слизи и прожилок крови).
/35.jpg)
При лабораторном обследовании пациентов с клебсиеллезной инфекцией (табл. 3) изменения в периферической крови проявлялись снижением уровня гемоглобина (Нb) в 66,1 % случаев, умеренным лейкоцитозом с нейтрофилезом в 85,7 % случаев; у 14,3 % пациентов формула крови и общее количество лейкоцитов периферической крови не менялись. Умеренное ускорение оседания эритроцитов отмечалось у 57,1 % пациентов. У 34 (60,7 %) пациентов выявлялись изменения в анализе мочи: умеренная лейкоцитурия, альбуминурия. Повышенное содержание мочевины — более 5,6 ммоль/л выявлено у 15 (26,8 %) наблюдаемых пациентов. Изменение в копрограмме определялось у 43 (76,8 %) больных (наличие нейтрального жира, непереваренной клетчатки, зерен крахмала, слизи, лейкоцитов).
Оценка преморбидного фона показала, что среди госпитализированных детей с клебсиеллезной инфекцией только 22 (39,3 %) ребенка относились к группе практически здоровых. У 34 (60,7 %) детей отмечались фоновые заболевания: у 18 (32,1 %) пациентов выявлена анемия; у 11 (19,6 %) — экссудативно-катаральный диатез; у 3 (5,4 %) — рахит; у 2 (3,6 %) детей — гипотрофия. На искусственном вскармливании находился 41 (73,2 %) пациент. Наиболее уязвимым контингентом являются дети от 0 до 3 лет. Вероятно, это связано с тем, что в ранней возрастной группе у детей отмечается функциональная незрелость иммунной системы, ее несовершенство, а также с тем фактом, что большинство заболевших детей имели сопутствующую патологию и отягощенный преморбидный фон. Одна из основных причин заболеваемости ОКИ у детей первого года жизни — неправильное питание (слишком раннее введение прикорма, не соответствующего возрасту младенца). Другой причиной является контакт с родителями, которые могут быть носителями возбудителей, выделяя их во внешнюю среду без каких-либо клинических проявлений. У детей старшей возрастной группы развитию ОКИ способствует употребление инфицированных пищевых продуктов, их неправильное хранение (несоблюдение температурного режима), употребление термически недостаточно обработанных продуктов, немытых овощей и фруктов. Если у взрослого человека в подобном случае срабатывает защитный барьер, препятствующий развитию заболевания, то у детей он еще несовершенен. Все это подчеркивает актуальность бактериологических исследований при сравнительно однообразных симптомах кишечных расстройств различной этиологии.
Выводы
1. Мониторинг ОКИ, вызванных УПФ, показал, что данная патология не имеет тенденции к снижению и является одной из частых причин инфекционных диарей у детей в Гродненской области. Высокая заболеваемость клебсиеллезной инфекцией отмечается у детей первых трех лет жизни. Отсутствие специфической профилактики, легкость инфицирования создали предпосылки для роста заболеваемости.
2. Клинические особенности клебсиеллезной инфекции характеризуются острым началом, лихорадкой, диареей. Заболевание протекает в среднетяжелой форме. Больным в возрасте до 1 года свойственно наличие вододефицитного эксикоза. Отсутствует четко выраженная сезонность клебсиеллезной инфекции.
3. Клебсиеллез чаще встречается у детей с неблагоприятным преморбидным фоном. Наиболее уязвимым контингентом являются дети первых лет жизни, находящиеся на искусственном вскармливании, у которых инфекция протекала тяжелее. Клиническое течение клебсиеллезной инфекции зависит от предрасполагающих факторов: белково-энергетической недостаточности, рахита, анемии.
4. При любых вспышках ОКИ, особенно возникающих в детских организованных коллективах, пациентов необходимо обязательно обследовать на УПФ, включая весь спектр известных возбудителей, что позволит оптимизировать не только способы лечения пациентов, но и противоэпидемические мероприятия.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Учайкин В.Ф. Этиопатогенетическая терапия острых кишечных инфекций у детей на современном этапе / В.Ф. Учайкин, А.А. Новокшенов, Н.В. Соколова // Лечащий врач. — 2010. — № 1. — С. 7-13.
2. Бондаренко В.М. Дисбактериоз кишечника как клинико-лабораторный синдром: современное состояние проблемы / В.М. Бондаренко, Т.В. Мацулевич — М., 2007. — 300 с.
3. Pronko N.V. Epidemiologic, etiological and age aspects of the syndrome of diarrhea in children / N.V. Pronko // Interfaces and Controversies in Gastroenterology. Mainz. — 2012. — P. 62.
4. Dennehy P.H. Acute diarrheal disease in children: epidemiology, prevention, and treatment / P.H. Dennehy // Infect. Dis. Clin. North. Am. — 2005. — V. 19, № 3. — Р. 585-602.
5. Sadkowska-Todys M.A. Infectious diseases in Poland in 2014 / M.A. Sadkowska-Todys, A. Zieliński, M.S. Czarkowski // Przegl. Epidemiol. — 2016. — V. 70, № 2. — P. 167-181.
6. Ершова И.Б. Препараты, восстанавливающие микробиоценоз, как этиотропная терапия острых кишечных инфекций у детей / И.Б. Ершова, А.А. Мочалова, Т.Ф. Осипова, В.А. Рещиков, С.Ю. Козина // Актуальная инфектология. — 2015. — № 2(7). — С. 45-50.
7. Guarino A. Evidence-based Guidelines for the Management of Acute Gastroenteritis in Children in Europe: Update 2014 / A. Guarino, S. Ashkenazi, D. Gendrel, A. Lo Vecchio, R. Shamir, H. Szajewska // Journal of pediatric gastroenterology and nutrition. — 2014. — V. 59, № 1. — P. 132-152.
8. Shane A.L. Infectious Diseases Society of America Clinical Practice Guidelines for the Diagnosis and Management of Infectious Diarrhea / A.L. Shane, R.K. Mody, J.A Crump // Clinical Infectious Diseases. — 2017. — V. 65, № 12. — P. 1963-1973.
9. Shrivastava A.K. Multiple etiologies of infectious diarrhea and concurrent infections in a pediatric outpatient-based screening study in Odisha, India / A.K. Shrivastava, S. Kumar, N.K. Mohakud // Gut. Pathog. — 2017. — V. 9. — P. 16.
10. Eberlin M. Racecadotril in the treatment of acute diarrhea in children: a systematic, comprehensive review and meta-analysis of randomized controlled trials / M. Eberlin, M. Chen, T. Mueck, J. Däbritz // BMC Pediatr. — 2018. — V. 18, № 1. — P. 124.
11. Broberg C.A. Klebsiella: a long way to go towards understanding this enigmatic jet-setter / C.A. Broberg, M. Palacios, V.L. Miller // F1000 Prime Reports. — 2014. — V. 6, № 64. — P. 60-64.
12. Wiener-Well Y.I. Carriage rate of carbapenem-resistant Klebsiella pneumoniae in hospitalised patients during a national outbreak / Y.I. Wiener-Well, B. Rudensky, A.M. Yinnon, P. Kopuit, Y. Schlesinger, E. Broide, T. Lachish, D. Raveh // J. Hosp. Infect. — 2010. — V. 74, № 4. — P. 344-349.
/34.jpg)
/34_2.jpg)

/35.jpg)