Международный эндокринологический журнал Том 15, №2, 2019
Вернуться к номеру
Факторы риска рецидива неактивных аденом гипофиза у больных с дефицитом гормона роста
Авторы: Урманова Ю.М., Шакирова М.Ю., Рихсиева Н.Т., Ходжаева Ф.С.
Ташкентский педиатрический медицинский институт, г. Ташкент, Республика Узбекистан
Республиканский специализированный научно-практический медицинский центр эндокринологии МЗ РУз имени акад. Я.Х. Туракулова, г. Ташкент, Республика Узбекистан
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. На даний час залишається актуальним пошук діагностично значущих маркерів агресивності неактивних аденом гіпофіза (НАГ) для визначення подальшого прогнозу в постопераційному періоді. Аденоми гіпофіза, що не мають клінічних проявів гіперсекреції гіпофізарних гормонів, є формами доброякісних пухлин аденогіпофіза. У загальній популяції частота НАГ становить 50 випадків на 1 млн населення. Мета дослідження: визначити клініко-діагностичні маркери агресивності пухлини у хворих із НАГ і дефіцитом гормона росту і їх роль у формуванні тяжкості нейроендокринної симптоматики захворювання. Матеріали та методи. Під наглядом перебувало 87 хворих (із них чоловіків — 44, жінок — 43) із верифікованим діагнозом НАГ після трансназальної гіпофізектомії; період спостереження — від одного до трьох років. Результати. При розподілі хворих на групи залежно від гістологічної характеристики НАГ переважали пацієнти з крупноклітинною хромофобною аденомою гіпофіза (77,5 %). НАГ у жінок супроводжувалася ожирінням, первинним і вторинним гіпотиреозом, вторинним гіпогонадизмом, синдромом персистуючої галактореї — аменореї (симптоматична й ідіопатична форми), нецукровим діабетом, синдромом порожнього турецького сідла та ін. У чоловіків НАГ супроводжувалася ожирінням, первинним і вторинним гіпотиреозом, вторинним гіпогонадизмом, нецукровим діабетом, гінекомастією. Розроблена шкала маркерів агресивності НАГ дозволила ідентифікувати фактори за трьома ступенями і розробити комплекс профілактичних заходів, покликаних унеможливлювати рецидив зростання пухлини. Висновки. Маркерами агресивності перебігу НАГ є: молодий вік пацієнта, перші симптоми маніфестації хвороби, великі розміри пухлини, асиметричність і деформація гіпофіза, ознаки інвазії пухлини в сусідні тканини/артерії/кавернозний синус, наявність дрібноклітинних і/або темноклітинних хромофобних аденом, пангіпопітуїтаризм.
Актуальность. В настоящее время остается актуальным поиск диагностически значимых маркеров агрессивности неактивных аденом гипофиза (НАГ) для определения дальнейшего прогноза в постоперационном периоде. Аденомы гипофиза, не имеющие клинических проявлений гиперсекреции гипофизарных гормонов, являются формами доброкачественных опухолей аденогипофиза. В общей популяции частота НАГ составляет 50 случаев на 1 млн населения. Цель исследования: определить клинико-диагностические маркеры агрессивности опухоли у больных с НАГ и дефицитом гормона роста и их роль в формировании тяжести нейроэндокринной симптоматики заболевания. Материалы и методы. Под наблюдением находилось 87 больных (из них мужчин — 44, женщин — 43) с верифицированным диагнозом НАГ после трансназальной гипофизэктомии, период наблюдения — от одного до трех лет. Результаты. При распределении больных по группам в зависимости от гистологической характеристики НАГ преобладали пациенты с крупноклеточной хромофобной аденомой гипофиза (77,5 %). НАГ у женщин сопровождалась ожирением, первичным и вторичным гипотиреозом, вторичным гипогонадизмом, синдромом персистирующей галактореи — аменореи (симптоматическая и идиопатическая формы), несахарным диабетом, синдромом пустого турецкого седла и др. У мужчин НАГ сопровождалась ожирением, первичным и вторичным гипотиреозом, вторичным гипогонадизмом, несахарным диабетом, гинекомастией. Разработанная шкала маркеров агрессивности НАГ позволила идентифицировать факторы по трем степеням и разработать комплекс профилактических мер, предупреждающих рецидив роста опухоли. Выводы. Маркерами агрессивности течения НАГ являются: молодой возраст пациента, первые симптомы манифестации болезни, большие размеры опухоли, асимметричность и деформация гипофиза, признаки инвазии опухоли в соседние ткани/артерии/кавернозный синус, наличие мелкоклеточных и/или темноклеточных хромофобных аденом, пангипопитуитаризм.
Background. Nowadays, a search for diagnostically significant markers of aggressiveness of non-functioning pituitary adenomas remains relevant for further prognosis in the postoperative period. Non-functioning pituitary adenomas without pituitary hypersecretion are the forms of adenohypophysis tumors. In the general population, frequency of non-functioning pituitary adenomas is 50 cases per 1 million people. The purpose of the study is to determine the clinical diagnostic markers of tumor aggressiveness in patients with non-functioning pituitary adenomas and growth hormone deficiency, as well as their role in the severity of the neuroendocrine symptoms of the disease. Materials and methods. Under our supervision, there were 87 patients (44 men, 43 women), of them 31 with a verified diagnosis of non-functioning pituitary adenomas after transnasal hypophysectomy. Follow-up was from 1 to 3 years. Results. When patients were distributed in groups depending on histological description of non-functioning pituitary adenomas, those with chromophobe pituitary adenoma prevailed (77.5 %). Non-functioning pituitary adenomas in women were associated with obesity, primary and secondary hypothyroidism, secondary hypogonadism, syndrome of persistent galactorrhea-amenorrhea (symptomatic and idiopathic forms), diabetes insipidus, empty sella syndrome and others. In men, non-functioning pituitary adenomas was accompanied by obesity, primary and secondary hypothyroidism, secondary hypogonadism, diabetes insipidus, gynecomastia. The scale developed to determine the markers of aggressiveness of non-functioning pituitary adenomas allowed identifying factors by 3 degrees and developing a set of measures to prevent the recurrence of tumor growth. Conclusions. Markers of aggressiveness of non-functioning pituitary adenomas are: young age of the patient, first symptoms of the disease, large tumor sizes, asymmetry and deformation of the pituitary gland, signs of tumor invasion into adjacent tissues/arteries/cavernous sinus, small cell and/or dark cell chromophobe adenomas, panhypopituitarism.
неактивні аденоми гіпофіза; дефіцит гормона росту; фактори ризику
неактивные аденомы гипофиза; дефицит гормона роста; факторы риска
non-functioning pituitary adenomas; growth hormone deficiency; risk factors
Введение
В настоящее время клиническое выявление нарушений, связанных с доброкачественными опухолями гипоталамо–гипофизарной области, остается серьезной нерешенной проблемой в нейроэндокринологии [1]. Аденомы гипофиза, не имеющие клинических проявлений гиперсекреции гипофизарных гормонов, называют неактивными аденомами гипофиза (НАГ). Они являются формами доброкачественных опухолей аденогипофиза [2–4]. В общей популяции частота НАГ составляет 50 случаев на 1 млн населения [5].
В отличие от гормонально–активных аденом, НАГ не имеют каких–либо специфических клинических симптомов и не проявляются классическими синдромами гиперсекреции гормонов. Однако недостаточно изучено, влияют ли НАГ на репродуктивную систему, не исследован характер полового созревания, не описаны особенности изменений гормонального спектра и клинических проявлений [6]. Кроме того, дискуссионным является вопрос о целесообразности лечения больных с НАГ [7, 8].
В настоящее время остается актуальным поиск диагностически значимых маркеров агрессивности НАГ для дальнейшего прогноза НАГ в постоперационном периоде (рецидив роста, необходимость повторной операции или лучевой терапии). Все вышеуказанное послужило причиной проведения настоящего исследования.
Цель исследования: определить клинико–диагностические маркеры агрессивности опухоли у больных с неактивными аденомами гипофиза и дефицитом гормона роста и их роль в формировании тяжести нейроэндокринной симптоматики заболевания.
Материалы и методы
Под наблюдением находилось 87 больных (мужчин — 44, женщин — 43) с верифицированным диагнозом НАГ, которые были подвергнуты транс–назальной аденомэктомии. У всех пациентов был диагностирован дефицит гормона роста в плазме крови. Средний возраст больных составил 32,2 года. 20 здоровых лиц соответствующего пола и возраста составили группу контроля. Пациенты после операции наблюдались в течение 1–3 лет.
В работе использованы следующие методы. Общеклиническое исследование включало определение эндокринного и неврологического статуса, антропометрических показателей — роста, веса, объема талии, объема бедер, индекса массы тела. Инструментальные методы: осмотр офтальмолога с определением состояния глазного дна, периметрии на все цвета, остроты зрения; ЭКГ, компьютерная томография или магнитно–резонанс–ная томография турецкого седла и надпочечников, ультразвуковое исследование половых органов. Кроме того, определяли содержание гормонов в крови: соматотропного гормона (СТГ), инсулиноподобного фактора роста 1 (ИФР–1), лютеинизирующего гормона, фолликулостимулирующего гормона, пролактина, тиреотропного гормона, адренокортикотропного гормона, тестостерона, эстрадиола, прогестерона, кортизола (радиоиммунный анализ сыворотки крови проводился на счетчиках Gamma–12 и Strantg–300). Проведено исследование качества жизни по вопроснику QoLAGHD (Quality of Life Adults with growth Hormone deficiency, KIMS Study Questionnaire).
Послеоперационный материал подвергался гистологической диагностике.
Статистические расчеты проведены в программной среде Microsoft Windows с использованием пакетов программ Microsoft Excel–2007 и Statistica version 6.0, 2003. Полученные данные отражены в виде М ± m, где М — среднее значение вариационного ряда, m — стандартная ошибка среднего значения. Достоверность различий между независимыми выборками определялась по методу Манна — Уитни и Стьюдента, в оценке динамики в парных рядах использован критерий Вилкоксона. Корреляционную зависимость (r) между выборками выявляли с использованием метода Спирмена
Результаты
Распределение больных по возрасту показано в табл. 1.
Далее нами были отобраны 31 пациент с НАГ после трансназальной аденомэктомии. В зависимости от гистологической характеристики постоперационного материала больные были разделены на 3 группы (табл. 2).
Как видно из табл. 2, преобладали пациенты с крупноклеточной хромофобной аденомой гипофиза — 24 (77,5 %) и лишь в одном случае (3,2 %) наблюдалась злокачественная гигантская макроаденома гипофиза с рецидивом роста и метастазированием в головной мозг у девочки–подростка, у которой гистологически определялась темноклеточная аденома гипофиза.
Клинические проявления синдрома НАГ делят на эндокринные, неврологические и нейроофтальмологические. В наших наблюдениях с эндокринными проявлениями было 41,5 % больных, неврологическими — 32,8 %, нейроофтальмологическими — 25,7 %.
НАГ у женщин сочеталась с ожирением, первичным и вторичным гипотиреозом, вторичным гипогонадизмом, синдромом персистирующей галактореи — аменореи (симптоматическая и идиопатическая формы), несахарным диабетом, синдромом пустого турецкого седла и др. У мужчин НАГ сопровождалась ожирением, первичным и вторичным гипотиреозом, вторичным гипогонадизмом, несахарным диабетом, гинекомастией.
По данным МРТ–исследования головного мозга у 15 больных обнаружена эндоселлярная опухоль, у 16 — эндоэкстраселлярная (преимущественно с супраселлярным ростом). При МРТ–исследовании НАГ имели преимущественно мягкотканную (n = 16; 52 %) и кистозную (n = 11; 35,4 %) структуру. В четырех случаях (13 %) структура НАГ была представлена геморрагическим компонентом, причем в двух (6,4 %) из них присутствовали как кистозный, так и геморрагический компоненты. У 18 пациентов была выявлена микроаденома (до 1 см), у 12 — макроаденома гипофиза (более 2 см) и у одного — гигантская аденома гипофиза.
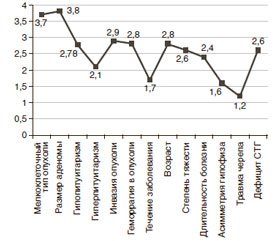
Следующим этапом наших исследований стал поиск наиболее достоверно значимого маркера агрессивности, играющего прогностическую роль в группе больных с ремиссией и рецидивом опухоли после трансназальной аденомэктомии.
Нами определена достоверность различий между такими параметрами, как число пациентов в период ремиссии и число рецидивов после трансназальной аденомэктомии в сравнении с различными показателями. Результаты многофакторного интегрального анализа показали большое количество подобных маркеров (рис. 1).
После анализа данных о частоте ремиссий и рецидивов НАГ выборочно нами была изучена корреляционная зависимость между различными показателями и частотой рецидивов.
Далее нами были изучены факторы риска или маркеры агрессивности НАГ как степени вероятности их рецидива в послеоперационном периоде. В табл. 3 показана степень тяжести маркеров агрессивности опухоли в зависимости от различных показателей.
Разработанная нами шкала маркеров агрессивности НАГ позволила идентифицировать факторы по трем степеням и разработать комплекс профилактических мер, предупреждающих рецидив роста опухоли.
Обсуждение
Неактивные аденомы гипофиза составляют около 35 % от всех гипофизарных аденом. Термин «НАГ» объединяет морфологически разные типы опухолей, для которых характерно отсутствие клинических симптомов избыточной секреции тропных гормонов гипофиза. Однако иммуногистохимические исследования, а также изучение опухолевой ткани in vitro показывают, что около 85 % НАГ обладают способностью продуцировать гормоны, главным образом гонадотропины [9, 10]. Для НАГ типична поздняя диагностика в связи со стертостью клинической картины, трудность полного удаления из–за достижения опухолью, как правило, значительных размеров и отсутствие маркеров, позволяющих оценивать их пролиферативную активность и прогнозировать возникновение рецидивов [11].
Более чем у 50 % больных с НАГ выявляется умеренная гиперпролактинемия. В этих случаях сего–дняшний уровень развития дооперационной диагностики не позволяет провести разграничение между истинной пролактинсекретирующей аденомой с умеренной гиперпродукцией пролактина и НАГ с сопутствующей гиперпролактинемией, вследствие чего возникают трудности в выборе тактики лечения — хирургического или медикаментозного, что является одной из актуальных проблем для клиницистов [12].
НАГ в большинстве случаев диагностируют на стадии макроаденом с выраженным инвазивным ростом. В ранее опубликованных работах указывается роль Ki–67 как маркера агрессивного роста гипофизарных аденом; фактора роста эндотелия сосудов (VEGF), участвующего в ангиогенезе и опухолевой инвазии. К факторам, влияющим на прогрессирование гипофизарных аденом, также относят половые стероиды, в частности эстрогены, которые являются регуляторами секреции пролактина и гонадотропинов [13, 14]. Выявление среди НАГ опухолей с агрессивными характеристиками, отражающими наиболее высокую способность к инфильтративному росту, может стать основой для оптимизации схемы лечения больных с такими аденомами, в частности для уточнения показаний к проведению послеоперационного облучения.
Результаты проведенного исследования указывают, что большое значение имеет определение клинико–диагностических маркеров агрессивности НАГ, как и любой другой опухоли гипофиза. Сравнительный анализ результатов наших исследований показал, что наблюдалась прямая корреляционная связь с такими факторами риска, как молодой возраст пациента, большие размеры опухоли, асимметричность и деформация гипофиза, признаки инвазии опухоли в соседние ткани/артерии/кавернозный синус, наличие мелкоклеточных и/или темноклеточных хромофобных аденом, пангипопитуитаризм.
Все это требует дальнейшего исследования в данном направлении и внедрения предоперационных стереотаксических методов биопсии ткани гипофиза для достижения эффективного прогнозирования рецидива роста опухоли в послеоперационном периоде в зависимости от данных гистологии.
По нашим данным, преобладали пациенты с крупноклеточной хромофобной аденомой гипофиза — 24 (77,5 %). Установлено, что маркерами агрессивности течения НАГ являются: молодой возраст пациента, первые симптомы манифеста болезни, большие размеры опухоли, асимметричность и деформация гипофиза, признаки инвазии опухоли в соседние ткани.
Выводы
1. При распределении больных по группам в зависимости от гистологической характеристики НАГ преобладали пациенты с крупноклеточной хромофобной аденомой гипофиза (77,5 %).
2. НАГ у женщин сочеталась с ожирением, первичным и вторичным гипотиреозом, вторичным гипогонадизмом, синдромом персистирующей галактореи — аменореи (симптоматическая и идиопатическая формы), несахарным диабетом, синдромом пустого турецкого седла и др. У мужчин НАГ сопровождалась ожирением, первичным и вторичным гипотиреозом, вторичным гипогонадизмом, несахарным диабетом, гинекомастией.
Маркерами агрессивности течения НАГ являются: молодой возраст пациента, первые симптомы манифеста болезни, большие размеры опухоли, асимметричность и деформация гипофиза, признаки инвазии опухоли в соседние ткани/артерии/кавернозный синус, наличие мелкоклеточных и/или темноклеточных хромофобных аденом, гипопитуитаризм.
Конфликт интересов. Авторы заявляют об отсутствии какого–либо конфликта интересов при подготовке данной статьи.

/107-1.jpg)
/107-2.jpg)
/108-1.jpg)
/108-2.jpg)