Вступ
Одними з найбільш поширених захворювань в Україні серед дітей молодше п’яти років є гастроентерити, які спричинені переважно ротавірусами, що підтверджується виявленням антигена вірусу у зразках калу методом імуноферментного аналізу. У світі більше 2 мільйонів дітей такого віку потрапляють до лікарень щороку через ротавірусну інфекцію, більше ніж у півмільйона захворювання завершується летальним наслідком [5]. У тяжких випадках захворювання ускладнюється дегідратацією, що призводить до смерті. До введення вакцинації на частку ротавірусного гастроентериту припадало до 39 % смертей [25]. Залежно від рівня розвитку держави існує відмінність між віком інфікування: у країнах з низьким рівнем розвитку переважно хворіють діти першого року життя, тоді як у країнах першого світу — від двох до п’яти років [3]. Ротавірус тропний до апікальних клітин та здатний вражати зрілі ентероцити, після чого відбувається їх руйнування та десквамація епітелію, що призводить до тимчасової нездатності всмоктувати речовини. Клінічно це проявляється діареєю. Особливістю ротавірусної інфекції у дітей молодшого віку є тяжкий перебіг захворювання з симптомами інтоксикації, діареї, блювання, катаральних явищ, дегідратації І–ІІІ ступеня. Ротавірусна інфекція також схильна до генералізації в організмі людини, призводячи до неврологічних ускладнень, які виявляються у 2–5 % випадків [19].
Метою нашого дослідження є вивчення клініко-епідеміологічних особливостей ротавірусної інфекції, принципів діагностики та профілактики даного захворювання.
Матеріали та методи
Для вивчення частоти та сезонності захворюваності на ротавірусну інфекцію нами проаналізована звітність інфекційно-діагностичного відділення Вінницької обласної дитячої клінічної лікарні з 2015 по 2017 рік та результати імунопрофілактики ротавірусної інфекції. Для уточнення клінічних проявів нами обстежено 58 дітей із ротавірусним гастроентеритом, які знаходились на стаціонарному лікуванні в інфекційно-боксованому відділенні Вінницької обласної дитячої клінічної лікарні з грудня 2017 по червень 2018 року. Серед них було 36 хлопчиків (62,06 %) та 22 дівчинки (37,94 %) віком від 7 місяців до 8 років. Для постановки діагнозу ротавірусної інфекції дітям проводили CITOTEST ROTA (тест-система для виявлення антигенів ротавірусів). Інтерпретація відбувалась згідно з інструкцією виробника. Негативним вважали результат з однією зеленою лінією (лінія контролю), позитивним — при появі біля зеленої контрольної лінії чіткої червоної. За відсутності контрольної лінії, а також при невірній техніці виконання тесту результат вважався недійсним. Окрім цього, дітям проведений комплекс наступних досліджень: загальний аналіз крові та сечі, біохімічне дослідження крові (електроліти, загальний білірубін та його фракції, білок, сечовина, креатинін, печінкові проби, трансамінази), глюкоза плазми крові, дослідження копроцитограми, аналіз калу на наявність яєць гельмінтів, аналіз випорожнень на приховану кров, посів калу на патогенну кишкову флору. Серед інструментальних досліджень застосовували ультразвукове дослідження органів черевної порожнини. До уваги брали сезонність захворювання (відношення кількості випадків до кількості днів у місяці) та методи профілактики. Для вивчення профілактики даного захворювання аналізували дані карти обліку профілактичних імунізацій і реакцій на щеплення. Застосовано методи епідеміологічного аналізу, статистичний, графічного зображення.
Результати та обговорення
При аналізі даних річних звітів інфекційно-діагностичного відділення було встановлено, що кількість пролікованих дітей з інфекційною патологією за 2015–2017 рр. знаходилась на одному рівні та становила 608, 634 та 612 осіб відповідно кожного року. Частка дітей, які мали інфекційні захворювання кишечника, — 19,40; 16,24 та 17,81 %. Серед усіх кишкових інфекційних хвороб питома вага ротавірусних гастроентеритів була на високому рівні — 32,20; 63,10 та 43,11 % відповідно кожного року.
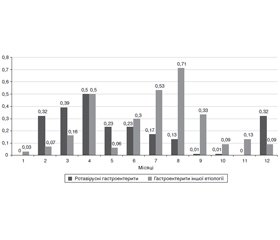
Нами була підтверджена сезонність ротавірусної інфекції, зареєстрованої у дітей (рис. 1). Найбільшу кількість госпіталізацій з приводу ротавірусної інфекції виявили у зимово-весняний період року з піковими значеннями у грудні — квітні на відміну від гастроентеритів іншої етіології. Так, найвищими показники сезонності були у квітні та становили 0,50, дещо меншими — у березні (0,39) та мали однакові значення у грудні та лютому (0,32).
/31.jpg)
Серед обстежених дітей розподіл захворюваності за віком був наступним: до 1 року — 5 дітей (8,63 %), від 1 до 3 років — 41 дитина (70,69 %), від 4 до 6 років — 6 осіб (10,34 %) та старше 7 років — 6 (10,34 %). Основними показаннями для госпіталізації були нестримне блювання, ознаки зневоднення, невдачі пероральної регідратації та відсутність умов для безпечного подальшого виконання рекомендацій та домашнього лікування [11]. Усі діти надходили у стаціонар за терміновими показаннями у тяжкому (79,31 % дітей) або середнього ступеня тяжкості стані (20,69 %). Оцінка тяжкості проводилась за класичною шкалою Васікарі, де середній ступінь тяжкості ставили за наявності 9–10 балів, тяжкий — при нарахуванні більше 11 балів. Провідними симптомами ротавірусної інфекції були розлади шлунково-кишкового тракту. Наявність діареї, яка тривала від 3 до 7 діб, відмічали у 96,55 % хворих, з кратністю випорожнень за добу в середньому від 3 до 8 разів. Випорожнення були рідкі, водянисті, жовто-коричневого кольору, іноді з домішками слизу та часточками неперетравленої їжі. Двох- та чотирьохразове блювання, яке тривало від 1 до 2 діб, спостерігалося у 58,62 % дітей. Третина дітей (34,48 %) мали періодичний спазмуючий біль у животі без чіткої локалізації. Гастроінтестинальні розлади перебігали на фоні вираженого інтоксикаційного синдрому. Практично в усіх пацієнтів відмічали підвищення температури тіла до фебрильних цифр, відмову від їжі та пиття, млявість, сонливість, неспокій. У 41,37 % пацієнтів спостерігали катаральні прояви: закладеність носу, утруднення носового дихання, слизові виділення з носу та помірну гіперемію задньої стінки глотки. Під час вивчення результатів загального аналізу крові при надходженні було виявлено нормальну або підвищену кількість лейкоцитів з абсолютним або відносним лімфоцитозом.
На третій день лікування в стаціонарі в усіх групах відмічена тенденція до регресу симптомів хвороби. Середній термін перебування в стаціонарі серед обстежених дітей становив 6,31 ± 2,14 дня. Переважна кількість дітей перебувала в стаціонарі від 4 до 7 днів (53,44 %), значно менше дітей (20,68 %) — до 3 діб та четверта частина (25,88 %) — більше 7 діб.
У інфекційно-діагностичному відділенні після госпіталізації пацієнта виконували всі заходи щодо попередження поширеності інфекції: діти були ізольовані та забезпечені індивідуальними засобами догляду. Відомо, що в Україні щеплення проти ротавірусної інфекції не входять в основний графік щеплень. За даними карти обліку профілактичних імунізацій і реакцій на щеплення нами було встановлено, що жодна дитина не отримувала профілактичних щеплень від ротавірусної інфекції.
Найбільш дієвим на сьогодні та економічно вигідним методом профілактики ротавірусної інфекції у дітей вважають вакцинацію [16, 30, 17]. Для захисту дітей від даного інфекційного агента були розроблені живі оральні атенуйовані вакцини. Першою з таких вакцин була Rotashield, виготовлена в 1998 році. Проте незабаром були отримані дані, що в перший тиждень після введення Rotashield імунна система дитини реагує таким чином, що сприйнятливість до інфікування ротавірусами збільшується. Окрім цього, була помічена серйозна побічна дія, яка полягала у виникненні інтестинальних інвагінацій з частотою 1 : 10 000. Пізніше було з’ясовано, що причиною даного ускладнення було призначення вакцини дітям старше 90 днів [19, 12]. Саме тому в 1999 році її використання у США було припинене [9]. Деякі автори запропонували переглянути терміни вакцинації Rotashield задля відновлення її застосування [34]. Після змін у календарі щеплень Rotashield використовувалась пізніше в Гані та країнах Південної Африки. У зв’язку з реєстрацією поодиноких випадків інвагінації кишечника після введення сучасної вакцини Rotarix (RV1) у Мексиці та Бразилії (з частотою 1 : 51 000 та 1 : 68 000 відповідно) були проведені дослідження, що показали відсутність збільшення ризику виникнення інвагінації у групі пацієнтів, імунізованих вакциною Rotarix (RV1), порівняно з групою плацебо. Тільки у Мексиці та Бразилії Rotarix дозволяє профілактувати щонайменше 80 000 випадків госпіталізацій та 1300 смертельних випадків від діареї щорічно [23].
На сьогодні доступними є два різновиди вакцин — Rotarix та RotaTeq. Сутність дії вакцини полягає в стимуляції вироблення ротавірусних антитіл IgA, яких в подальшому достатньо для захисту від даного вірусу [27]. Існують також вакцини Lanzhoulambrotavirus (Китай) та Rotavin-M1 (В’єтнам), які не ліцензовані для міжнародного використання, оскільки вони не пройшли третьої фази клінічних випробувань [26]. Індійські вчені також розробили власну вакцину проти ротавірусної інфекції — Rotavас, яка була випущена у 2014 році. Вона використовується та включена у календар щеплень лише у країні виробника [6, 19]. Окрім цього, отримані перші результати випробовувань недорогої термостабільної оральної пентавалентної вакцини проти ротавірусної інфекції (BRV-PV, Serum Institute of India) у 3508 новонароджених, які показали ефективність вакцинації у 66,7 % випадків [13]. Використання даної вакцини може набути більшої популярності вже найближчим часом, особливо в тих країнах, де підтримання холодового ланцюжку є ненадійним [22].
Вакцини Rotarixі RotaTeq мають доведену тривалу статистично значиму ефективність (діють на велику кількість серотипів ротавірусів) та добру переносимість [32, 28, 24, 20, 31]. Саме тому Всесвітня організація охорони здоров’я (ВООЗ) рекомендує вакцинацію для профілактики та контролю ротавірусних інфекцій та включення її в усі імунізаційні програми національного рівня [14].
Rotarix (RV1) — це моновалентна вакцина для профілактики ротавірусного гастроентериту, яка містить живий ослаблений вірус, отриманий зі штаму ротавірусу людини. Вакцина призначена тільки для перорального застосування, ні у якому разі не можна вводити її ін’єкційно. Немає необхідності у зміні режиму та характеру харчування дитини, оскільки відсутні дані щодо впливу споживання рідини та їжі на ефективність вакцинації. Зазвичай призначають дві дози вакцини (по 1,5 мл) згідно з інструкцією, затвердженою в Україні (реєстрація № UA/13060/01/01 від 27.12.2013. Наказ № 1153 від 27.12.2013). Перша доза призначається починаючи з 6 тижнів, а друга не раніше ніж через 4 тижні після першої. Як правило, дводозовий режим вакцинації завершують цією ж вакциною до досягнення дитиною 24 тижнів. За даними клінічних досліджень, зригування та спльовування при застосуванні вакцини спостерігали дуже рідко, і в таких випадках повторну дозу не вводили. У випадку, якщо дитина одразу зригнула або сплюнула майже всю дозу вакцини, можна одноразово замінити дану дозу під час цієї ж вакцинації. За аналогічними принципами проводиться щеплення недоношених дітей.
Сьогодні порівнюють різні варіанти дводозового введення вакцини: на 6-му і 10-му та 10-му і 14-му тижнях. Вказується, що у країнах з низьким і середнім рівнем доходів більш оптимальним є другий варіант, оскільки при цьому відмічена вища імуногенність. А введення трьох доз Rotarix (RV1) на 6-му, 10-му, 14-му тижні має аналогічні або дещо вищі показники сероконверсії порівняно з графіком 10/14 тижнів [10]. Схожі результати, які вказували на вищу імуногенність та ефективність трьохдозових графіків введення вакцини, отримані у Південній Африці та Малаві [21]. Тому продовжуються подальші вивчення ефективності різних схем введення вакцин для оптимізації графіків вакцинації.
RotaTeq — це пентавалентна вакцина, що містить п’ять рекомбінованих екземплярів ротавірусу, стабілізованих у буферному розчині, які були отримані шляхом рекомбінації з ланцюгів ДНК людського та бичачого штамів. Не дозволено змішувати вакцину з будь-якими розчинами. Призначають перорально три дози по 2 мл: першу — у віці між 6-м та 12-м тижнями, наступні дози призначають з інтервалом від 4 до 10 тижнів, але третю дозу необхідно ввести дитині не пізніше досягнення нею віку 32 тижні. Для дітей не існує ніяких обмежень щодо споживання їжі або рідини, включаючи грудне молоко. Після вакцинації RotaTeq визначено стійке зниження кількості госпіталізацій дітей з ротавірусним гастроентеритом віком до 3 років без підвищення частоти несприятливих подій після імунізації [2, 33].
Вакцини протипоказані дітям з відомою підвищеною чутливістю після попереднього їх застосування або до будь-якого з компонентів вакцин. Вони не використовуються у дітей з наявністю в анамнезі інвагінації або наявною неусуненою вродженою вадою розвитку шлунково-кишкового тракту та у дітей з тяжким комбінованим імунодефіцитом. Rotarix (RV1) також протипоказаний дітям із рідкісними спадковими захворюваннями, що пов’язані з непереносимістю фруктози, глюкозо-галактозною мальабсорбцією або з цукрово-ізомальтозною недостатністю. Щеплення проти ротавірусу відкладають дітям з гострими захворюваннями, що супроводжуються лихоманкою, а також при наявності гастроінтестинальних розладів. Застосування вакцин у немовлят, які знаходяться на імуносупресивній терапії, значно обмежується. Особи, які контактують з нещодавно вакцинованими дітьми, мають бути проінформовані про необхідність дотримання ретельної гігієни, оскільки з випорожненнями дитини, в середньому протягом 10 діб, виділяється вакцинний штам. Серед найпоширеніших несприятливих подій виділяють діарею та дратівливість.
Дані Кокранівського огляду свідчать про ефективність застосування Rotarix і RotaTeq як у країнах із низьким, так і високим рівнем розвитку [29]. Результати досліджень говорять, що найбільш повний захист від інфікування ротавірусами виникає лише після прийому повного курсу вакцин RotaTeq, проте деякою мірою діти є захищеними і після часткового курсу [35].
На сьогодні ефективним є введення вакцини проти ротавірусу як разом з іншими вакцинами, так і окремо [18]. Дослідження, проведені у США, довели, що одночасне введення вакцини Rotarix (RV1) в комбінації з іншими вакцинами не знижує імунної відповіді до жодної з них [7].
Було продемонстровано невелику кількість інфікувань плода живою вакциною, що вносить певні обмеження в призначення вакцин вагітним. Але вакцини проти ротавірусу рекомендовані лише для дітей, тому спеціальні дослідження не проводились, а отримані дані потребують подальшої перевірки та детального вивчення [9]. Також трансплацентарне отримання антитіл до ротавірусу є доказом недоцільності застосування Rotarix і RotaTeq у немовлят перших тижнів життя. ВООЗ рекомендує використовувати вакцини якомога раніше після досягнення дітьми шеститижневого віку [26].
Цікаво, що у країнах після введення обов’язкової вакцинації проти ротавірусної інфекції відмічений суттєвий стійкий ефект у зниженні циркуляції ротавірусу та зміні епідеміології серед дітей, а також щорічне зниження гастроентеритів і у групі від 5 до 44 років [8, 1, 4]. Восьмирічні результати впровадження вакцинації проти даного збудника показали високу ефективність (68–98 %) та значне зменшення відсотку госпіталізації з 84 до 65 % у європейських країнах [15]. Такі дані вказують на першочерговість дітей у передачі ротавірусу та непрямий позитивний вплив, що полягає у посиленні ефекту від ротавірусної вакцинальної програми у цих країнах серед інших верств населення [1, 4, 8].
Висновки
1. При майже однакових показниках госпіталізованих до відділення з інфекційною патологією частка ротавірусних гастроентеритів коливалась від 32,2 % (у 2015 році) до 63,1 % (у 2016 році).
2. Найбільшу кількість госпіталізованих з приводу ротавірусної інфекції виявлено у зимово-весняний період. У віковій структурі з даною патологією переважали діти віком від 1 до 3 років (70,69 % випадків).
3. З’ясовано, що серед усіх пацієнтів клінічні прояви захворювання розподілялися наступним чином: діарея — у 96,55 % хворих, блювання — у 58,62 %, біль в животі — у 34,48 %, катаральні прояви — у 41,57 % хворих.
4. Виявлено, що середня тривалість перебування дітей в стаціонарі становила 6,31 ± 2,14 дня.
5. За даними карти обліку профілактичних імунізацій і реакцій на щеплення було встановлено, що жоден пацієнт не отримував профілактичних щеплень від ротавірусної інфекції.
6. Найбільш ефективним та безпечним методом профілактики ротавірусної інфекції є вакцинація, саме тому мають бути розроблені шляхи впровадження вакцинації проти даного захворювання в Україні.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Aliabadi N., Tate J.E., Haynes A.K., Parashar U.D.; Centers for Disease Control and Prevention (CDC). Sustained decrease in laboratory detection of rotavirus after implementation of routine vaccination — United States, 2000–2014 // MMWR Morb. Mortal. Wkly Rep. 2015 Apr 10; 64(13): 337-42.
2. Christie C.D., Duncan N.D., Thame K.A., Onorato M.T., Smith H.D., Malcolm L.G. et al. Pentavalent rotavirus vaccine in developing countries: safety and health care resource utilization // Pediatrics. 2010 Dec; 126(6): e1499-506. doi: 10.1542/peds.2010-1240.
3. Colin Sanderson, Andrew Clark, David Taylor, Brenda Bolanos. Global review of rotavirus morbidity and mortality data by age and region. 2011 Sep.
4. Cortes J.E., Curns A.T., Tate J.E., Cortese M.M., Patel M.M., Zhou F. et al. Rotavirus vaccine and health care utilization for diarrhea in U.S. children // N. Engl. J. Med. 2011 Sep 22; 365(12): 1108-17. doi: 10.1056/NEJMoa1000446.
5. Danchin M.H., Bines J.E. Defeating rotavirus? The global recommendation for rotavirus vaccination // N. Engl. J. Med. 2009 Nov 12; 361(20): 1919-21. doi: 10.1056/NEJMp0905091.
6. Dash N., Verma S. Pertussis and Rotavirus Vaccines — Controversies and Solutions // Indian J. Pediatr. 2018 Jan; 85(1): 53-59. doi: 10.1007/s12098-017-2393-2.
7. Dennehy P.H., Bertrand H.R., Silas P.E., Damaso S., Friedland L.R., Abu-Elyazeed R. Coadministration of RIX4414 oral human rotavirus vaccine does not impact the immune response to antigens contained in routine infant vaccines in the United States // Pediatrics. 2008 Nov; 122(5): e1062-6. doi: 10.1542/peds.2008-1059.
8. Gastañaduy P.A., Curns A.T., Parashar U.D., Lopman B.A. Gastroenteritis hospitalizations in older children and adults in the United States before and after implementation of infant rotavirus vaccination // JAMA. 2013 Aug 28; 310(8): 851-3. doi: 10.1001/jama.2013.170800.
9. Global Advisory Committee on Vaccine Safety, December 2011 // Wkly Epidemiol. Rec. 2012 Feb 10; 87(6): 53-9.
10. Gruber J.F., Gruber L.M., Weber R.P., Becker-Dreps S., Jonsson Funk M. Rotavirus Vaccine Schedules and Vaccine Response Among Infants in Low- and Middle-Income Countries: A Systematic Review // Open Forum Infect. Dis. 2017 Apr 5; 4(2): ofx066. doi: 10.1093/ofid/ofx066.
11. Guarino A., Ashkenazi S., Gendrel D., Lo Vecchio A., Shamir R., Szajewska H.; European Society for Pediatric Gastroenterology, Hepatology, and Nutrition; European Society for Pediatric Infectious Diseases. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition/European Society for Pediatric Infectious Diseases evidence-based guidelines for the management of acute gastroenteritis in children in Europe: update 2014 // J. Pediatr. Gastroenterol. Nutr. 2014 Jul; 59(1): 132-52. doi: 10.1097/MPG.0000000000000375.
12. Haber P., Patel M., Izurieta H.S., Baggs J., Gargiullo P., Weintraub E. et al. Postlicensure monitoring of intussusception after RotaTeq vaccination in the United States, February 1, 2006, to September 25, 2007 // Pediatrics. 2008 Jun; 121(6): 1206-12. doi: 10.1542/peds.2007-3793.
13. Isanaka S., Guindo O., Langendorf C., Matar Seck A., Plikaytis B.D., Sayinzoga-Makombe N. et al. Efficacy of a Low-Cost, Heat-Stable Oral Rotavirus Vaccine in Niger // N. Engl. J. Med. 2017 Mar 23; 376(12): 1121-1130. doi: 10.1056/NEJMoa1609462.
14. Jonesteller C.L., Burnett E., Yen C., Tate J.E., Parashar U.D. Effectiveness of Rotavirus Vaccination: A Systematic Review of the First Decade of Global Postlicensure Data, 2006–2016 // Clin. Infect. Dis. 2017 Sep 1; 65(5): 840-850. doi: 10.1093/cid/cix369.
15. Karafillakis E., Hassounah S., Atchison C. Effectiveness and impact of rotavirus vaccines in Europe, 2006–2014 // Vaccine. 2015 Apr 27; 33(18): 2097-107. doi: 10.1016/j.vaccine.2015.03.016.
16. Kotirum S., Vutipongsatorn N., Kongpakwattana K., Hutubessy R., Chaiyakunapruk N. Global economic evaluations of rotavirus vaccines: A systematic review // Vaccine. 2017 Jun 8; 35(26): 3364-3386. doi: 10.1016/j.vaccine.2017.04.051.
17. Lamberti L.M., Ashraf S., Walker C.L., Black R.E. A Systematic Review of the Effect of Rotavirus Vaccination on Diarrhea Outcomes Among Children Younger Than 5 Years // Pediatr. Infect. Dis. J. 2016 Sep; 35(9): 992-8. doi: 10.1097/INF.0000000000001232.
18. Libster R., McNeal M., Walter E.B., Shane A.L., Winokur P., Cress G. et al. Safety and Immunogenicity of Sequential Rotavirus Vaccine Schedules // Pediatrics. 2016 Feb; 137(2): e20152603. doi: 10.1542/peds.2015-2603.
19. Luchs A., Timenetsky Mdo C. Group A rotavirus gastroenteritis: post-vaccine era, genotypes and zoonotic transmission // Einstein (Sao Paulo). 2016 Apr-Jun; 14(2): 278-87. doi: 10.1590/S1679-45082016RB3582.
20. Madhi S.A., Cunliffe N.A., Steele D., Witte D., Kirsten M., Louw C. et al. Effect of human rotavirus vaccine on severe diarrhea in African infants // N. Engl. J. Med. 2010 Jan 28; 362(4): 289-98. doi: 10.1056/NEJMoa0904797.
21. Madhi S.A., Kirsten M., Louw C., Bos P., Aspinall S., Bouckenooghe et al. A Efficacy and immunogenicity of two or three dose rotavirus-vaccine regimen in South African children over two consecutive rotavirus-seasons: a randomized, double-blind, placebo-controlled trial // Vaccine. 2012 Apr 27; 30(Suppl. 1): A44-51. doi: 10.1016/j.vaccine.2011.08.080.
22. Martinón-Torres F., Greenberg D., Varman M., Killar J.A., Hille D., Strable E.L. et al. Safety, Tolerability and Immunogenicity of Pentavalent Rotavirus Vaccine Manufactured by a Modified Process // Pediatr. Infect. Dis. J. 2017 Apr; 36(4):4 17-422. doi: 10.1097/INF.0000000000001511.
23. Patel M.M., López-Collada V.R., Bulhões M.M., De Oliveira L.H., Bautista Márquez A., Flannery B. et al. Intussusception risk and health benefits of rotavirus vaccination in Mexico and Brazil // N. Engl. J. Med. 2011 Jun 16; 364(24): 2283-92. doi: 10.1056/NEJMoa1012952.
24. Payne D.C., Selvarangan R., Azimi P.H., Boom J.A., Englund J.A., Staat M.A. et al. Long-term Consistency in Rotavirus Vaccine Protection: RV5 and RV1 Vaccine Effectiveness in US Children, 2012-2013 // Clin. Infect. Dis. 2015 Dec 15; 61(12): 1792-9. doi: 10.1093/cid/civ872.
25. Pollard S.L., Malpica-Llanos T., Friberg I.K., Fischer-Walker C., Ashraf S., Walker N. Estimating the herd immunity effect of rotavirus vaccine // Vaccine. 2015 Jul 31; 33(32): 3795-800. doi: 10.1016/j.vaccine.2015.06.064.
26. Rotavirus vaccines. WHO position paper — January 2013 // Wkly Epidemiol. Rec. 2013 Feb 1; 88(5): 49-64.
27. Sana Fatima, Nuzhath Irfana, Sabiha Mirza Mushtaq, Qadri Mohammed Rizwan Masood, Juveriya Parveen, Dr. U. Narayan Reddy et al. A Cross-Sectional Study to Assess Prevalence and Management of Acute Gastroenteritis in Pediatric Inpatients of A Large Teaching Hospital // IOSR Journal Of Pharmacy. 2014 Dec; 4(12): 12-26.
28. Santos V.S., Marques D.P., Martins-Filho P.R., Cuevas L.E., Gurgel R.Q. Effectiveness of rotavirus vaccines against rotavirus infection and hospitalization in Latin America: systematic review and meta-analysis // Infect. Dis. Poverty. 2016 Aug 12; 5(1): 83. doi: 10.1186/s40249-016-0173-2.
29. Soares-Weiser K., Maclehose H., Bergman H., Ben-Aharon I., Nagpal S., Goldberg E. et al. Vaccines for preventing rotavirus diarrhoea: vaccines in use // Cochrane Database Syst. Rev. 2012 Nov 14; 11: CD008521. doi: 10.1002/14651858.CD008521.pub3.
30. Tissera M.S., Cowley D., Bogdanovic-Sakran N., Hutton M.L., Lyras D., Kirkwood C.D. et al. Options for improving effectiveness of rotavirus vaccines in developing countries // Hum. Vaccin. Immunother. 2017 Apr 3; 13(4): 921-927. doi: 10.1080/21645515.2016.1252493.
31. Todd S., Page N.A., Duncan Steele A., Peenze I., Cunliffe N.A. Rotavirus strain types circulating in Africa: Review of studies published during 1997–2006 // J. Infect. Dis. 2010 Sep 1; 202(Suppl.): S34-42. doi: 10.1086/653555.
32. Velázquez R.F., Linhares A.C., Muñoz S., Seron P., Lorca P., DeAntonio R. et al. Efficacy, safety and effectiveness of licensed rotavirus vaccines: a systematic review and meta-analysis for Latin America and the Caribbean // BMC Pediatr. 2017 Jan 13; 17(1): 14. doi: 10.1186/s12887-016-0771-y.
33. Vesikari T., Karvonen A., Ferrante S.A., Ciarlet M. Efficacy of the pentavalent rotavirus vaccine, RotaTeq®, in Finnish infants up to 3 years of age: the Finnish Extension Study // Eur. J. Pediatr. 2010 Nov; 169(11): 1379-86. doi: 10.1007/s00431-010-1242-3.
34. Vesikari T. Intussusception after human rotavirus vaccine // Pediatr. Infect. Dis. J. 2013 May; 32(5): 579-80. doi: 10.1097/INF.0b013e318278bb4e.
35. Wang F.T., Mast T.C., Glass R.J., Loughlin J., Seeger J.D. Effectiveness of an incomplete RotaTeq (RV5) vaccination regimen in preventing rotavirus gastroenteritis in the United States // Pediatr. Infect. Dis. J. 2013 Mar; 32(3): 278-83. doi: 10.1097/INF.0b013e318275328f.

/31.jpg)