Вступ
Кір являє собою висококонтагіозне захворювання вірусної природи. Навіть незважаючи на наявність безпечної й ефективної вакцини, ця хвороба залишається однією з головних причин смерті серед дітей у всьому світі.
У 2017–2018 роках у різних країнах світу та в нашій країні зокрема спостерігається зростання кількості хворих на кір. В Україні на 41-й тиждень від початку 2018 року на кір захворіли 33 165 осіб, серед яких 13 184 дорослі та 19 981 дитина (https://phc.org.ua). Спалах кору, що триває, обумовлений переважно генотипами вірусу B3, D8 та D9, у той же час захворюваність на початку 2000-х років асоціювалась здебільшого з генотипом вірусу кору D6 [1, 2].
Метою даного дослідження було вивчення клінічних особливостей кору в дітей під час спалаху 2017–2018 рр.
Матеріали та методи
Було проведено ретроспективне дослідження 140 історій хвороби дітей, хворих на кір, які були госпіталізовані до міської дитячої клінічної лікарні міста Києва (КМДКІЛ) впродовж епідемічного підйому у 2017–2018 роках.
Статистичний аналіз. Для надання даних розраховувались середні значення (М) та стандартні відхилення (SD). Різниця між кількісними показниками визначалась за допомогою однофакторного або багатофакторного тесту ANOVA, при невідповідності нормальному розподілу та/або незначній кількості варіантів застосовувався критерій Манна — Уїтні; категорійні значення аналізувались за допомогою відношення шансів та тесту хі-квадрат. Статистично значущою вважали різницю при р < 0,05.
Результати
Загалом було проаналізовано 140 історій хвороби дітей, які проходили стаціонарне лікування у КМДКІЛ із діагнозом «кір». Діагноз установлювався на підставі клініко-епідеміологічних даних (контакт із хворим на кір, характерна клінічна картина), підтверджувався дослідженням ПЛР та визначенням специфічних антитіл — IgM.
Вікові та гендерні характеристики пацієнтів наведені в табл. 1.
Вік хворих коливався від 3 місяців до 18 років. У 2017–2018 роках серед госпіталізованих дітей із кором більшість (62,9 %) становили діти шкільного віку. Діти перших 2 років життя становили лише 16,5 % від загальної кількості досліджуваних пацієнтів.
Частка не щеплених від кору становила 72,1 %, та в 4 (2,9 %) вакцинальний статус був невідомий (табл. 2). У групі дітей від 1 до 2 років нещеплені пацієнти становили 75,0 %, від 2 до 5 років — 72,4 %, від 6 до 11 років — 83,3 %, старше 12 років — 55,9 %. Серед хворих на кір були пацієнти, які щеплені в повному обсязі (n = 21 — 15,0 %), та пацієнти, які мали лише одне введення корової вакцини (14 дітей понад 6 років — 10,0 %). Загалом хворих, які отримали хоча б одне щеплення, було 35 (25,0 %). Найбільша частка дітей, хворих на кір, які мали в анамнезі щеплення, спостерігалась у групі дітей старше 12 років — 44,1 %, найменша — у групі дітей 6–11 років — 16,7 %.
/56-1.jpg)
Тривалість стаціонарного лікування в хворих коливалась від 1 до 19 днів (5,96 ± 2,85, M ± SD). Тривалість стаціонарного лікування суттєво не залежала від віку пацієнтів: серед дітей першого року життя вона становила 6,27 ± 2,33 дня (від 4 до 12 днів), серед дітей 1–2 років — 5,58 ± 5,62 дня (від 1 до 19 днів), 2–5 років — 5,62 ± 1,95 дня (від 2 до 11 днів), 6–11 років — 6,11 ± 2,49 дня (від 1 до 16 днів), старше 12 років — 6,12 ± 2,88 дня (від 1 до 13 днів). Серед дітей, які були щеплені від кору (мінімум 1 доза вакцини), тривалість перебування в стаціонарі становила 5,91 ± 2,68 дня (від 1 до 14 днів), серед невакцинованих — 6,00 ± 2,88 дня (від 1 до 19 днів) (p > 0,05 за багатофакторним тестом ANOVA). Тривалість перебування в стаціонарі була суттєво довшою в пацієнтів з ускладненим перебігом кору — 8,65 ± 2,88 дня порівняно з хворими без ускладнень — 5,53 ± 2,37 дня (p < 0,00001 за тестом ANOVA).
У переважної більшості пацієнтів із кором (79,1 %) у клінічній картині були наявні симптоми класичної тріади: кон’юнктивіт, кашель та нежить. Кон’юнктивіт спостерігався у 85,7 % хворих, кашель — у 96,1 %, нежить — у 87,8 %. Інший відомий симптом корової інфекції — плями Копліка, був зафіксований у медичній документації у 126 (90,0 %) пацієнтів.
Лихоманка спостерігалась у всіх пацієнтів. Середній рівень максимального підвищення температури тіла становив 39,3 °С (від 37,5 до 40,5 °С). У 95,2 % хворих максимальне підвищення температури перевищувало 38,0 °С. Середня тривалість лихоманки була на рівні 7,26 дня (7,26 ± 1,88, від 1 до 13 днів). Серед дітей першого року життя рівень максимальної температури тіла дорівнював 38,90 ± 0,67 °С (від 37,5 до 49,6 °С), тривалість лихоманки — 6,50 ± 2,62 дня (від 1 до 10 днів). У категорії дітей від 1 до 2 років підвищення температури досягало 39,30 ± 0,76 °С (від 38,0 до 40,4 °С), тривалість періоду лихоманки — 8,10 ± 2,47 дня (від 4 до 13 днів). Серед пацієнтів від 2 до 5 років, відповідно, показник температури тіла був 39,5 ± 0,57 °С (від 38,1 до 40,3 °С), тривалість періоду лихоманки — 7,10 ± 1,78 дня (від 4 до 12 днів); від 6 до 11 років: температура — 39,30 ± 0,52 °С (від 38,0 до 40,1 °С), тривалість — 7,2 ± 1,4 дня (від 4 до 12 днів); старше 12 років: температура — 39,30 ± 0,48 °С (від 38,5 до 40,5 °С), тривалість — 7,40 ± 2,15 дня (від 3 до 12 днів). Суттєвої різниці за рівнем та тривалістю лихоманки між різними віковими групами хворих не відмічалось (p > 0,05 за тестом ANOVA). У дітей, які були щеплені мінімум однією дозою корової вакцини, рівень температури становив 39,3 ± 0,6 °С (від 37,5 до 40,0 °С), тривалість лихоманки — 6,60 ± 1,74 дня (від 1 до 10 днів). У нещеплених, відповідно, температура — 39,3 ± 0,55 °С (від 38,0 до 40,5 °С), тривалість — 7,50 ± 1,92 дня (від 4 до 13 днів). Тривалість періоду лихоманки була вірогідно довшою в пацієнтів, які не отримували вакцинацію від кору (p = 0,018 за тестом ANOVA).
Середня тривалість продромального періоду в пацієнтів із кором становила 2,96 ± 1,46 дня. При цьому серед дітей першого року життя продромальний період тривав 2,9 ± 1,3 дня, у віковій групі від 1 до 2 років — 2,80 ± 1,34 дня, 2–5 років — 3,00 ± 1,21 дня, 6–12 років — 2,90 ± 1,46 дня, старше 12 років — 3,10 ± 1,78 дня. Ми не виявили суттєвої залежності тривалості продромального періоду від віку (p > 0,05 за багатофакторним тестом ANOVA). У нещеплених осіб продромальний період тривав 3,20 ± 1,48 дня (від 1 до 8 днів) та був вірогідно довший, ніж у щеплених мінімум одним введенням корової вакцини — 2,50 ± 1,31 дня (від 1 до 6 днів) (p = 0,016 за тестом ANOVA).
Висипання були наявні у всіх пацієнтів. В усіх випадках характер висипки був плямисто-папульозний зі схильністю до злиття. У 97,0 % пацієнтів простежувалась етапність появи висипки з характерним поширенням від голови до дистальних відділів кінцівок. У 95,5 % хворих поширення висипань тривало 2 дні, у 1,5 % — 3 дні. Висипка була наявна на шкірі в середньому впродовж 5,55 дня (від 3 до 12 днів). Тривалість висипань суттєво не залежала від вакцинального статусу і становила в нещеплених 5,63 ± 1,73 дня (від 3 до 12 днів), у щеплених (мінімум одне щеплення) — 5,3 ± 1,3 дня (від 3 до 10 днів) (p > 0,05 за тестом ANOVA). У той же час, за результатами нашого спостереження, тривалість висипань залежала від віку дитини. У дітей першого року життя тривалість висипань становила 4,96 ± 1,29 дня, від 1 до 2 років — 6,09 ± 2,11 дня, від 2 до 5 років — 5,60 ± 1,29 дня, від 6 до 11 років — 6,02 ± 1,78 дня, старше 12 років — 5,13 ± 1,44 дня (р = 0,0058 за багатофакторним тестом ANOVA).
Рівень лейкоцитів периферичної крові у хворих коливався від 2,1 до 32,2 Г/л. У 96,3 % хворих при першому дослідженні спостерігався зсув нейтрофілів у бік молодих форм. Відсоток паличкоядерних нейтрофілів при першому дослідженні в день госпіталізації коливався в межах від 1 до 37 % (15,2 ± 7,42 %). Зменшення кількості лейкоцитів спостерігалось переважно впродовж 4–6-го дня захворювання. Підвищений рівень лейкоцитів (більше 9 Г/л) був характерний у проміжку з 6-го по 13-й день від початку хвороби.
Лейкопенія, що належить до найбільш типових лабораторних симптомів кору, спостерігалась практично в кожного п’ятого пацієнта. Загалом серед досліджуваних пацієнтів лейкопенія (рівень лейкоцитів < 4 Г/л) відмічалась у 38 дослідженнях. Лейкопенія реєструвалась у хворих з 2-го по 12-й день від початку хвороби (5,60 ± 1,72 дня). Лейкопенія реєструвалась у пацієнтів всіх вікових груп від 11 місяців до 17 років 11 місяців (8,80 ± 5,01 року). Частота лейкопенії серед щеплених становила 27,0 % і суттєво не відрізнялась від такої серед нещеплених осіб (21,8 %).
У 14,3 % хворих спостерігався ускладнений перебіг захворювання (табл. 2). Ми проаналізували залежність ускладнень від віку пацієнтів. Частота ускладненого перебігу серед дітей першого року життя становила 16,7 %, у віковій групі від 1 до 2 років — 23,1 %, від 2 до 5 років — 17,8 %, від 6 до 11 років — 11,3 %, старше 12 років — 21,3 %. Коливання частоти ускладнень із віком не були статистично значущі. Серед нещеплених хворих частота ускладнень становила 18,1 %, серед щеплених (мінімум 1 введення вакцини) — 15,7 %, відношення шансів 1,09 (0,51–2,34).
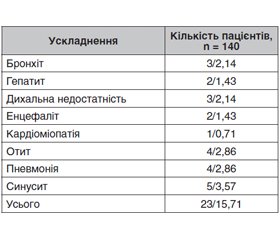
В табл. 3 наведені спектр та частота окремих ускладнень, що спостерігались у наших пацієнтів. Серед виявлених ускладнень переважна більшість (82,9 %) була пов’язана з органами респіраторного тракту.
Бронхіт спостерігався у 8 дітей, серед яких були 3 пацієнти першого року життя, 2 — віком від 2 до 5 років, 2 — від 6 до 11 років та 1 — старше 12 років.
Пневмонія ускладнювала перебіг кору в 7 хворих. В усіх випадках це було вторинне бактеріальне ускладнення. Строки розвитку пневмонії були в межах 4–6 днів (медіана — 6 днів). В усіх випадках пневмонія підтверджувалась рентгенологічно. В одного пацієнта пневмонія ускладнилась плевритом. У 3 дітей пневмонія супроводжувалась дихальною недостатністю та потребувала застосування підтримуючої оксигенотерапії. Серед пацієнтів із пневмонією більшість становили діти старше 12 років (4 хворі) та по одному пацієнту — у вікових групах від 1 до 2 років, від 2 до 5 років та від 6 до 11 років. Бактеріальні ускладнення з боку лор-органів мали місце у 11 хворих. Серед них було 6 випадків синуситу та 5 — середнього отиту. Всі випадки реєструвались серед дітей старше 6 років.
У 2018 році ми спостерігали 2 пацієнтів з ураженням центральної нервової системи. Серед них була дівчинка 5,5 року, не щеплена проти кору, захворювання у якої почалося раптово з підвищення температури до фебрильних цифр, появи катаральних явищ. На 3-й день захворювання з’явилась плямисто-папульозна висипка на обличчі, що протягом наступної доби поширилась по всьому тілу. На 5-й день загальний стан дитини погіршився, стала сонливою, відмовлялася від їжі, самостійно не могла піднятися з ліжка, з’явилися болі в ногах та спині, при цьому висипання на шкірі на цей час зникли. На 6-й день захворювання під час огляду в госпіталі спостерігаються порушення свідомості (13 балів за шкалою Глазго, E4V4M5), при фізикальному обстеженні виявлені позитивні менінгеальні симптоми (ригідність потиличних м’язів, симптоми Керніга та Брудзинського), симптоми натягу корінців спинномозкових нервів (симптом Нері). Продуктивному контакту дитина недоступна. Обличчя симетричне. Бульбарна група черепно-мозкових нервів не порушена. Зіниці D = S, помірно розширені, фотореакція збережена, співдружня. Загальна м’язова гіпотонія. Черевні рефлекси відсутні. Судом та блювання не було. Температура тіла 36,4–36,6 °С. Мікроциркуляція не порушена. Дихання самостійне, ефективне, біомеханіка не порушена, із підтримкою зволоженим киснем через лицьову маску. Частота серцевих скорочень — 58–86 за 1 хв, артеріальний тиск (АТ) утримується на рівні 103/41–83/48 мм рт.ст. Перистальтика збережена. Самостійної дефекації не було. Діурез достатній, на рівні 3 мл/кг/годину. Протягом наступних 3 діб стан свідомості погіршувався. На 9-ту добу хвороби рівень свідомості — 9 балів за шкалою коми Глазго (E4V1M4), посилились прояви брадикардії до 44/хв, спостерігалось зниження АТ до 65/40 мм рт.ст. З 10-го дня хвороби спостерігалось поступове покращання стану дитини. Відновлення рівня свідомості спостерігалось на 12-й день. На 8-й день хвороби отримано результат дослідження IgM до вірусу кору. В аналізі спинномозкової рідини спостерігався незначний лімфоцитарний плеоцитоз, МРТ-дослідження виявило розсіяні вогнищеві зміни. Під час виписки зі стаціонару на 18-й день хвороби в дитини зберігались незначні прояви у вигляді зниження м’язової сили в кінцівках, підвищеної втомлюваності.
Друга дитина, дівчинка 11 років, була госпіталізована в КМДКІЛ із порушенням свідомості (оцінка за шкалою коми Глазго — 9 балів, E4V1M4). Порушень черепно-мозкових нервів, судом не відмічалось. Черевні рефлекси не викликаються. М’язовий тонус знижений. Дихання самостійне, ефективне. Гемодинаміка стабільна. З анамнезу було встановлено, що дитина перенесла кір у віці 9 місяців. 1,5 року тому в дівчинки раптово почались порушення моторної функції у вигляді мимовільного тремору рук, нахилу голови вправо, епізоди мимовільного падіння до 30 разів на добу. У подальшому були періоди погіршення та покращання неврологічного статусу. За 4 дні до госпіталізації в нашу клініку дитина стала більш сонливою, зросла інтенсивність міоклонусів, посилились галюцинаторні реакції. У день госпіталізації в дитини порушилась свідомість до рівня сопору (за шкалою коми Глазго — 9 балів, E4V1M4), при обстеженні в спинномозковій рідині виявлений лімфоцитарний плеоцитоз. При МРТ головного мозку спостерігались ознаки перевентрикулярного лейкоареозу. Результати обстеження спинномозкової рідини на маркери токсоплазмозу, CMV, EBV, VZV, HSV1/2, HHV 6–7 (ПЛР) були негативними, проте був виявлений високий титр антитіл IgG до вірусу кору. Дитина отримувала емпіричну противірусну терапію (ацикловір), імуномодулюючу терапію (кортикостероїди, внутрішньовенний імуноглобулін), підтримуючі та симптоматичні засоби. Проте, незважаючи на лікування, що проводилось, стан дитини прогресивно погіршувався із поступовим розвитком поліорганної недостатності. На 18-й день стаціонарного лікування у хворої на тлі посилення серцевої недостатності та розвитку ДВЗ-синдрому сталась зупинка серцевої діяльності та зафіксована смерть пацієнта.
Прояви ураження печінки ми відмічали у двох пацієнтів у 2017–2018 рр. У них спостерігалось підвищення трансаміназ, зокрема зростання АЛТ понад 2 норми. Клінічних проявів печінкової дисфункції у даних пацієнтів не було. В обох випадках спостерігались спонтанна нормалізація рівня АЛТ, тривалість гіпертрансфераземії не перевищувала 10 днів.
Супутня патологія у хворих на кір зустрічалась у 13,6 % (табл. 2). Ми враховували як преморбідний стан, так і випадки гострих захворювань, що розвивались упродовж перебування пацієнтів із кором у стаціонарі та не були пов’язані з основним захворюванням причинно-наслідковими зв’язками. Супутня патологія була представлена широким спектром хронічних та гострих захворювань, серед яких частіше зустрічався алергічний дерматит (5 випадків), вроджена вада серця (3 випадки), вітряна віспа (3 випадки), дефіцитна анемія (3 випадки), аскаридоз (2 випадки), бронхіальна астма (2 випадки). Серед інших поодиноких випадків слід зазначити пацієнтів із ВІЛ-інфекцією, епілепсією, гемофілією, цукровим діабетом, ревматоїдним артритом, інфекцією сечовивідних шляхів. Ми встановили, що наявність супутньої патології асоціюється з більшою частотою ускладнень. На тлі супутньої патології частота ускладнень становила 34,4 %, а в дітей без супутньої патології — 15,7 % (р = 0,006 за критерієм хі-квадрат).
Обговорення
Рівень захворюваності на кір залежить від багатьох чинників, серед яких ключовим є рівень охоплення профілактичною вакцинацією. Після впровадження в Україні планової вакцинації від кору в 1966–1967 рр. та ревакцинації в 1986 р. рівень захворюваності суттєво знизився, зменшилась частка дітей у структурі хворих та до 5–6 років збільшились міжепідемічні інтервали. Однак після 2008 року рівень охоплення вакцинацією проти кору в Україні знизився менше 95 %, досягнувши мінімуму у 2017–2018 рр. Зокрема, за даними Всесвітньої організації охорони здоров’я, першу дозу корової вакцини у 2017–2018 рр. отримали 42 %, а другу дозу вакцини — лише 31 % дітей [3]. Результати даного дослідження свідчать, що більшість хворих становили нещеплені особи, і, відповідно, причиною епідемічного підйому є зниження охоплення плановою вакцинацією.
Госпіталізація дітей із коровою інфекцією та тривалість перебування в стаціонарі звичайно обумовлюються як клінічними, так й епідеміологічними показаннями. За даними нашого спостереження, тривалість стаціонарного лікування суттєво не залежить від віку пацієнтів та їх вакцинального статусу. Єдиний фактор, що мав вірогідний зв’язок із подовженням часу стаціонарного лікування, був ускладнений перебіг кору. Наші результати за даним показником не мають значних розбіжностей із даними інших досліджень. Зокрема, в роботі К. Lee (2006), в якій аналізуються дані трьох епідемічних спалахів упродовж 1989–2001 років (загалом 520 пацієнтів), тривалість стаціонарного лікування становила від 5,7 до 6,4 дня [4]. В іншому дослідженні вивчалась залежність клінічних характеристик кору, зокрема тривалості стаціонарного лікування, від віку пацієнтів [5]. За його результатами середнє перебування в стаціонарі тривало від 5,1 до 6,0 дня і не залежало від віку дітей.
Лихоманка була постійним симптомом кору. Результати нашого спостереження виявили деякі закономірності даного симптому. Зокрема, за нашими даними, тривалість лихоманки у вакцинованих є суттєво меншою, ніж у невакцинованих.
Тривалість продромального періоду, за нашими спостереженнями, не залежала від віку пацієнтів. Проте ми виявили, що продромальний період був вірогідно довший у нещеплених осіб, ніж у щеплених, мінімум одним введенням корової вакцини.
Щодо тривалості висипань, то, за результатами нашого дослідження, вона має залежність від віку пацієнтів. Так, відносно коротшою вона є в дітей першого року життя та в пацієнтів старше 12 років.
Важливою патогенетичною особливістю кору є депресія імунної системи. Вона асоціюється з розвитком вторинних ускладнень та тяжкістю перебігу захворювання. Хоча досі механізм імунної супресії остаточно не з’ясований, до провідних ланок відносять порушення проліферації лімфоцитів, пригнічення гемопоезу, пошкодження імунологічної пам’яті та руйнування епітеліального бар’єра [6–9]. Лейкопенія — найбільш відомий прояв імунної супресії, корелює з часом появи та вираженістю вірусемії [7]. За результатами нашого спостереження, лейкопенія спостерігалась у більше ніж 22 % пацієнтів. Частіше зниження кількості лейкоцитів припадало на 4–6-й день захворювання.
Імуносупресивна дія вірусу кору безпосередньо пов’язана з розвитком ускладнень. До найбільш важливих та частих ускладнень кору належить пневмонія, частота якої, за даними різних досліджень, коливається від 14 до 66 % [4, 10–12]. Серед наших пацієнтів пневмонія також була відносно частим ускладненням, проте її частота не перевищувала 4,5 %. Ймовірно, це пояснюється більш широкими показаннями до госпіталізації в нашій клініці, що не обмежують перебування в стаціонарі з нетяжкими формами захворювання. Зокрема, в місті Києві під час епідемічного підйому, що тривав у 2017 р. і триває у 2018 р., госпіталізується понад 70 % хворих на кір.
Ураження нервової системи належать до найбільш тяжких ускладнень при корі. Їх розвиток можливий за рахунок прямого ушкодження вірусом, імуноопосередкованого ураження (постінфекційний енцефаліт), а також у вигляді підгострого склерозуючого паненцефаліту [13]. Серед наших пацієнтів ми спостерігали випадок постінфекційного менінгоенцефаліту та підгострого склерозуючого паненцефаліту.
Поширеними ускладненнями кору вважають також ураження печінки. Прояви даного ускладнення можуть коливатись від субклінічної зміни лабораторних показників до проявів фульмінантного гепатиту. За даними опублікованих досліджень, гепатит та дисфункція печінки більш характерні для дітей старше 15 років та дорослих, у яких частота даного ускладнення може досягати понад 80 % [10, 14, 15]. У нашому спостереженні прояви гепатиту відмічалися лише у двох пацієнтів старшого віку (15 та 17 років). В обох випадках печінкові зміни обмежувались лише підвищенням трансаміназ і не супроводжувались клінічною симптоматикою.
Висновки
Під час поточного спалаху у віковій структурі хворих дітей, які госпіталізуються з кором, переважають діти шкільного віку та підлітки.
Серед хворих переважна більшість становлять нещеплені діти.
Клінічні характеристики кору в дітей значною мірою залежать від віку та вакцинального статусу.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Mankertz A., Mulders M.N., Shulga S. et al. Molecular Genotyping and Epidemiology of Measles Virus Transmission in the World Health Organization European Region, 2007–2009 // J. Infect. Dis. — 2011. — 204(Suppl. 1). — Р. 335-342. doi: 10.1093/infdis/jir101.
2. Rota P.A., Brown K., Mankertz A. et al. Global Distribution of Measles Genotypes and Measles Molecular Epidemiology // J. Infect. Dis. — 2011. — 204(Suppl. 1). — Р. 514-523. doi: 10.1093/infdis/jir118.
3. WHO. Ukraine restores immunization coverage in momentous effort to stop measles outbreak that has affected more than 12 000 this year. — 2018. Available at: https://www.euro.who.int/en/countries/ukraine/news/news/2018/05/ukraine-restores-immunization-coverage-in-momentous-effort-to-stop-measles-outbreak-that-has-affected-more-than-12-000-this-year. — Accessed September 30, 2018.
4. Lee K.-Y., Lee H.-S., Hur J.-K., Kang J.-H., Lee B.-C. The changing epidemiology of hospitalized pediatric patients in three measles outbreaks. — 2006. doi: 10.1016/j.jinf.2006.02.016.
5. Lee K.-Y., Lee H.-S., Hur J.-K., Kang J.-H., Lee B.-C. Clinical features of measles according to age in a measles epidemic // Scand. J. Infect. Dis. — 2005. — 37(6–7). — Р. 471-5. doi: 10.1080/00365540510037803.
6. Ludlow M., McQuaid S., Milner D., de Swart R.L., Duprex W.P. Pathological consequences of systemic measles virus infection // J. Pathol. — 2015. — 235(2). — Р. 253-265. doi: 10.1002/path.4457.
7. De Vries R.D., de Swart R.L. Measles immune suppression: functional impairment or numbers game? // PLoS Pathog. — 2014. — 10(12). — e1004482. doi: 10.1371/journal.ppat.1004482.
8. Laksono B.M., de Vries R.D., McQuaid S., Duprex W.P., de Swart R.L. Measles Virus Host Invasion and Pathogenesis // Viruses. — 2016. — 8(8). doi: 10.3390/v8080210.
9. Laksono B.M., Grosserichter-Wagener C., de Vries R.D. et al. In Vitro Measles Virus Infection of Human Lymphocyte Subsets Demonstrates High Susceptibility and Permissiveness of both Naive and Memory B Cells. Dutch RE, ed. // J. Virol. — 2018. — 92(8). — e00131-18. doi: 10.1128/JVI.00131-18.
10. Grammens T., Schirvel C., Leenen S. et al. Ongoing measles outbreak in Wallonia, Belgium, December 2016 to March 2017: characteristics and challenges // Euro Surveill. — 2017. — 22(17). doi:10.2807/1560-7917.ES.2017.22.17.30524.
11. Ge, Zhai X.-W., Zhu Y.-F. et al. Measles Outbreak in Pediatric Hematology and Oncology Patients in Shanghai, 2015 // Chin. Med. J. (Engl.) — 2017. — 130(11). — 1320. doi: 10.4103/0366-6999.206358.
12. Xu Z.W., Chen Y.P., Yang M.J., Li W.C., Liu Q., Lin J. The epidemiological and clinical characteristics of measles in Wenzhou, China, 2000–2010 // Epidemiol. Infect. — 2013. — 142(1). — Р. 1-8. doi:10.1017/S0950268813000411.
13. Fisher D.L., Defres S., Solomon T. Measles-induced encephalitis // QJM. — 2015. — 108(3). — Р. 177-182. doi: 10.1093/qjmed/hcu113.
14. Dinh A., Fleuret V., Hanslik T. Liver involvement in adults with measles // Int. J. Infect. Dis. — 2013. — 17(12). — e1243-4. doi: 10.1016/j.ijid.2013.06.014.
15. Caseris M., Houhou N., Longuet P. et al. French 2010–2011 measles outbreak in adults: report from a Parisian teaching hospital // Clin. Microbiol. Infect. — 2014. — 20(4). — Р. 242-4. doi: 10.1111/1469-0691.12384.

/56-1.jpg)
/57-1.jpg)