/39-1.jpg)
Вступ
У структурі інфекційних захворювань нервової системи важливе місце посідають енцефаліти різної етіології, зокрема герпетичної, що обумовлено тяжкістю клінічних проявів захворювання, виникаючими неврологічними ускладненнями, невизначеними перспективами й прогнозом [1].
Початкові прояви енцефаліту нерідко маніфестують судомами, що є важливим вогнищевим неврологічним симптомом і свідчать про іритативні зміни в центральній нервовій системі (ЦНС) з домінуванням процесів збудження в корі головного мозку, порушення корково-стовбурових взаємин чи недостатність ГАМКергічних гальмівних систем [2].
У сучасній епілептології важливе місце посідає вивчення проблеми симптоматичної епілепсії. Це зумовлено поширеністю вторинних судом у людській популяції внаслідок дії різноманітних причин (травматичні, інфекційні, дисциркуляторні, токсичні), що призводять до ураження головного мозку й формування епілептичного вогнища [3]. Значною проблемою залишається і встановлення причини судом, особливо при нейроінфекційній патології, що на практиці помітно обмежує можливості надання ефективної допомоги таким хворим. Згідно з даними статистики, на 1000 мешканців планети припадає 8–10 осіб, які страждають від епінападів, а на 1 хворого з генуїнною епілепсією припадає 10 пацієнтів з епілептиформним синдромом [4]. У структурі цієї захворюваності близько третини становлять пацієнти з енцефалітом або наслідками перенесеної нейроінфекції герпесвірусної природи, що свідчить про актуальність проблеми.
Відомо, що віруси герпесу, проникаючи в нервові елементи, викликають тяжкі структурні зміни в речовині головного мозку, що неодмінно супроводжується набряком-набуханням нервової тканини, мікроциркуляторними, гемо- й ліквородинамічними порушеннями. Герпесвіруси мають природний тропізм до нейронів і вибірково вражають нервові клітини кори великого мозку, переважно лобні та скроневі, зрідка тім’яні частки, що клінічно проявляється різними психопатологічними й неврологічними симптомокомплексами, зокрема епілептичними нападами. Руйнування нервових клітин і супутня гліальна реакція з обов’язковим залученням у процес мікросудин призводять до утворення рубців, спайок і кіст у нервовій тканині, поширених рубцевих змін у м’яких оболонках і ліквороносних протоках, що є морфологічною й патофізіологічною основою формування епілептичного вогнища (вогнищ) і розвитку симптоматичної епілепсії. Звідси випливає, що поява судом у таких хворих може свідчити як про поточний запальний процес (гострий, рецидивуючий), так і про формування резидуально-органічного епілептичного синдрому після завершення енцефаліту. Розмежування цих станів є надзвичайно важливим моментом у клінічній практиці, бо визначає принципово різне бачення механізмів виникнення епілептичних нападів, відтак диктує відмінну за своєю суттю лікувальну тактику. Якщо при гострому герпетичному енцефаліті чи його рецидиві, що маніфестує судомами, пріоритетним є призначення противірусних препаратів, то у випадку формування резидуально-органічного епілептичного синдрому після завершення запального процесу терапевтичні заходи мають переважно відновний характер, а також спрямовані на правильний вибір протисудомних засобів. Разом з тим максимально точна й своєчасна діагностика активного герпесвірусного процесу та його наслідків, що супроводжуються епілептичними нападами, сприятиме підвищенню ефективності лікування й запобігатиме несприятливим наслідкам.
Матеріали та методи
У міському реабілітаційному центрі нейроінфекцій і київському НДІ епідеміології та інфекційних хвороб ім. Л.В. Громашевського НАМН України під нашим спостереженням перебували 42 хворі, у яких із застосуванням клінічних, анамнестичних, серологічних та інструментальних методів дослідження встановлено герпетичний енцефаліт (ГЕ) або його наслідки. У клінічній картині недуги відзначались різні форми епілептичних нападів. Серед обстежених були 23 чоловіки і 19 жінок віком від 16 до 56 років. Переважали особи молодого віку (33 пацієнти до 38 років). Тривалість хвороби становила від одного місяця до трьох років. У комплексному обстеженні хворих поряд з електроенцефалографією (ЕЕГ) і магнітно-резонансною томографією (МРТ) головного мозку використовували серологічні дослідження крові, спинномозкової рідини (СМР), зокрема імуноферментний аналіз (ІФА) і ДНК-тестування вірусних нуклеїнових кислот методом полімеразної ланцюгової реакції (ПЛР).
Результати та обговорення
На сьогодні спостерігається патоморфоз клінічних проявів ГЕ, що зумовлено негативним впливом чинників довкілля на стан імунної системи, поширенням вторинного імунодефіцитного стану серед населення, розвитком набутої структурно-функціональної неповноцінності гістогематичних бар’єрів, особливо гематоенцефалічного [5]. Зазначені чинники сприяють швидкому доланню вірусами захисних систем із наступним їх проникненням у нервові клітини ЦНС, що може спричиняти нейроінфекційний процес [6]. При цьому патоморфоз клінічного перебігу енцефаліту визначається ступенем і рівнем неспроможності імунних і бар’єрних механізмів, реактивністю імунної системи загалом. У результаті зростає кількість хворих із хронічними й хронічно-рецидивуючими варіантами ГЕ, у яких загальноінфекційні явища й менінгеальні симптоми взагалі не відзначаються [7]. У таких хворих вогнищева неврологічна симптоматика розвивається поступово і в переважній більшості випадків на початку проявляється ураженням кори головного мозку. Ось чому на ранніх етапах захворювання, ще до виникнення вогнищевих неврологічних симптомів, з боку нервової системи так часто спостерігаються іритативні зміни у вигляді епілептичних нападів чи психопродуктивної симптоматики. У зв’язку з труднощами у встановленні правильного діагнозу особливу увагу слід приділити правильній, а головне, своєчасній діагностиці активності герпесвірусної інфекції для встановлення етіології й першопричини хвороби.
Підсумовуючи особливості клінічних проявів ГЕ на сучасному етапі, можна за частотою виникнення умовно окреслити такі три основні симптомокомплекси: астенодепресивний, епілептиформний і галюцинаторно-маячний. Зрозуміло, що на ранніх етапах розвитку ГЕ клінічна симптоматика досить різноманітна й не обмежується лише зазначеними синдромами. На практиці вони рідко виникають у чистому вигляді й часто поєднуються між собою, формуючи складну картину психопатологічних і неврологічних синдромів.
Початкові прояви ГЕ у 20 (47,6 %) хворих із домінуванням астенодепресивного синдрому характеризувались церебрастенічними, психоемоційними й астеновегетативними розладами, які спостерігались ще до появи вогнищевої неврологічної симптоматики чи епінападів. Хворі скаржились на виражену загальну слабкість, швидку втомлюваність, помітне зниження пам’яті, особливо оперативної, порушення сну, що часто супроводжувалось підвищеною запальністю, дратівливістю, немотивованою агресивністю чи, навпаки, психоемоційною млявістю і загальмованістю. При цьому виникала байдужість до оточуючої дійсності, рідних і друзів, звужувалось коло інтересів і вподобань. Характерним було зниження успішності в навчанні й професійній діяльності. На фоні наростаючих змін емоційно-вольових та інтелектуально-мнестичних функцій з’являлись епінапади.
У 15 (35,7 %) хворих домінування в клінічній картині ГЕ епінападів було підставою для виділення епілептиформного синдрому. Так, у період загострення запального процесу на тлі помірно виражених ознак невротичної астенії виникали епілептичні пароксизми, що переважно розпочинались з абсансів чи абортивних судом без втрати свідомості, але з плином часу трансформувались у фокальні або генералізовані судомні напади. Тільки в п’яти хворих ГЕ маніфестував генералізованими судомами при відносно задовільному самопочутті пацієнтів без попередніх передвісників чи з рухової аури. У хворих із завершенням запального процесу формування резидуального-органічного епілептичного синдрому спостерігалось упродовж року й характеризувалось переважно фокальними нападами, зазвичай після провокуючих чинників (перевтома, екзогенна інтоксикація, гіперінсоляція, супутні вірусні інфекції тощо).
У 7 (16,7 %) хворих ГЕ на початку проявлявся помітним зниженням психічної й рухової активності, аж до кататонічного ступору, або дебютував психопродуктивною симптоматикою, що розвивались у динаміці патологічного процесу впродовж кількох тижнів. У клінічній картині галюцинаторно-маячного синдрому домінували істинні слухові (рідше зорові) галюцинації, неприємні, інколи страхітливі, а також маячення переслідування, стосунку й впливу. Такі хворі нерідко потрапляли в психоневрологічний диспансер із помилковим діагнозом делірію, психозу, шизофренії. Заслуговує на увагу той факт, що призначення психотропних, здебільшого нейролептичних, препаратів не давало ефекту й погіршувало стан хворих. При прогресуванні запального процесу продуктивна симптоматика в таких пацієнтів поступово редукувалась і трансформувалась у непродуктивні форми розладів свідомості — сопор і кому. Частіше на цьому етапі перебігу захворювання з’являлась підозра щодо органічної природи походження психопатологічних порушень, і після здійснення МРТ, серологічних і лікворологічних обстежень встановлювався правильний діагноз. Зрозуміло, що запізніле призначення специфічного противірусного лікування далеко не завжди давало бажаний позитивний результат, що було основною причиною зростання кількості ускладнень і несприятливих наслідків.
Як приклад наводимо виписку з історії хвороби № 188.
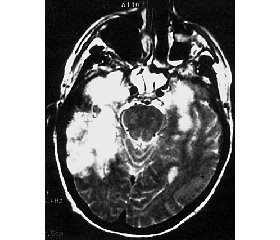
Хвора Н., 46 років. Захворювання розпочалося з появи астенодепресивних і емоційно-вольових порушень, що неухильно наростали впродовж трьох тижнів. Хвору оглянув психіатр, і на тій підставі, що змінам особистості передувала психоемоційна травма, діагностував істеричний мутизм із наступною госпіталізацією в психоневрологічний диспансер. Стан хворої продовжував погіршуватись, з’явились міоклонічні судоми, згодом поодинокі фокальні епілептичні напади. Поглиблювались непродуктивні форми розладів свідомості, аж до ступорозного. Тільки на четвертому тижні захворювання запідозрили органічну основу психопатологічних порушень, виконано МРТ-дослідження головного мозку, при якому в обох гемісферах лобно-скроневих часток встановлено просторі зони зниженої щільності нервової тканини без чітких контурів. При дослідженні методом ПЛР у крові й лікворі виявлено ДНК HSV1, що свідчило про реплікативну активність даного вірусу й підтверджувало етіологію захворювання.
У неврологічному статусі: стан хворої тяжкий, у свідомості, однак продуктивному контакту малодоступна через вогнищеве ураження локалізованих центрів кори головного мозку з порушенням мовленнєвої, гностичної й праксичної функцій. Наявність свідомості без усвідомлення оточуючої дійсності розцінювали як синдром агнозії внаслідок масивного двостороннього ураження кори головного мозку. При цьому відзначалась груба неврологічна симптоматика у вигляді високих сухожилкових і періостальних рефлексів із розширенням рефлексогенних зон, позитивних кистьових феноменів Вартенберга, Россолімо і Вендеровича, випадіння черевних рефлексів, патологічних стопних рефлексів Оппенгейма, Гордона, Шеффера. Тазовий контроль відсутній.
Діагноз: герпетичний енцефаліт, корковий синдром з агнозією, набряк головного мозку, тяжкий підгострий перебіг, епілептиформний синдром із фокальними нападами.
Унаслідок призначення комплексного етіопатогенетичного лікування протягом наступних трьох тижнів у хворої повністю відновилась свідомість і усвідомлення, пам’ять, припинились судоми, самостійно почала себе обслуговувати. Виписана на 40-й день лікування. У неврологічному статусі виявлялась пірамідна недостатність, лобна атаксія й стійкий церебрастенічний синдром.
Діагностика ГЕ чи його наслідків, першопочатковими ознаками якого є епілептичні напади, ґрунтується на клінічних, лабораторних і параклінічних методах обстеження. Так, при МРТ-дослідженні головного мозку в гострому періоді запального процесу в різних відділах кори, субкортикально й перивентрикулярно в білій речовині реєструються множинні дрібні вогнища підвищеної щільності (від 3 до 6 мм), рідше виявляють вогнища діаметром від 2 до 5 см, що не чинять впливу на оточуючу нервову тканину. Вогнища зазвичай розміщені симетрично, мають неправильну форму з нечіткими контурами, можуть супроводжуватись перифокальним набряком. При хронічному перебігу ГЕ поряд із гострими змінами запально-некротичного характеру в нервовій тканині реєструються сформовані органічні дефекти (дрібні кісти, атрофія, гідроцефалія, поренцефалія). Отже, МРТ-дослідження дає змогу виявляти свіжі вогнища запалення та їх наслідки, а потім контролювати динаміку перебігу захворювання, особливо в зіставленні з клінічними даними. Зміни на МРТ спостерігаються досить довго, регресують уже після клінічного покращання й одужання. Збільшення кількості вогнищ на МРТ свідчить про неефективність лікування, що здійснюється. При рецидиві ГЕ з’являються нові ділянки ураження мозкової тканини. Разом з тим відсутність змін при МРТ-дослідженні головного мозку в перші дні захворювання не є аргументом для спростування діагнозу енцефаліту, якщо для цього є ґрунтовні клінічні й лабораторні підстави.
Заслуговує на увагу, що кількість вогнищ запалення та їх розміри не мають вирішального значення у визначенні тяжкості клінічних проявів захворювання. Тяжкість стану хворих, особливості психопатологічних порушень і різновид епінападів більше залежали від темпу розвитку запального процесу з формуванням відповідного клінічного варіанту перебігу захворювання.
Особливу роль у діагностиці ГЕ відіграють методи ПЛР та ІФА, що можуть безпосередньо виявити ознаки активності збудника інфекційного процесу (вірусу з родини герпесвірусів) і підтвердити етіологію захворювання. Для підтвердження герпетичної етіології енцефаліту в клінічній практиці широко використовують ІФА та ДНК-тестування методом ПЛР у різних біологічних середовищах, переважно в сироватці крові й СМР. Разом з тим широка циркуляція вірусів у людській популяції та їх тривала, нерідко довічна персистенція в організмі без будь-яких клінічних проявів, що супроводжується лише антитільною реакцією (імуноглобуліни класу G), зумовлюють труднощі в оцінці отриманих даних [8]. На практиці метод ІФА сам по собі, та ще й у випадку одноразового застосування без визначення антитіл у динаміці, є малоінформативним при хронічних (латентних) герпесвірусних інфекціях, що знецінило саме поняття «діагностичний титр антитіл». Наявність у сироватці крові специфічних противірусних імуноглобулінів G свідчить лише про факт інфікування й антитільну імунну відповідь, але ні в якому разі, навіть при дуже високих титрах антитіл за умови одноразового визначення, не є свідченням активації вірусної інфекції. Більше того, встановлена обернена залежність між висотою так званого діагностичного рівня антитіл класу імуноглобулінів G і наявністю реплікативної форми герпетичної інфекції [9]. Звідси випливає важливий висновок, що за відсутності клінічних і МРТ-даних за ГЕ у хворих з епінападами обґрунтування етіологічного діагнозу лише одноразовим визначенням високого рівня сумарних антитіл класу G у сироватці крові й призначення специфічного противірусного лікування є помилковим рішенням.
Встановлення антитіл класу М у сироватці крові є підтвердженням активації герпетичної інфекції. Варто відзначити, що ці антитіла зберігаються в крові після активації процесу впродовж 30–45 діб.
Ось чому повторне встановлення позитивних протигерпетичних імуноглобулінів упродовж цього терміну не є свідченням продовження активності герпетичної інфекції й необхідності відновлення специфічного лікування у випадку позитивних результатів клінічного перебігу хвороби. Виявлення в СМР протигерпетичних антитіл класу G може свідчити про їх інтратекальне походження. Проте за наявності відповідних клінічних і МРТ-даних призначення противірусного лікування в таких випадках виправдане. Незначна кількість антитіл G у лікворі зазвичай спостерігається при пошкодженні гематоенцефалічного бар’єра та їх проникненні з крові в ліквор і не має діагностичного значення.
Застосування методу ПЛР і виявлення ДНК вірусних патогенів дає змогу чітко розмежувати реплікативні (активні) та хронічні (латентні) форми інфекційного процесу. Ось чому найбільшу цінність мають позитивні результати ДНК-тестування на герпетичну інфекцію в СМР. У зіставленні з клінічними даними (астенодепресивні розлади, епінапади, психопродуктивна симптоматика тощо) це свідчить про реплікативну активність вірусної інфекції й розвиток нейроінфекційного процесу, що потребує безумовного призначення комплексного етіопатогенетичного лікування.
Отже, з’ясування серологічного профілю методом ІФА та ДНК-тестування на вірусні патогени дає змогу підтвердити чи, навпаки, заперечити герпесвірусну етіологію нейроінфекційного процесу, а також розмежувати гострий енцефаліт або його рецидив при хронічному перебігу з наслідками захворювання, що проявляються епінападами. Потрібно підкреслити, що за відсутності відповідних клінічних і МРТ-даних за енцефаліт поодинокі серологічні знахідки можна проігнорувати (вони можуть мати хибнопозитивний характер) і не поспішати з призначенням протигерпетичного лікування «про всяк випадок». Потрібно враховувати, що специфічні противірусні препарати (зовіракс, вальтрекс) проникають лише в клітини з активно реплікуючим вірусом, блокуючи його діяльність, і не діють на латентно інфіковані чи здорові клітини. Ось чому їх призначення з профілактичною метою без урахування активності герпетичної інфекції на підставі результатів ПЛР-діагностики є неефективним і може сприяти формуванню фармакорезистентних штамів вірусів.
У клінічній практиці нерідко трапляються випадки, коли отримати спинномозкову рідину з певних причин неможливо. У такій ситуації за наявності відповідних клінічних даних і при підозрі на загострення хронічного енцефаліту (психопатологічні порушення, фокальні епінапади, абсанси, міоклонії) призначають МРТ-дослідження головного мозку, імунологічні обстеження, визначають серологічний профіль у сироватці крові, здійснюють ДНК-тестування. Позитивні результати ІФА (особливо виявлення IgM або зростання кількості IgG у 2–4 рази в динаміці), а тим більш ПЛР, свідчать про активацію хронічної герпесвірусної інфекції з імовірним залученням у процес нервової системи. У таких випадках, навіть за відсутності характерних запально-некротичних змін у нервовій тканині (які можуть з`явитися згодом), діагностують ГЕ і призначають специфічне противірусне лікування.
Критерії ефективності здійснюваної терапії полягають у регресі вогнищевої неврологічної симптоматики й припиненні вірусної реплікації в сироватці крові при повторному ДНК-тестуванні. Зазначена тактика є цілком виправданою, випливає з інтересів хворого й запобігає тяжким ускладненням.
У лікуванні хворих з резидуально-органічним епілептичним синдромом у результаті перенесеного енцефаліту широко використовували ферментативні, розсмоктувальні, судинні й нейрометаболічні лікарські засоби, а також поліненасичені жирні кислоти. На сьогодні в практичній медицині є значний арсенал медикаментозних препаратів, що покращують обмінно-трофічні процеси в нервовій тканині після перенесеного запального процесу й запобігають виникненню ускладнень, зокрема епінападів.
Так, поліненасичені жирні кислоти (лецитин), ферменти (флогензим і коензим Q10) сприяли відновленню структури клітинних мембран, активізували лізосомальні ферменти, покращували синтез білка мієліну й тим самим стабілізували функцію нервової системи, зокрема біоелектричну активність кори головного мозку. Призначення мексиприму й цитофлавіну стимулювало судинно-метаболічні процеси в мозковій тканині, збільшувало транспорт глюкози в мозок, активувало дихання нейронів, покращувало розумово-пізнавальні функції, а також емоційно-поведінкові реакції.
Включення в комплексне лікування кортексину стимулювало поєднані процеси тканинного дихання й окисного фосфорилювання, сприяло накопиченню АТФ, захищало нейрони від ушкоджуючої дії вільних радикалів, обмежувало процеси перекисного окислення ліпідів, тим самим підвищувало стійкість клітин в умовах гіпоксії. Відзначене лікування разом з протиепілептичними засобами впродовж двох-трьох місяців помітно зменшувало клінічні прояви астеноневротичних розладів, підвищувало психічну й розумову активність, позитивно відбивалось на загальному стані пацієнтів, зокрема перебігу симптоматичної епілепсії.
Після згасання клінічних, параклінічних і лабораторних проявів енцефаліту у випадках продовження епілептичних нападів виникала важлива проблема подальшого лікування пацієнтів в амбулаторних умовах. Для отримання позитивного результату встановлювали форму епілепсії й тип нападів, підбирали диференційовану й індивідуально дозовану фармакотерапію, визначались з оптимальними дозами протисудомних препаратів, тривалістю їх застосування й прагнули до монотерапії. При цьому дотримувались основного принципу епілептології, що полягає в досягненні максимальної терапевтичної ефективності при мінімальних побічних ефектах з відсутністю негативного впливу на якість життя пацієнта [10].
У лікуванні таких хворих перевагу віддавали карбамазепінам і вальпроатам з пролонгованою дією (фінлепсин і депакін ретард), що з-поміж наявного розмаїття антиконвульсантів становлять золотий фонд препаратів для купірування широкого спектра епілептичних нападів [11]. Препарати нового покоління (топірамат, ламотриджин, леветирацетам) застосовували лише у випадках, коли старі препарати першої лінії не давали очікуваного результату. Основну дозу даних засобів розподіляли залежно від домінування судом протягом доби (денний чи нічний час). Разом з тим формат статті не дає змоги детально зупинитися на описі дозування препаратів залежно від форми епілептичних нападів.
Тривалість застосування протисудомних засобів різнилася й насамперед визначалася клінічними критеріями, зокрема відсутністю епілептичних нападів понад три роки. У процесі лікування таких хворих щоквартально здійснювали ЕЕГ і серологічний контроль (ІФА, ПЛР), раз на рік — МРТ-дослідження головного мозку. Відновлення судом і їх видозміна викликали настороженість щодо можливості рецидиву ГЕ та необхідності проведення повторного противірусного лікування з обов`язковим ДНК-тестуванням на герпетичну інфекцію.
Висновки
1. Визначений патоморфоз клінічного перебігу ГЕ засвідчив, що на сьогодні його початкові прояви маніфестують такими психоневрологічними симптомокомплексами: астенодепресивним, епілептиформним і галюцинаторно-маячним. Домінування на ранніх етапах розвитку запального процесу психопатологічних розладів і епілептичних нападів нерідко призводить до діагностичних помилок, непрофільної госпіталізації хворих і несвоєчасного призначення специфічного протигерпетичного лікування.
2. У розпізнаванні ГЕ та його наслідків, що проявляються епілептичними нападами, поряд з клінічними й інструментальними методами обстеження (МРТ, ЕЕГ) потрібно широко застосовувати методи ІФА та ПЛР. Встановлення імуноглобулінів класу М і реплікативної активності вірусу герпесу в лікворі й крові шляхом виявлення фрагментів ДНК свідчить про поточний запальний процес і нагальну потребу призначення специфічного противірусного лікування. Наявність лише імуноглобулінів класу G (одноразово) при негативній ПЛР свідчить на користь наслідків ГЕ з призначенням лише відновного й протиепілептичного лікування.
3. Базовими препаратами в лікуванні генералізованих і фокальних епілептичних нападів у хворих із наслідками перенесеного ГЕ та сформованим резидуально-органічним вогнищем є карбамазепіни й вальпроати. При цьому варто віддавати перевагу препаратам з подовженою (ретардною) формулою дії, зокрема фінлепсину й депакіну ретард, що характеризуються високою клінічною ефективністю й відносно низькою частотою ускладнень у випадках тривалого застосування. Протиепілептичні засоби нового покоління (топамакс, ламіктал, кеппра) потрібно застосовувати лише при торпідних формах епілепсії, після перенесеного ГЕ.
Конфлікт інтересів. Не заявлений.

/39-1.jpg)
/43-1.jpg)