Вступ
Епштейна — Барр вірусна інфекція (ЕБВІ) належить до найбільш поширених інфекційних захворювань людини. Антитіла до вірусу Епштейна — Барр виявляють у 60 % дітей перших двох років життя і 80–100 % дорослих. Сьогодні в усьому світі відзначається збільшення кількості хворих на ЕБВІ, що пов’язано не лише з покращанням якості діагностики, але й зі зростанням їх числа. Захворюваність на гостру форму ЕБВІ в різних країнах коливається від 4 до 45 на 100 тис. населення [1].
В Україні, як і в усьому світі, відмічається тенденція до збільшення дифузних захворювань печінки, що є причиною інвалідизації та смертності людей різного віку. Значною мірою зростання числа хворих на захворювання печінки серед дорослих обумовлено ушкодженнями гепатобіліарної системи в дитячому віці [2].
Етіологічний спектр уражень печінки в дітей більш різноманітний, ніж у дорослих, у цей період не відзначається домінування вірусних гепатитів В і С.
У літературі широко обговорюється роль вірусу Епштейна — Барр у розвитку хронічного гепатиту як тригерного агента автоімунного гепатиту [3]. Є підтвердження ролі вірусу Епштейна — Барр у розвитку гранульом у печінці [4] та навіть рідкісного «синдрому жовчних протоків, що зникають» [5].
Повідомляється про випадки гострої печінкової недостатності, що спричинена вірусом Епштейна — Барр, із летальністю до 87 % [6].
Патогенетичний механізм, що викликає деструкцію гепатоцитів і розвиток холестазу при EБВІ, до кінця не з’ясований. Є припущення про те, що вірус Епштейна — Барр не чинить прямої цитопатичної дії, а руйнування гепатоцитів викликається токсичною дією вільних радикалів, що беруть участь у перекисному окислюванні ліпідів [7]. Описано механізм антитілозалежного цитолізу клітин, що вражені вірусом Епштейна — Барр: цитоліз розвивається під впливом Т-супресорів і природних кілерів.
При жовтяничних формах гострого Епштейна — Барр вірусного гепатиту ДНК вірусу Епштейна — Барр виявляється переважно в CD3-, CD4- і СD8-лімфоцитах, тоді як при інфекційному мононуклеозі в пацієнтів без жовтяниці в основному інфіковані В-лімфоцити периферичної крові, що вказує на можливу участь Т-лімфоцитів у розвитку тяжких форм гострого Епштейна — Барр вірусного гепатиту. Є повідомлення про те, що при тяжких жовтяничних формах Епштейна — Барр вірусного гепатиту інфікуються вірусом Епштейна — Барр саме Т-клітини інфільтрату, а не гепатоцити [8].
У формуванні ізольованого ураження гепатоцитів при Епштейна — Барр вірусному гепатиті важливу роль може відігравати й безпосередня дія збудника в крові у випадку парентерального інфікування.
Проблема лікування ЕБВІ на сьогодні залишається актуальною й потребує індивідуального й комплексного підходу з урахуванням патогенетичних особливостей захворювання, наявних імунологічних змін, ступеня тяжкості хвороби, віку дитини, клінічних особливостей тощо [9, 10].
У літературі відсутні єдині підходи до лікування, що пов’язано з невизначеністю деяких ланок патогенезу. Це стосується й проблеми ураження печінки.
Більшість авторів пропонують застосовувати у хворих препарати гепатопротекторної дії, але досвіду їх застосування в дітей з ураженням печінки при ЕБВІ недостатньо. З огляду на механізм дії щодо цього найбільш привабливо виглядають препарати урсодеоксихолієвої кислоти (УДХК). Парні молекули УДХК зав–дяки гідрофільній групі (7β-гідроксил) вбудовуються у фосфоліпідний шар клітинної мембрани гепатоцитів і холангіоцитів, відновлюючи структуру клітин і підвищуючи стійкість до пошкоджуючих факторів дії вірусів.
Багатогранні ефекти УДХК забезпечують широкий спектр терапевтичних можливостей використання препарату.
УДХК являє собою жовчну кислоту, що утворюється в кишечнику й печінці та становить 0,1–5 % від загального пулу жовчних кислот людини. УДХК є нетоксичною кислотою, що обумовлене гідрофільністю її молекули.
При лікуванні препаратами УДХК відбувається зміщення пропорцій складових частин жовчі в бік переважання УДХК над іншими жовчними кислотами. Позитивний вплив УДХК пов’язується з витісненням токсичних жовчних кислот з ентерогепатичної циркуляції (шляхом конкурентного гальмування всмоктування в клубовій кишці) і запобіганням їх шкідливій дії на мембрани [11–13].
Виявлено цитопротективну дію УДХК, що обумовлена здатністю вбудовуватися в мембрани гепатоцитів, у результаті чого зменшується продукція на поверхні гепатоцитів антигенів HLA I класу, що запобігає розвитку автоімунних реакцій (імуномодулююча дія).
УДХК має жовчогінну дію внаслідок холегепатичного шунта (повернення з канальців до синусоїдальної мембрани через перибіліарні сплетіння) [11, 14].
УДХК знижує літогенність жовчі внаслідок формування рідких кристалів з молекулами холестерину, запобігає виникненню холестеринових каменів і розчиняє їх. Окрім того, препарат знижує всмоктування холестерину в кишечнику й синтез його в печінці, екскрецію останнього в жовч.
Дослідження довели, що УДХК витісняє пул токсичних гідрофобних жовчних кислот за рахунок конкурентного захоплення рецепторами в клубовій кишці й стимулює екзоцитоз у гепатоцитах шляхом активізації Са-залежної протеїнкінази. Це призводить до зменшення концентрації гідрофобних жовчних кислот та індукує гідрокарбонатний холерез, посилюючи виведення гідрофобних жовчних кислот у кишечник [15].
Деякі автори [16] повідомляють про зменшення експресії молекул HLA I класу на гепатоцитах і HLA II класу на холангіоцитах, а також про зниження продукції прозапальних цитокінів (ІЛ-1, ІЛ-2, ІЛ-6, фактор некрозу пухлини альфа, інтерферон гамма) під дією УДХК.
Антиоксидантні властивості УДХК, описані в літературі, обумовлені зміною метаболізму простагландинів і жирних кислот, їх впливом на регенерацію печінки через систему цитокінів [17].
Механізми дії УДХК не вичерпуються перерахованими. Вони кардинально доповнилися в кінці XX й на початку XXI століття такими властивостями, як анти–апоптичні, антифібротичні й антиканцерогенні, що дозволило не обмежуватися застосуванням УДХК тільки в гематології.
Зважаючи на виявлені нами у хворих з ЕБВІ синдроми ураження печінки (збільшення розмірів, наявність симптомів цитолізу, зміни щільності паренхіми за даними УЗД і виражені прозапальні зміни концентрації інтерлейкінів, мікро-РНК), ми вдосконалили терапію препаратом УДХК.
Метою нашої роботи було дослідження ефективності й безпечності застосування удосконаленого комплексу в дітей з інфекційним мононуклеозом Епштейна — Барр вірусної етіології.
Матеріали та методи
У Київській міській дитячій клінічній інфекційній лікарні було обстежено 60 дітей віком від 1 до 18 років із інфекційним мононуклеозом (ІМ) Епштейна — Барр вірусної (ЕБВ) етіології. Усіх хворих спостерігали й обстежували протягом гострого періоду хвороби. Функціональний стан печінки визначався шляхом дослідження основних печінково-клітинних ферментів (аланінамінотрансферази (АЛТ), аспартатамінотрансферази (АСТ), лужної фосфатази (ЛФ), лактатдегідрогенази (ЛДГ), гамма-глутамілтрансферази (ГГТ), ти–молової проби, рівня загального білірубіну, загального білка, альбуміну, протромбінового показника).
Хворі були розподілені на 2 групи.
У першій групі (основна) діти (n = 35) отримували базисну терапію ІМ ЕБВ-етіології в поєднанні з урсодеоксихолієвою кислотою. У нашій роботі ми використовували препарат УДХК вітчизняного виробництва — Укрлів суспензію. Доза УДХК становила 10 мг/кг/добу. 1 мірна ложка суспензії Укрлів (5 мл) містить 250 мг УДХК. Суспензія пацієнтами приймалася всередину ввечері перед сном. Тривалість прийому препарату становила 28 днів. За необхідності, залежно від лабораторних показників, курс лікування тривав до 3 місяців.
У другій групі (контрольна) діти (n = 25) отримували базисну терапію ІМ ЕБВ-етіології. Вона включала: режим; симптоматичну терапію (жарознижувальні, протибольові препарати); при синдромі тонзиліту, приєднанні вторинної бактеріальної інфекції — антибіотики.
Рандомізація хворих за групами дослідження була проведена методом випадкових чисел. Статистична обробка отриманих результатів проводилася з використанням сучасних методів медичної статистики за допомогою MS Excel 2007. Визначали середні показники (t-тест Стьюдента), стандартні відхилення (М ± m). Оцінку терапії проводили за допомогою методу однофакторного дисперсійного аналізу. Різницю частот визначали за методом оцінки різниці між частотами появи ознаки в окремих серіях спостереження.
Дизайн дослідження: проспективне рандомізоване порівняльне післяреєстраційне клінічне дослідження в паралельних групах.
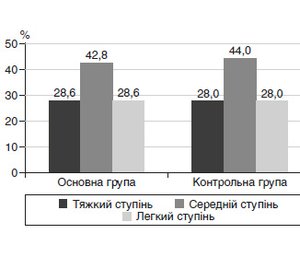
Розподіл дітей за ступенем тяжкості в обох групах наведено на рис. 1.
Результати та обговорення
Ураження печінки спостерігалося в усіх дітей. Аналіз скарг і даних об’єктивного обстеження показав, що в усіх дітей захворювання починалося гостро.
Лихоманка, тонзиліт, лімфаденопатія, гепатомегалія відзначалися в 100 % хворих, спленомегалія — у 60,0 %, аденоїдит — у 86,8 %, екзантема — у 26,8 % хворих. Ступінь вираженості інтоксикаційного синдрому залежав від тривалості й тяжкості захворювання.
Клінічні прояви ураження печінки в обстежених дітей характеризувалися: зниженням апетиту (100 % хворих), болем у животі (75 %), нудотою (55 %), болем у правому підребер’ї (28,3 %), блюванням (20 %), жовтяницею склер (18,3 %), жовтяницею шкіри (13,3 % хворих).
Підвищення АЛТ спостерігалося у 70 % хворих дітей, АСТ — 62,5 %, ЛДГ — 65 %, ГГТ — 50 %, ЛФ — 77,5 %, тимолової проби — 18,8 %, білірубіну загального — у 17,5 % хворих дітей (рис. 2).
Нами отримані дані, які свідчать про те, що удосконалена терапія інфекційного мононуклеозу в дітей ЕБВ-етіології з ураженням печінки при використанні суспензії Укрлів сприяє більш швидкому темпу регресії основних симптомів інфекції, таких як лихоманка, зниження апетиту й жовтяниця, вже на 7-й день від початку лікування (рис. 3).
На 7-й день від початку лікування в 76,0 % пацієнтів контрольної групи зберігалася лихоманка, а в основній групі — тільки в 45,7 % дітей (p < 0,05).
Зниження апетиту відзначалося на 7-й день від початку лікування в 92,0 % хворих контрольної групи й 37,1 % — основної групи. Жовтяниця шкіри відмічена в 16,0 % дітей контрольної групи й 8,6 % пацієнтів основної групи (p < 0,05). Спленомегалія — у 60 та 45,7 % дітей відповідно (p > 0,05).
На 28-й день від початку лікування в дітей основної групи в жодному випадку не було зареєстровано лихоманки, зниження апетиту чи жовтяниці, на той час як у пацієнтів контрольної групи ці симптоми зберігалися в 16,0; 8,0 і 4,0 % відповідно (p < 0,05).
Гепатоспленомегалія відзначалася у 45,7 % дітей основної групи й 92,0 % пацієнтів контрольної групи (p < 0,05). Спленомегалія — у 31,4 і 48,0 % відповідно (p > 0,05).
Включення в комплексну терапію інфекційного мононуклеозу ЕБВ-етіології, що супроводжується ураженням печінки з холестазом, суспензії Укрлів сприяє також більш швидкій нормалізації показників функціонального стану печінки (АЛТ, білірубін, ЛФ, ГГТ, ЛДГ).
На 7-й день від початку лікування вірогідна динаміка відзначена з боку показника АЛТ (рис. 5), який залишався підвищеним у 76,0 % дітей контрольної групи й 37,1 % пацієнтів основної групи (p < 0,05).
На 28-й день від початку лікування в основній групі загальний білірубін сироватки крові нормалізувався в усіх обстежених (рис. 6), АЛТ залишалася підвищеною лише в 14,3 % дітей, ЛФ — у 8,6 %, ГГТ — у 8,6 % пацієнтів, ЛДГ — у 14,3 % обстежених. У той же час у дітей контрольної групи АЛТ залишалася підвищеною у 56,0 %, ЛФ — у 28,0 %, ГГТ — у 32,0 %, ЛДГ — у 36,0 % і загальний білірубін сироватки крові — у 4,0 % пацієнтів (p < 0,05).
Висновки
Отже, включення препарату Укрлів у вигляді суспензії в схему лікування хворих з інфекційним мононуклеозом ЕБВ-етіології з ураженням печінки дозволяє підвищити ефективність удосконаленої терапії захворювання порівняно з базисною терапією.
Препарат Укрлів суспензія переносився добре, відмови від лікування серед пацієнтів не було, побічних реакцій не спостерігалося.
Включення в комплексну терапію інфекційного мононуклеозу ЕБВ-етіології, що супроводжується ураженням печінки, препарату Укрлів суспензія сприяє більш швидкому регресу симптомів інфекції, таких як лихоманка, гепатоспленомегалія, жовтяниця.
Включення в комплексну терапію інфекційного мононуклеозу ЕБВ-етіології, що супроводжується ураженням печінки, препарату Укрлів суспензія також сприяє більш швидкій нормалізації показників функціонального стану печінки, а саме АЛТ, рівня білірубіну, ЛФ, ГГТ, ЛДГ.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Kramarev SA, Litvinenko NG, Palatnaja LA. Jepshtejna-Barr-virusnaja infekcija u detej. Sovremennaja pediatrija. 2004;34(5):13-18. (in Russian).
2. Denisova MF. Nauchno prakticheskie prioritety detskoj gepatologii. Suchasna gastroenterologіja. 2009:6(50);115-119. (in Russian).
3. Raynard B, Вalian A, Fallik D, et al. Risk factors of fibrosis in alcohol-induced liver disease. Hepatology. 2002;2(35):635- 638.
4. Bantel H, Schulze-Osthoff K. Apoptosis in hepatitis C virus infection. Cell Death Differ. 2003;10(suppl 1):48-58.
5. Gorbig MN, Gines P, Bataller R, et al. Human hepaticAtellate cells secrete adrenomedullin: potential autocrine factor in the regulation of cell contractility. J Hepatol. 2001;2(34):222-229.
6. Feldmann G. Liver apoptosis. J Hepatol. 1997;26(2):1-11.
7. Faulkner GC, Krajewski AS, Crawford DH. The ins and outs of EBV infеction. Trends in Microbiology. 2000;8:185-189.
8. Kramarev SA, Vygovskaja OV. Hronicheskie foromy Epshtejna-Barr virusnoj infekcii u detej: sovremennye podhody k diagnostike i lecheniju. Sovremennaja pediatrija. 2008;2(19):103-108. (in Russian).
9. Feranchak AP, Tyson RW, Narkewicz MR, et al. Fulminant Epstein-Barr viral hepatitis: orthotopic liver transplantation and review of the literature. Pediatric Liver Center and Liver Transplantation Program, The Children's Hospital, Denver, CO, USA. Liver Transpl Surg. 1998;4:469-476.
10. Maeda A, Wakiguchi H, Yokoyama W, et al. J. Infect. Dis. 1999;179(4):1012-1015.
11. Volkova GI. Еpshtejna-Barr virusnyj gepatit u detej: avtoref. dis. na soiskanie nauchnoj stepeni kand. med. nauk: spec. 14.01.08. Moscow: 2013. 20 р. (in Russian).
12. Serov BB, Aprosina ZG. Hronicheskij virusnyj gepatit. Moscow: Medicina; 2002. 383 р. (in Russian).
13. Friedman SL., Maher JJ, Bissell DM. Mechanism and the–rapy of hepatic fibrosis: report of the AASLD Single Topic Basic Research Conference. Hepatology. 2000;32:1403-1408.
14. Janeczko J. Immunomodulatory treatment of lymphopenia after infectious mononucleosis. Przeql Epidemiol. 2001;55(4):433-441.
15. Urazova OI, Pomogaeva FP, Novickij VV. Infekcionnye bolezni. 2004;2(4):17-21. (in Russian).
16. Gubergric NB, Lukashevich GM, Fomenko PG. Zhelchnyj refljuks: sovremennye teorija i praktika. Moscow; 2014. 36 р. (in Russian).
17. Kikuchi K, Miyakawa H, Abe K, et al. Vanishing bile duct syndrome associated with chronic EBV infection. Dig Dis Sci. 2000;45:160-165.

/45-1.jpg)
/45-2.jpg)
/46-1.jpg)
/47-1.jpg)