Вряд ли в хирургии можно выделить проблему более древнюю и более актуальную, чем проблема перитонита. Научно-технический прогресс, достижения хирургии, анесте–зиологии, реаниматологии и иммунологии, антибиотикотерапии, к сожалению, не раз–решили ее, и мы продолжаем терять больных. Анализ литературных источников свидетельствует о высокой летальности при данном заболевании, которая колеблется от 15 до 80 %, и отсутствии тенденции к ее снижению [1, 3, 4, 13]. Наиболее высокая летальность наблюдается при послеоперационном перитоните — от 45 до 92,8 %, вероятнее всего, это связано с присоединением внутрибольничных штаммов микроорганизмов, обладающих высокой антибиотикорезистентностью.
Воспаление — это одна из древнейших и универсальных форм ответной реакции макроорганизма на действие повреждающего фактора (механического, термического, химического, ишемического и других). Участие микроорганизмов придает воспалению характер инфекционного процесса, в котором воплощается диалектическая сложность взаимодействия факторов жизнеобеспечения макро–организма с различными экологическими факторами. Одним из ярких примеров воспаления является перитонит.
Перитонит — острое воспаление брюшины, сопровождающееся высокой интоксикацией, одно из наиболее тяжелых осложнений заболеваний и повреждений органов брюшной полости с высокой летальностью. Актуальность проблемы перитонита обусловлена его широкой распространенностью, высокой летальностью, сложностью и множественными нарушениями гомеостаза при перитоните [3, 8].
По данным различных авторов, от 15 до 25 % заболеваний органов брюшной полости осложняются перитонитом.
В этиологии и патогенезе перитонита еще много неясных и спорных вопросов. По определению В.В. Москаленко и соавт. [11], перитонит является аутоинфекционным полимикробным заболеванием. Считается, что основной причиной перитонита является проникновение микробов в брюшную полость, хотя накопилось много фактов, свидетельствующих о том, что наличие микроорганизмов в брюшной полости не всегда определяет развитие перитонита. Однако в возникновении перитонита играют роль количество поступивших микроорганизмов, вирулентность и патогенность микробов, снижение реактивности организма и др.
Микробиологический компонент является одним из ведущих факторов развития эндогенной интоксикации при перитоните. Совершенствование методических подходов к микробиологическим исследованиям позволило более широко изучить микрофлору в очаге воспаления. При этом высветилась роль неклостридиальных анаэробных возбудителей в этиопатогенезе гнойного перитонита.
Доказано, что перитонит является полимикробным заболеванием и в его этиологии большую роль играют анаэробные неклостридиальные возбудители, что диктует необходимость создания препаратов, направленных против аэробно-анаэробных микроорганизмов.
Лечение перитонита является сложной проблемой и должно быть комплексным. От грамотного, последовательного, свое–временного включения новых подходов в процесс лечения каждого конкретного больного зависит исход заболевания.
Программа лечения перитонита всегда индивидуальна, однако его принципиальная схема универсальна и включает следующие звенья:
I. Предоперационный период:
— дренирование желудка назогастральным зондом;
— катетеризация мочевого пузыря, учет количества мочи;
— катетеризация большой вены (кубитальной, подключичной);
— коррекция гомеостаза;
— обезболивание;
— антибактериальная терапия;
— очистительная клизма.
II. Оперативное вмешательство:
— удаление патологического содержимого из брюшной полости;
— введение в корень брыжейки тонкой кишки 0,5% р-ра новокаина 100–150 мл;
— выявление и удаление источника перитонита;
— интраоперационная санация брюш–ной полости в зависимости от распространенности повреждений;
— дренирование тонкой кишки с помощью назоэнтерального зонда при наличии показаний;
— выбор метода завершения операции (дренирование брюшной полости, активная лапаростомия).
III. Послеоперационный период:
— коррекция нарушений гомеостаза;
— антибактериальная терапия;
— восстановление моторной функции кишечника;
— дезинтоксикация;
— иммунокоррекция;
— компенсация энергетических и пластических потребностей организма;
— профилактика осложнений.
IV. Период реабилитации.
Вторым по значимости в программе лечения перитонита, после оперативного вмешательства, является рациональная антибиотикотерапия (АБТ).
Выбор АБТ у хирургических больных с гнойно-септическими осложнениями является одной из важных проблем. Это связано прежде всего с постоянно меняющимся видовым составом микрофлоры и ее чувствительностью к антибиотикам.
По данным многих авторов, доминирующим микроорганизмом при перитоните является кишечная палочка (от 30 до 65 %) в ассоциации с другими микро–организмами — стафилококками, энтеро–кокками, стрептококками, синегнойной палочкой, протеем, клебсиеллами и др.
По нашим данным, при микро–биологическом исследовании экссудата из брюшной полости больных с разлитым и общим перитонитом, в токсической или терминальной стадии в 2015 г. доминирующими микроорганизмами также оказались E.coli, Pr.mirabilis, St.aureus, St.epidermidis, St.saprophyticus и др. (анаэробы не определяли).
Решающую роль в достижении результатов лечения играет стартовая адекватная антимикробная терапия, основанная на эмпирическом и деэскалационном принципах.
Перитонит, как сказано выше, является полимикробным заболеванием, при котором чаще всего выделяются ассо–циации грамположительных и грам–отрицательных аэробных и анаэробных микроорганизмов, в связи с чем в клинике принято комбинированное сочетание антибиотиков, направленное на борьбу с синергирующими аэробными и анаэробными возбудителями. До получения микробиологического диагноза перитонита и определения чувствительности микрофлоры к антибиотикам при выраженном синдроме эндогенной интоксикации мы назначаем антибиотики широкого спектра действия (стартовая, эмпирическая АБТ), меропенемы, фторхинолоны III–IV поколения, полусинтетические пенициллины (ампициллин, ампиокс), цефалоспорины III–IV поколения (Сульбактомакс), аминогликозиды и препарат против анаэробных возбудителей метронидазол до получения результатов микробиологического исследования, с последующим соблюдением принципа деэскалационной АБТ, что является одним из путей борьбы с анти–биотикорезистентностью.
Что касается дозы антибиотиков, то мы придерживаемся принципа АБТ — сила лечения должна соответствовать клиническому проявлению болезни.
Применяемые антибиотики должны обладать способностью проникать в зоны инфекции, создавая там бактерицидные концентрации, иметь широкий спектр действия, охватывать аэробные и анаэробные возбудители. При лечении тяжелых форм гнойно-некротических осложнений необходимо применять комбинированную антибактериальную терапию.
За эти годы открыто более 1000 антибиотиков, но применяются в клинической практике около 45, имеющие 6500 наименований, что затрудняет работу клиницистов.
Проведение рациональной АБТ, являющейся важным компонентом в комплексном лечении перитонита, в усло–виях широкого распространения антибиотикорезистентности — сложная задача. При выборе схем АБТ учитывают данные о микробиологической активности препаратов, их переносимости и фармакокинетике.
Одна из самых актуальных и сложных проблем в медицине — это неуклонный рост резистентности микроорганизмов к различным антибактериальным препаратам (АБП) [7, 14, 15]. По мнению многих исследователей, антибиотикорезистентность достигла критического уровня [5]. Резистентность — неизбежное биологическое явление, связанное с высокими адаптационными способностями микроорганизмов, которое возникло с начала антибиотической эры, прогрессивно увеличивается, и задача ученых — находить пути ее предотвращения. В 2009 г. H.W. Boucher отметил проблемных возбудителей: Enterococcus faecium, Staphylоcoccus aureus (MRSA), Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa, Entero–bacter spp. [16].
Всемирная организация здраво–охранения 2011 год назвала годом борьбы с анти–биотикорезистентностью.
Резистентность к антимикробным препаратам неуклонно растет, приводя ежегодно к миллионам смертей [27].
Бета-лактамаза была выделена в 1940 году из кишечной палочки [20]. Бета-лактамазы — группа бактериальных ферментов, способных бороться с бета-лактамными антибиотиками, наиболее широко применяемыми в медицинской практике (пенициллины, цефалоспорины и др.).
В своей статье М.В. Бондар и соавт. (2016) приводят классификацию бета-лактамаз, что весьма важно с практической точки зрения в клинической практике.
Бета-лактамазы в настоящее время разделяют на 4 молекулярных класса — А, В, С, D:
— плазмидные бета-лактамазы класса А стафилококков — гидролизуют природные и полусинтетические пенициллины, чувствительны к ингибиторам;
— плазмидные бета-лактамазы широкого спектра класса А –грамотрицательных бактерий — гидролизуют природные и полусинтетические пенициллины, цефалоспорины I поколения, чувствительны к ингибиторам;
— плазмидные бета-лактамазы расширенного спектра (БЛРС) класса А грамотрицательных бактерий — гидролизуют природные и полусинтетические пенициллины, цефалоспорины I–IV поколений, чувствительны к ингибиторам;
— хромосомные бета-лактамазы класса С грам–отрицательных бактерий — гидролизуют природные и полусинтетические пенициллины, цефалоспорины I–III поколений, нечувствительны к ингибиторам;
— хромосомные бета-лактамазы класса А грам–отрицательных бактерий — гидролизуют природные и полусинтетические пенициллины, цефалоспорины I–II поколений, чувствительны к ингибиторам;
— хромосомные бета-лактамазы класса В грам–отрицательных бактерий — эффективно гидролизуют практически все бета-лактамные антибиотики, включая карбапенемы, нечувствительны к ингибиторам;
— плазмидные бета-лактамазы класса D грам–отрицательных бактерий (преимущественно Ps.aerugi–nosa) — гидролизуют природные и полусинтетические пенициллины, цефалоспорины I–III поколений, в большинстве случаев нечувствительны к ингибиторам.
Наибольшее значение для клинической практики имеют плазмидные БЛРС (бета-лактамазы расширенного спектра) грамотрицательных бактерий, они способны разрушать цефалоспорины III поколения БЛРС, продуцируют микро–организмы рода Klebsiella, E.coli, Proteus spp. При нозокомиальных инфекциях, вызванных Enterobacter spp., Citrobacter spp. и некоторыми другими микроорганизмами, в процессе лечения цефалоспоринами III поколения формируется резистентность к этим антибиотикам, которая связана с гиперпродукцией хромосомных бета-лактамаз класса С. В таких случаях следует назначать це–фалоспорины IV поколения (цефепим) и карбапенемы [18, 19, 22].
Предполагается, что бета-лактамазы классов А, С и D эволюционировали из бактериальных пенициллинсвязывающих белков в почвенных экосистемах в результате селективного прессинга бета-лактамных антибиотиков, продуцируемых некоторыми микроорганизмами.
Следует отметить, что активность АБ непостоянна и это обусловлено формированием резистентности, которая является неизбежным биологическим явлением и связана с высокими адаптационными способностями микроорганизмов [24].
Ведущими механизмами резистентности микроорганизмов к АБ принято считать:
— изменение мишени воздействия АБ;
— ферментативную инактивацию АБ;
— активное выведение антибиотиков из микробной клетки (эффлюкс — активное выведение препарата из микробной клетки вследствие включения стрессорных механизмов защиты);
— нарушение проницаемости микробной клетки для АБ;
— формирование метаболических шунтов.
Резистентность к АБП не носит универсального характера. Наиболее выраженная резистентность микроорганизмов к АБП наблюдается в отделениях интенсивной терапии и реанимации, гнойной хирургии, в ожоговых центрах (внутрибольничные штаммы, которые, как правило, обладают резистентностью ко многим антибиотикам, в том числе и к меропенемам).
Известно, что резистентность бывает природная (конститутивная) и приобретенная (индуцибельная); последняя возникает спонтанно вследствие генетических мутаций и чаще всего обусловлена тремя факторами:
— модификацией мишени действия на уровне микробной клетки, которая постоянно меняется;
— активным выталкиванием препарата из микробной клетки;
— существованием микроорганизмов в виде биологических пленок (коммуникативные сообщества), между которыми происходит постоянный обмен информацией с помощью диффундирующих сигнальных молекул [26, 29].
Диффундирующие сигнальные молекулы бактерии осуществляют обмен информацией путем мониторинга своей популяционной плотности, защиты своей экологической ниши, координации своего поведения в соответствии с изменившимися условиями внешней среды, а также путем «наблюдения» за другими коммуникативными сообществами [21].
Следует отметить, что вторичная лекарственная устойчивость возникает в процессе лечения (часто в результате бессистемного лечения, применения малых доз, несоблюдения принципов анти–биотикотерапии).
От частой «встречи» микроорганизмов с антибио–тиками у бактерий вырабатывается устойчивость к антибактериальным препаратам, что приводит к формированию полирезистентных бактерий. Это связано с длительным применением одних и тех же антибиотиков в том или ином стационаре.
Антибиотикотерапия делится на 2 этапа: эмпирический и этиотропный.
Адекватная стартовая (эмпирическая) АБТ является важным, зачастую определяющим фактором исхода заболевания.
В основе данного принципа лежит назначение антибиотика с наиболее широким спектром действия с параллельным определением микробиологической флоры в очаге и ее чувствительности к фармакотропным антибиотикам с последующим назначением антибактериальных препаратов согласно чувствительности выделенных микроорганизмов — этиотропной АБТ.
В последние годы появился новый принцип интенсивной антибиотикотерапии критических состояний, получивший название деэскалационной терапии.
Принципы указанной терапии определены на международной конференции «Хирургические инфекции: профилактика и лечение» в Москве (2003).
Принципы деэскалационной терапии следующие: выделение возбудителя и определение его чувствительности к антимикробным препаратам; оценка и модификация стартовой терапии на основании результатов микробиологического исследования; оценка клинической эффективности проводимой стартовой терапии; индивидуализация длительности терапии с учетом характеристик пациента и динамики клинической картины инфекции.
Деэскалационная терапия проводится в 2 этапа.
Первый этап предполагает использование антибиотика широкого спектра действия (эмпирическая АБТ).
Второй этап заключается в собственно деэскалации АБТ, направленной на максимальное уменьшение вероятности появления резистентных штаммов микроорганизмов и осуществление возможно более эффективного с экономической точки зрения лечения. После выделения возбудителя инфекции и его чувствительности к антибиотикам появляется возможность перейти на применение антибиотиков с узким спектром активности или, при необходимости, завершить курс антибактериальной терапии.
В клинической практике достаточно часто нарушаются правила очередности применения антибактериальных средств, неверно подбираются дозы препаратов, и в результате уже на догоспитальном этапе лечения больных с хирургическими инфекциями происходит формирование устойчивых штаммов микроорганизмов.
Способами повышения эффективности АБТ могут быть следующие:
— если антибиотик направлен против возбудителя, он должен применяться в достаточной дозе, его концентрация в организме должна быть высокой и поддерживаться постоянно на этом уровне;
— основным принципом рациональной антибиотикотерапии считается выработка правильных показаний к ней. По данным США, в 90 % случаев антибиотики назначают необоснованно;
— оптимальным фактором при назначении антибиотиков является микробиологическое подтверждение диагноза (антибиотикограмма);
— сила лечения должна соответствовать выраженности симптомов болезни. Вся система лечения должна быть адекватна характеру гнойно-септического процесса;
— следует четко соблюдать интервалы введения антибиотиков;
— при назначении антибиотиков –основным принципом является диф–ференцированный отбор препаратов;
— при тяжелом сепсисе, перитоните, менингите и других тяжелых, быстро прогрессирующих болезнях рекомендуется массивная терапия большими дозами;
— весь план лечения и сроки применения анти–биотиков должны быть обусловлены нозологической характеристикой болезни;
— длительная антибиотикотерапия должна проводиться на фоне витаминотерапии.
Приводим опыт лечения пациентов с острой патологией органов брюшной полости в хирургическом отделении № 2 КГКБ № 6 в течение 2015 года.
В 2015 году в хирургическое отделение госпитализировано 3400 больных, оперировано 2546 (74,8 %). С острой патологией органов брюшной полости оперированы 1245 (48,9 %), из них с ослож–ненной перитонитом — 931 (74,8 %) и распределены по нозологии так: острый аппендицит — 778 (83,8 %), перфоративная язва — 46 (4,9 %), перфорация опухоли кишки — 31 (3,3 %), острый холецистит — 25 (2,8 %), острая кишечная непроходимость — 15 (1,6 %), абсцесс брюшной полости — 8 (0,8 %), травма брюшной полости — 6 (0,6 %), тромбоз мезентериальных сосудов — 5 (0,5 %), острый панкреатит — 3 (0,3 %), ущемленная грыжа — 2 (0,2 %), разные причины были у 12 (1,2 %) больных (рис. 1).
Больные с перитонитом были в возрасте от 18 до 90 лет. Мужчины составили 53,7 %, женщины — 46,3 %. Таким образом, среди больных перитонитом подав–ляющее большинство — мужчины.
82,6 % больных перитонитом — люди трудоспособного возраста, что обусловливает социальную проблему.
Среди причин перитонита острый аппендицит занимает первое место и составляет 83,8 %, на втором месте — перфоративная язва желудка и ДПК (4,9 %).
Перитонит возникает на фоне исходной гиперер–гической реакции организма, проявлением которой является острый деструктивный процесс в брюшной полости.
В основу классификации перитонита, которую предложил К.С. Симонян (1971), положена гиперергическая реакция организма на повреждающий фактор. Автор разделил перитонит на стадии (фазы): реактивную, токсическую, терминальную.
Одна из самых выраженных манифестаций эндогенной интоксикации наблюдается при токсической и терминальной стадии перитонита и обусловлена нарушением эвакуаторной, секреторной и всасывающей функции кишечника [6].
Выбор метода лечения и способа завершения хирургического вмешательства, а также выбор рациональной антибиотикотерапии зависит от стадии перитонита и его распространенности (табл. 1).
Как видно из табл. 1, у большинства больных (796 пациентов (85,5 %)) отмечается местный перитонит; диффузный, разлитой и общий перитонит отмечается у 135 пациентов (14,5 %).
При изучении моторно-эвакуаторной функции желудочно-кишечного тракта в первые сутки после операции отмечается отсутствие перистальтики у всех больных в токсической и терминальной стадиях, то есть динамическая кишечная непроходимость сохранялась и в послеоперационном периоде, что обусловило возникновение диспептических явлений.
Одним из критериев эффективности лечения перитонита и своевременной диагностики осложнений являются лабораторные исследования.
В связи с активацией процессов белкового катаболизма и снижением экскреторной функции почек отмечено достоверное увеличение в сыворотке крови мочевины.
Наибольшую диагностическую ценность имеет такой показатель, как уровень молекул средней массы (МСМ) в сыворотке крови, который находится в коррелятивной зависимости от стадии перитонита и от характера заболевания, которое является причиной перитонита.
Наиболее низкое содержание МСМ в сыворотке крови отмечено в токсической стадии перитонита, у больных с острым холециститом (1116,2 ± 176,2), а наиболее высокое — у больных с острой кишечной непроходимостью, осложненной перитонитом (1596,2 ± 239,2). При перфорации или повреждении полого органа уровень МСМ в токсической стадии по сравнению с реактивной повышается в 1,9 раза, а в терминальной — в 2,5 раза. Высокое содержание МСМ отмечено при после–операционном перитоните в обеих стадиях (токсической и терминальной).
В динамике все эти показатели изменялись не однотипно и находились в коррелятивной зависимости от течения перитонита и возникновения осложнений.
Стоит отметить, что уровень МСМ является объективным показателем, отражающим уровень токсемии, однако это исследование является сложным и не всегда есть возможность для его выполнения. Достаточно объективно течение перитонита, возникновение осложнений отражают такие показатели, как лейкоцитоз, СОЭ, уровень мочевины и другие.
В гемограмме чаще всего наблюдались однотипные изменения. Характерным является лейкоцитоз, сдвиг лейкоцитарной формулы влево. Лейкопения является плохим прогностическим признаком. Анемия возникает чаще всего у больных в терминальной стадии перитонита.
Практически у всех больных с разлитым и общим перитонитом, особенно в токсической и терминальной стадии, отмечалась диспротеинемия, что свидетельствует о нарушении динамического равновесия в протеиназно-ингибиторной системе. Отмечалась гипопротеинемия, гипоальбуминемия, снижение альбумино-глобулинового коэффициента. Безлимитный эндогенный протеолиз способствует возникновению и накоплению в сыворотке крови продуктов промежуточного и конечного метаболизма белка.
Важная роль в выявлении гнойно-септических осложнений в раннем после–операционном периоде отводится лабораторным данным, в основном динамике лейкоцитоза, скорости оседания эритроцитов (СОЭ), билирубина, общего белка, мочевины.
При исследовании уровня лейкоцитов наблюдается его повышение перед операцией во всех группах больных. Достоверное повышение лейкоцитоза отмечается на 7–9-е сутки у больных с нагноением послеоперационной раны, такая же тенденция отмечается в динамике лейкоцитарного индекса интоксикации (ЛИИ).
Клинические признаки интоксикации (тошнота, повышение температуры, тахикардия, желудочковая экстрасистолия, общая слабость, головная боль, сон–ливость, раздражительность, неадекватность) были более выражены при повышенном показателе ЛИИ.
У всех больных при ЛИИ 3,0 и более отмечались выраженные явления интоксикации. У большинства больных с высоким показателем ЛИИ в периферической крови выявлялись плазматические клетки Тюрка. Довольно часто их появление совпадало с исчезновением эозинофилов и резким уменьшением количества лимфоцитов. Можно допустить, что у этих больных ЛИИ отражал не только степень интоксикации, но и состояние иммунобиологических сил организма. В процессе лечения в группе больных с неосложненным течением перитонита на 7–9-е сутки ЛИИ достоверно снижался, однако сохранялся на высоких цифрах по сравнению со здоровыми. Часть больных указанной группы на 9-е сутки выписалась из стационара с повышенным ЛИИ.
Одним из объективных показателей течения перитонита и возникновения осложнений является скорость оседания эритроцитов (СОЭ). В послеоперационном периоде имело место существенное повышение СОЭ, особенно у больных с токсической или терминальной стадией перитонита.
СОЭ зависит от соотношения между фибриногеном и глобулином (особенно гамма-глобулином), с одной стороны, фибриногеном и альбумином — с другой. В итоге распада клеток при перитоните указанные соотношения сдвигаются в сторону крупномолекулярных белков — фибриногена и глобулина, несущих меньший электрический заряд, чем мелкодисперсные белки; они меньше отталкиваются друг от друга. Эритроциты в такой ситуации лучше склеиваются между собой и быстрее выпадают в осадок.
Значения ЛИИ и СОЭ у больных с неблагоприятным течением перитонита или возникновением нагноения послеоперационной раны значительно превышают эти показатели у больных с не–осложненным течением перитонита.
Летальность при терминальной стадии перитонита колеблется от 42 до 92–100 %.
По нашим данным, терминальная стадия перитонита у пациентов с острой патологией органов брюшной полости, госпитализированных в хирургическое отделение для лечения больных с хирургическими гнойными заболеваниями и осложнениями КГКБ № 6 в течение 2015 года, наблюдалась в 129 случаях, что составило 21,5 %.
Умерло 16 больных с диагнозом «перитонит», что составляет 33,3 % от всех умерших. У всех умерших больных отмечалась терминальная стадия перитонита.
Одной из причин неудовлетворительных результатов лечения больных перитонитом является поздняя госпитализация. Причиной летальных исходов были гнойно-септические осложнения и полиорганная недостаточность.
Антибиотикорезистентность возбудителей перитонита в настоящее время является глобальной проблемой, существенно лимитирующей эффективность стандартных режимов эмпирической терапии. Поэтому представляется перспективным создание комбинации цефалоспоринов III поколения с ингибиторами бета-лактамаз.
К ингибиторам бета-лактамаз относятся клавулановая кислота (клавуланат), сульбактам, тазобактам, авибактам и др. Клавулановая кислота обладает способностью связываться с пенициллинсвязывающими белками (ПСБ) грамположительных и грамотрицательных бактерий, в результате чего происходит лизис бактериальной стенки, однако клавулановая кислота проявляет минимальную активность по отношению к Pseudomonas aeruginosa и энтерококкам, при этом наибольшая активность отмечается против бактероидов, стафилококков, стрептококков, хламидий, легионелл.
Сульбактам — вещество β-лактамной природы, способен, жертвуя собой, необратимо связываться с β-лактамазами и таким образом ингибировать их активность. Сульбактам, кроме того, обладает антибактериальной активностью, преимущественно против Acinetobaсter spp. и микроорганизмов рода Bacteroides и Neisseria. Механизм действия сульбактама заключается в том, что он проникает в бактериальную клетку и вызывает инактивацию ферментов бактерий путем создания связи с бета-лактамазами бактерий, происходит ацетилирование с последующим гидролизом созданного комплекса, тем самым обеспечивается доступ к микробной клетке, что вызывает ее гибель.
Сульбактам ингибирует ферменты грамотрицательных бактерий — Klebsiella pneumoniae, Bacteroides fragilis, Escherichia coli, а также ингибирует бета-лактамазы Staphylococcus aureus, что весьма важно с хирургической точки зрения, так как указанные микроорганизмы наиболее часто выделяются у хирургических больных, в том числе и при перитоните.
Цефтриаксон — цефалоспориновый АБ III поколения, оказывает бактерицидное действие за счет ингибирования синтеза клеточной стенки бактерий. Препарат имеет широкий спектр противомикробного действия, который включает различные аэробные и анаэробные грамположительные и грамотрицательные микроорганизмы.
После внутримышечного введения цефтриаксон быстро и полностью всасывается, биодоступность составляет 100 %. Максимальная концентрация в плазме крови отмечается через 1,5 ч. Обратимо связывается с альбуминами плазмы крови (85–95 %). Препарат длительно сохраняется в организме. Минимальные антимикробные концентрации определяются в крови в течение ≥ 24 ч. Цефтриаксон легко проникает в органы и жидкости организма (перитонеальную, плевральную, синовиальную, спинномозговую), а также в костную ткань, что определяет широкий круг показаний для его применения. Период полувыведения составляет 5,8–8,7 ч и значительно удлиняется у лиц в возрасте > 75 лет (16 ч), детей (6,5 дня), новорожденных (до 8 дней). В активной форме выделяется (до 50 %) почками в течение 48 ч, частично выводится с желчью. Важно, что цефтриаксон и сульбактам не взаимодействуют между собой и не изменяют фармакокинетические показатели друг друга.
Одним из таких комбинированных препаратов является цефтриаксон 1000 мг/сульбактам 500 мг — Сульбактомакс (Mili Healthcare, Великобритания), который обладает широким спектром действия по отношению ко многим микроорганизмам и, что особенно важно, по отношению к E.coli как доминирующему возбудителю при перитоните, в том числе Acinetobacter spp., B.fragilis, N.gonorrhoeae. Кроме того, он обладает стойкостью к бета-лактамазам и металло-бета-лактамазам: препятствует быстрому распространению БЛРС/МБЛ-опосредованной антибиотикорезистентности. Обладает расширенным спектром активности, включая грамотрицательную флору, такую как Acinetobacter baumannii, дает возможность щадящего использования карбапенемов для терапии БЛРС-флоры, не имеет значимых побочных эффектов.
Область клинического применения цефтриаксона/сульбактама не отличается от таковой цефтриаксона. Добавление к нему сульбактама — синтетического сульфона пенициллановой кислоты — повышает микробиологическую активность комбинации за счет связывания сульбактама с пенициллинсвязывающими белками, на которые не действует цефтриаксон, и расширяет спектр антибактериальной активности за счет микроорганизмов, вырабатывающих цефалоспориназы. Комбинированный препарат Сульбактомакс представляется более эффективной альтернативой незащищенным цефалоспоринам в лечении пациентов с острой патологией органов брюшной полости. Ингибиторозащищенный цефтриаксон Сульбактомакс расширяет возможности терапии проблемных пациентов, в частности при перитоните и сепсисе.
Высокую эффективность Сульбактомакса в клинической практике при лечении отита отметили M.P. Ragunath et al. [12, 25]. Проведено многоцентровое клиническое исследование эффективности Сульбактомакса в лечении инфекций органов дыхания и мочевыводящих путей [28]. Получены положительные результаты применения Сульбактомакса при острой негоспитальной пневмонии у детей. В.Г. Майданик [9], Л.О. Мальцева и соавт. сообщают о клинической и бактерио–логической эффективности Сульбактомакса при лечении тяжелого сепсиса [10].
Мы имеем опыт применения Сульбак–томакса в комплексном лечении перитонита, который назначаем внутривенно, по 1,5–3 грамма каждые 12 часов. Сульбак–томакс показал хорошую эффективность, что дает основание рекомендовать его применение как стартовую терапию в комплексном лечении перитонита.
С целью изучения эффективности –Сульбактомакса у пациентов с хирургической абдоминальной инфекцией нами проведено экспериментальное исследование.
Материалы и методы
Исследование проводилось на 60 белых крысах-самцах линии Vistar. Всем животным смоделировали гнойную рану (абсцесс). После оперативного вмешательства (хирургическая обработка гнойного очага) выполняли бактериологическое исследование раневого содержимого с определением анти–биотикочувствительности выделенных микроорганизмов, среди которых были Pr.mirabilis, E.coli, E.faecalis, St.epidermidis, E.cloacae, St.aureus.
Частота выделения микроорганизмов была следующей: Pr.mirabilis встречался в 45,5 % ран, E.coli — в 68,2 %, E.faecalis — в 77,3 %, St.epidermidis — в 22,7 %, E.cloacae — в 9,1 %, St.aureus — в 72,7 % (рис. 2).
Монокультуры выделили в 27,3 % ран, микробные ассоциации выделялись со следующей частотой: 2 микроорганизма встречались в 22,7 % ран, 3 микроорганизма — в 40,9 %, 4 микроорганизма — в 9,1 %.
Выделенные штаммы вышеуказанных микроорганизмов определяли чувствительность к следующим антибиотикам: оксациллину, ампициллину, цефазолину, цефтриаксону, цефепиму, имипенему, меропенему, эртапенему, офлоксацину, ципрофлоксацину, лево–флоксацину, моксифлоксацину, ванко–мицину, тейкопланину, линезолиду, амикацину, тобрамицину, фосфомицину, Сульбактомаксу.
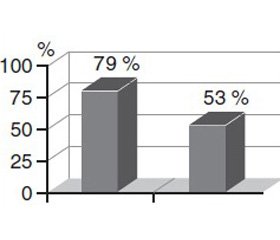
Отмечена высокая чувствительность выделенных микроорганизмов к лево–флоксацину, меропенему, ванкомицину и Сульбактомаксу (рис. 3–6).
/34-1.jpg)
Проведенное нами исследование демонстрирует высокую чувствительность Сульбактомакса к выделенным у экспериментальных животных патогенам.
Выводы
1. Перитонит является сложной проблемой в абдоминальной хирургии. Острые заболевания органов брюшной полости осложняются перитонитом в 74,8 % случаев, с летальностью 33,3 %. Причиной летальных исходов были гнойно-септические осложнения и поли–органная недостаточность. Основной причиной неудовлетворительных результатов является позднее обращение больных за медицинской помощью.
2. Лейкоцитоз, МСМ, ЛИИ, СОЭ являются объективными критериями течения воспалительного процесса в брюшной полости и эффективности лечения.
3. Сульбактомакс — оригинальный препарат, может применяться для стартовой антибактериальной терапии, что позволяет получить инновационный, качественно новый уровень терапевтического действия в сравнении с терапевтическим эффектом от применения незащищенного цефтриаксона.
4. Сульбактомакс вводится 1–2 раза в сутки, внутривенно или внутримышечно, и может применяться с рождения ребенка. Доза антибиотика зависит от возраста и тяжести заболевания. Все это является обоснованием применения Сульбактомакса для стартовой терапии различных заболеваний, в том числе при перитоните и сепсисе.
5. Для преодоления антибиотикорезистентности необходимо:
— четко определять показания к антибиотикотерапии, не назначать антибиотики с профилактической целью;
— строго соблюдать принципы рациональной антибиотикотерапии;
— производить смену антибиотиков в процессе лечения согласно антибио–тикограмме;
— для борьбы с нозокомиальными инфекциями производить смену антибиотиков, применяемых в стационарах, каждые 3 года;
— создавать новые антибиотики или их сочетания с существующими анти–биотиками.
Конфликт интересов. Не заявлен.

/31-1.jpg)
/31-2.jpg)
/34-1.jpg)