Всемирная организация здравоохранения (ВОЗ) и Продовольственная сельскохозяйственная организация ООН (ФАО) в 2014 году опубликовали многокритериальный рейтинг риска заражения пищевыми паразитами. Экспертная группа провела огромное исследование, в котором учитывались риск заражения тем или иным гельминтом, тяжесть клинической картины, вызванная паразитом, прогноз для жизни человека после перенесенного заболевания. На основании этого ими был подготовлен рейтинг самых опасных пищевых паразитов. Мы на страницах журнала хотим показать вам десятку лидеров этого списка.
5-е место среди самых опасных пищевых паразитов
Криптоспоридиоз
Шифр МКБ-10: A07.2
Криптоспоридиоз — паразитарное протозойное заболевание рода Cryptosporidium типа апикомплексы.
История открытия
В 1907 г. Тиццер, проводя научно-исследовательскую работу, впервые обнаружил и описал криптоспоридии в слизистой оболочке желудка лабораторных мышей. Начиная с 1970 г. криптоспоридии были обнаружены в желудочно-кишечном тракте и дыхательных путях большинства млекопитающих, птиц, рыб и рептилий [10]. Первый случай заболевания криптоспоридиозом у человека описан в 1976 г. В настоящее время известно около 20 видов криптоспоридий, хозяевами которых являются различные животные. Человек — хозяин только одного вида криптоспоридии (С.parvum), но строгой специфичности хозяев нет [11, 14].
Строение
Ооцисты криптоспоридий самые мелкие (от 4,5 × 5 до 6,25 × 5,5 мкм). Особенность строения ооцисты криптоспоридий заключается в том, что она содержит в себе по 4 не защищенных оболочкой спорозоита.
Жизненный цикл
Жизненный цикл паразита включает в себя половой и бесполый циклы, которые проходят в организме одного хозяина, в результате чего в окружающее пространство выделяются инвазивные зрелые ооцисты.
Развитие
После заглатывания ооцист хозяином их оболочка разрушается и из нее выходят 4 подвижных спорозоита. Достигая микроворсинок слизистой оболочки, спорозоиты образуют паразитоформную вакуоль. Внутри вакуоли формируются трофозоиты, из которых формируются меронты I и II типов (рис. 1). Меронты I типа имеют бесполое размножение, меронты II типа образуют ооцисты со спорозоитами внутри. Ооцисты существуют двух видов: с толстыми стенками — выделяются с фекалиями во внешнюю среду, и с тонкими стенками, оболочка которых легко разрушается в кишечнике, в результате чего высвобождаются спорозоиты, что приводит к аутоинвазии.
Эпидемиология
Источники инвазии — человек и различные животные. Механизм заражения — фекально-оральный. Пути передачи — водный, алиментарный, контактно-бытовой. Восприимчивость к криптоспоридиозу невелика. Иммунокомпетентный организм легко осво–бождается от возбудителя. В то же время криптоспоридиоз является СПИД-индикаторным заболеванием, так как у пациентов с иммунодефицитами криптоспоридии вызывают тяжелые заболевания, нередко приводящие к летальному исходу.
Патогенез
При попадании криптоспоридий в тонкий кишечник начинается размножение паразита и обсеменение слизистой оболочки, что вызывает поражение энтероцитов [1, 7, 11]. Отмечаются дегенеративные изменения эпителия, кратерообразные вдавления на поверхности клеток, частичная или тотальная атрофия микроворсинок энтероцитов. Это приводит к уменьшению всасывающей поверхности кишечника, замедляется усвоение питательных веществ, воды и электролитов. Одновременно с этим повышается бактериальная ферментация углеводов и жирных кислот, увеличивается осмолярность. Развивается мальабсорбция, осмотическая гиперсекреция, возникает водянистая диарея и обезвоживание организма с потерей массы тела.
Клиническая картина
Инкубационный период продолжается от 4 до 14 дней. Спектр клинических проявлений криптоспоридиоза достаточно широк. Прежде всего он зависит от иммунологического статуса пациента. Основным и наиболее типичным клиническим проявлением заболевания как у пациентов с нормальной иммунной системой, так и с иммунодефицитными состояниями является профузная водянистая диарея [16, 18].
У пациентов с нормальной иммунной системой диа–рея развивается, как правило, остро, продолжается от нескольких дней до 2 нед., после чего всегда проходит самостоятельно. В противоположность этому у больных СПИДом диарея развивается постепенно, протекает тяжелее (в среднем 3–6 л в сутки, реже — до 20 л в сутки), может продолжаться несколько месяцев и часто приводит к угрожающему жизни пациента обезвоживанию и электролитным нарушениям. Диарея сопровождается повышением температуры тела до 38 °С, редко — выше, общей слабостью, головной болью, снижением аппетита, у части больных — тошнотой и рвотой. В то время как у пациентов с нормальной иммунной системой симптоматика криптоспоридиоза ограничивается только диареей, при иммунодефицитных состояниях может наблюдаться как кишечная, так и внекишечная симптоматика, связанная с поражением дыхательных путей, поджелудочной железы и желчевыводящих путей.
Респираторное инфицирование сопровождается кашлем, затруднением дыхания и одышкой, охриплостью голоса. При этом у пациентов не обязательно имеется поражение кишечника.
Криптоспоридиоз желчевыводящих путей может проявляться холециститом, значительно реже — гепатитом и склерозирующим холангитом, что клинически проявляется лихорадкой, болью в правом подреберье, желтухой, тошнотой, рвотой и диареей. Могут повышаться уровень билирубина, активность щелочной фосфатазы и трансаминаз. Диагностика билиарного криптоспоридиоза основана на биопсии и обнаружении различных стадий развития криптоспоридий в желчевыводящих путях. Поражение криптоспоридиями поджелудочной железы встречается крайне редко. Описано лишь 8 таких случаев у ВИЧ-инфицированных пациентов.
Бронхолегочный (респираторный) криптоспоридиоз характеризуется лихорадкой, лимфаденопатией, длительным кашлем со скудной слизистой, реже — слизисто-гнойной мокротой, одышкой, цианозом. В мокроте можно обнаружить ооцисты криптоспоридий. При биопсии выявляется метаплазия поверхностных эпителиальных клеток бронхов. У больных СПИДом описана и двусторонняя интерстициальная пневмония, обусловленная криптоспоридиями. Ооцисты при этом выявляют в альвеолярных макрофагах. Респираторный криптоспоридиоз завершается смертью больных, несмотря на массивную химиотерапию [8, 15].
Осложнения
При длительной диарее и выраженном обезвожи–вании возможно развитие гиповолемического шока.
Дифференциальная диагностика
В исследуемых мазках ооцисты криптоспоридий следует отличать от других возбудителей, вызывающих энтериты молодняка. Ооцисты эймерий в мазках — различной формы, значительно крупнее криптоспоридий, внутри бывают различимы 4 спороцисты, содержащие по 2 спорозоита. Яйцо гельминта — крупное, овальное, круглое или бочонковидное, с оболочкой сложного строения.
В связи с достаточно неспецифичными клиническими проявлениями энтерита криптоспоридиозной этиологии его следует отличать от энтеритов инфекционной природы, определять ведущую роль возбудителей в их возникновении. Л.А. Небайкиной (2001) предложен способ ориентировочного выявления ведущего возбудителя энтерита в окрашенных по Граму мазках-отпечатках со слизистой оболочки кишечника телят (табл. 1).
Диагностика
Диагноз на криптоспоридиоз устанавливают на основании лабораторных исследований фекалий (прижизненно) и патологического материала (посмертно) с учетом эпизоотологических, клинических и патологоанатомических данных.
Паразитологический метод
Для исследования в лабораторию направляют:
— свежие пробы фекалий массой около 10 г из прямой кишки, взятые от 10–20 подозреваемых в заболевании животных, пробы исследуют в день отбора;
— пробы патматериала от трупов — соскобы и мазки-отпечатки из пораженных мест кишечника или участки тонкого кишечника, которые необходимо исследовать не позднее 6 ч после гибели животного.
Приготовление мазка из свежих фекалий. На обезжиренное предметное стекло наносят каплю фекалий, разбавляют каплей физиологического раствора, распределяют тонким слоем (без нажима!). Полученный мазок высушивают при комнатной температуре.
Применение флотационных методов. Пробу фекалий массой 3 г помещают в стакан объемом 50 мл, заливают небольшим количеством насыщенного раствора хлорида натрия (400 г на 1 л горячей воды, плотность раствора — 1,18 г/мл) или сульфата цинка (400 г на 1 л воды, плотность раствора — 1,24 г/мл) или смесью Павласека (хлорид цинка — 220 г, хлорид натрия — 210 г, вода — 800 мл). Тщательно размешивают палочкой, добавляют раствор до краев стакана, фильтруют через сито и отстаивают в течение 15–20 мин. Затем металлической петлей снимают 15–20 капель с поверх–ностной пленки, переносят на предметное стекло, делают тонкий мазок и высушивают на воздухе [11, 18].
Применение центрифугирования в сочетании с флотацией. Пробу фекалий массой 3 г помещают в стакан емкостью 50 мл, добавляют 15 мл воды, размешивают, фильтруют через металлическое сито, переливают в центрифужную пробирку и центрифугируют при 2000–3000 об/мин в течение 1–2 мин. Надосадочную жидкость сливают, к осадку добавляют один из флотационных растворов, указанных выше, перемешивают и снова центрифугируют при том же режиме. Металлической петлей снимают 15–20 капель с поверхностной пленки, переносят на предметное стекло, делают тонкий мазок и высушивают на воздухе.
Фиксация мазков. На высушенный мазок наносят несколько капель этилового (метилового) спирта и фиксируют в течение 10–15 минут до полного испарения спирта. Затем мазок окрашивают одним из следующих способов.
Окраска мазков по Цилю — Нильсену. Для приготовления карболового фуксина Циля в ступку вносят фуксин основной — 2 г, добавляют 2–3 капли глицерина, растирают, тщательно перемешивают при постепенном добавлении спирта этилового 96° — 12 мл, карболовой кислоты — 5 г и воды дистиллированной — 100 мл. Раствор сливают в склянку с плотной пробкой, помещают на сутки в термостат при температуре 37 °С и фильтруют через бумажный фильтр.
Зафиксированные мазки окрашивают в течение 20 мин в растворе карболового фуксина, промывают в проточной воде, слегка высушивают и наносят на стекло 7–10% раствор серной кислоты на 30–60 секунд для обесцвечивания. Затем промывают в проточной воде и докрашивают мазок 5% раствором малахитового зеленого в течение 1–2 минут [10].
Окраска мазков сафранином по Кюстеру. Готовят отдельно 3% раствор сафранина и 5,6% раствор гидро–ксида калия (КОН) в дистиллированной воде. Перед применением готовят рабочий раствор: берут 5 капель свежеприготовленного раствора сафранина и смешивают с 1,5 мл раствора КОН.
Фиксированный мазок окрашивают рабочим раствором сафранина в течение 5 мин, промывают водой, обесцвечивают 0,5% раствором серной кислоты в течение 15 секунд, промывают водой, докрашивают 5% раствором малахитового зеленого на 10% этиловом спирте в течение 10–15 секунд, промывают водой, высушивают на воздухе.
Окраска мазков по Романовскому — Гимзе. Рабочий раствор краски готовят из расчета 1–3 капли готовой краски на 1 мл воды (рН = 7,0–7,2). На один препарат используют 3–4 мл разведенной краски.
Окрашивают фиксированные мазки в течение 20–30 мин, после чего их промывают дистиллированной водой и высушивают [10, 14].
Оценка результатов окраски. Высушенные мазки просматривают под большим увеличением микроскопа, с использованием иммерсионного объектива.
Результаты окраски:
— по Цилю — Нильсену — кислотоустойчивые ооцисты криптоспоридий округлой формы, 4–5 мкм, ярко-красного цвета различных оттенков; они хорошо различимы на общем зеленом фоне мазка;
— по Кюстеру — ооцисты окрашиваются в бледно-розовый цвет;
— по Романовскому — Гимзе — округлые ооцисты не окрашиваются или окрашиваются слабо, внутри них по периферии заметны спорозоиты удлиненной формы, слегка изогнутые, бледно-голубого цвета с красной гранулой.
Оценка интенсивности инвазии в среднем по 10 полям зрения микроскопа:
+ — низкая (1–3 ооцисты);
++ — средняя (до 25 ооцист);
+++ — высокая (более 25 ооцист).
Исследование нативных препаратов фекалий. Применяется метод И. Павласека (1990) с применением глицерина. В каплю фекалий добавляют несколько капель глицерина, при этом ооцисты криптоспоридий приобретают слегка розоватый цвет и становятся хорошо различимы. В ооцистах четко выявляются спорозоиты. Другие простейшие и частицы не обладают свойством менять свой цвет под влиянием глицерина. Следует отметить, что такая окраска ооцист криптоспоридий может исчезнуть через 30–40 мин после приготовления нативного препарата. В связи с этим необходимо исследовать только свежеприготовленные препараты. Исследование проводят под увеличением микроскопа 40 × 10.
Количественный метод диагностики криптоспори–диоза. Методика основана на способности эфира, будучи добавленным во взвесь фекалий, просветлять ее, захватывая частицы детрита и жира, поднимать их на поверхность при центрифугировании. К пробе фекалий (1 мл) добавляют 5 мл 2% раствора кальцинированной соды и тщательно перемешивают, затем смесь фильтруют через металлическое сито в центрифужную пробирку, добавляют воду, доводя объем взвеси до 10 мл. Взвесь центрифугируют в течение 3 мин при 2500–3000 об/мин. Надосадочную жидкость сливают, к осадку добавляют 6–7 мл 2% раствора кальцинированной соды и 1,5–2 мл этилового эфира. Пробирку закрывают пробкой, осторожно перемешивают и центрифугируют 10 мин при 250–500 об/мин. После центрифугирования образовавшуюся в пробирке над–осадочную жидкость отсасывают пипеткой до метки 1 мл. Осадок тщательно перемешивают и пипеткой из гемометра Сали быстро набирают 0,01 мл взвеси, выдувают на предметное стекло и готовят мазок. Полученный мазок высушивают, фиксируют и окрашивают по Цилю — Нильсену. Подсчет ооцист криптоспоридий ведут по всей поверхности мазка под большим увеличением микроскопа, с использованием иммерсионного объектива. Полученное количество ооцист умножают на 1000 и получают количество ооцист в 1 г фекалий. Для удобства подсчета ооцист криптоспоридий мы рекомендуем применять сетку Акбаева.
Серологический метод. Криптоспоридийные антигены в фекалиях выявляют методами непрямой иммунофлюоресценции, иммуноферментного анализа. Могут быть использованы иммуноблоттинг, молекулярно-генетические методы (полимеразная цепная реакция (ПЦР)).
Посмертная диагностика
Посмертный диагноз на криптоспоридиоз представляет определенные сложности в связи с мелкими размерами ооцист, их внешней схожестью на мазках-отпечатках с каплями жира, эритроцитами и др., а также быстрым аутолизом. Обязательное условие — недопущение замораживания и оттаивания проб патматериала. Мазки-отпечатки и соскобы фиксируют этанолом и окрашивают по Цилю — Нильсену, затем просматривают под большим увеличением микроскопа, с использованием иммерсионного объектива.
Лечение
При легком или среднетяжелом течении болезни и при отсутствии нарушений в иммунной системе лечение криптоспоридиоза не вызывает проблем. Пациентам назначают легкоусвояемую пищу с исключением лактозы, грубой клетчатки, жиров. Необходим прием адекватного количества жидкости (солевые растворы для пероральной регидратации). При тяжелом течении целесообразно проводить внутривенную регидратацию в соответствии со степенью обезвоживания.
Этиотропная терапия не разработана. Однако пациентам с иммунодефицитными состояниями рекомендуют в качестве терапии использовать антибиотики из группы макролидов, и антиретровирусные препараты могут уменьшить или прекратить симптомы данного заболевания.
Одним из самых многообещающих препаратов в этой сфере является нитазоксадин. Он помог половине всех пациентов, которые принимали участие в научных исследованиях этого препарата. К сожалению, разработка нитазоксадина была остановлена в связи с решением Управления по контролю за продуктами и лекарствами США. Однако в 2002 году препарат был одобрен для лечения детей [8].
Патогенетическая терапия. Одним из самых важных этапов лечения является регидратация. При легкой и среднетяжелой степени обезвоживания (эксикоз 1-й и 2-й ст.) проводится пероральная регидратация, которая начинается уже в домашних условиях. При эксикозе 2–3-й ст. и при возрастающей диарее пероральная регидратация сочетается с внутривенным введением жидкости и проводится в условиях стационара. Пер–оральную регидратацию (прием жидкости через рот) проводят в 2 этапа.
Первый этап: первые 4–6 часов устраняют водно-солевой дефицит. При эксикозе I степени объем вводимой жидкости у детей составляет 30–50 мл/кг массы тела, при эксикозе II степени — 100 мл/кг.
Более простой расчет: для возмещения дефицита массы тела в 1 % необходимо ввести жидкость в объеме 10 мл/кг массы тела.
Или: объем жидкости (в мл) = Р × Д × 10, где Р — фактическая масса тела в кг к началу лечения; Д — дефицит массы тела в %; 10 — коэффициент пересчета.
Или определяется по формуле: V (мл/ч) = 1,66 × Р × П, где V — объем раствора (мл/ч); Р — масса больного в кг; П — % обезвоживания по отношению к массе тела больного; 1,66 — коэффициент пропорциональности.
Критерии эффективности 1-го этапа пероральной регидратации: уменьшение потерь жидкости со стулом и рвотой, исчезновение жажды, повышение тургора тканей, увлажнение слизистых оболочек, увеличение диуреза.
При эффективности 1-го этапа регидратации через 4–6 часов начинают 2-й этап, который является поддержкой текущих потерь жидкости.
Примерный объем раствора у детей на этом этапе — 50–100 мл/кг массы тела или 10 мл/кг после каждого стула.
Парентеральную регидратацию проводят в стационаре изотоническими полиионными кристаллоидными растворами (глюкозы, раствором натрия хлорида). Соотношение глюкозы и солевых растворов зависит от типа обезвоживания. Изотонический тип обезвоживания — 2 : 1, гипертонический — 2 : 1, гипотонический — 1 : 1. У взрослых + полиионные кристаллоидные растворы трисоль, квартасоль, хлосоль, ацесоль.
Коллоидные растворы (5% раствор альбумина, рео–полиглюкин) используют при наличии признаков нарушения микроциркуляции или гиповолемическом шоке.
Симптоматическая терапия
Назначают энтеросорбенты, пробиотики и ферменты.
Профилактика
Специфическая профилактика криптоспоридиоза не разработана. Необходимо соблюдение мер личной гигиены. Патологический материал от больных обрабатывают 10% раствором формалина или 5% раствором аммиака не менее 18 ч. При обработке помещений для скота используют 10% раствор формалина с многочасовой экспозицией.
6-е место среди самых опасных пищевых паразитов
Дизентерийная амеба
Шифр МКБ-10:
A06.0 Острая амебная дизентерия, острый амебиаз, кишечный амебиаз
A06.1 Хронический кишечный амебиаз
A06.2 Амебный недизентерийный колит
A06.3 Амебома кишечника, амебома
A06.4 Амебный абсцесс печени, печеночный амебиаз
A06.5 Амебный абсцесс легкого, амебный абсцесс легкого (и печени)
A06.6 Амебный абсцесс головного мозга (и печени) (и легкого)
A06.7 Кожный амебиаз
A06.8 Амебная инфекция другой локализации, амебный аппендицит
A06.9 Амебиаз неуточненный
Амебиаз (Amebiasis) — протозойное заболевание, вызываемое Entamoeba histolytica, характеризующееся умеренно выраженной интоксикацией, язвенным поражением толстого кишечника, возможным развитием внекишечных проявлений — абсцессов в печени и других органах.
История открытия
Возбудитель болезни открыт Ф.А. Лешем в 1875 г. Исследования амебиаза Леш начал в 1873 г. и опубликовал их в Archiv fiir Pathologische Anatomie (1875 г., т. 65, с. 196). Эти исследования основывались на изучении заболевания крестьянина Архангельской губернии, у которого наблюдался кровавый понос. Ф.А. Леш провел заражение фекалиями этого больного четырех собак, одна из которых заболела острой формой амебиаза с типичным поражением толстой кишки и выделением возбудителя. Позже А.В. Григорьев установил, что в кишечнике человека существуют как патогенные, так и непатогенные формы амеб, и отметил необходимость дифференциации амебной дизентерии от бациллярной [2, 5].
Современное название возбудителя амебиаза — Enta–moeba histolytica — предложил F. Schaudinn в 1903 г. [5].
Этиология амебиаза
Entamoeba histolytica относится к царству Animalia, подцарству Protozoa, типу Sarcomas tigophora, подтипу Sarcodina.
Существуют непатогенные амебы: Entamoeba gingivalis, Entamoeba dispar, Entamoeba hartmanni, Enta–moeba coli, Endolimax nana, lodamoeba biletschlii, Dien–tamoeba fragilis и патогенная Entamoeba histolytica, вызывающая тяжелую кишечную симптоматику.
Строение дизентерийной амебы
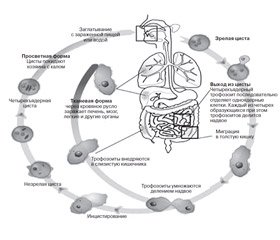
Амеба существует в виде различных форм: трофозоит (вегетативная стадия) и циста. Вегетативная форма имеет 4 стадии: тканевую, Е.histolytica forma magna (эритрофаг), Е.histolytica forma minuta (просветная) и предцистную.
Тканевая форма — патогенная форма амебы, паразитирующая в ткани слизистой оболочки толстого кишечника и вызывающая специфическое его поражение. Цитоплазма ее разделена на два слоя: наружный (эктоплазма) и внутренний (эндоплазма). Эндоплазма — мелкозернистая блестящая масса, напоминающая мелко истолченное стекло. Эктоплазма имеет вид прозрачной стекловидной массы. Размер — 20–25 мкм. Тканевая форма обнаруживается только при остром амебиазе в пораженных органах и редко — в фекалиях [12].
Эритрофаг проникает в слизистую и подслизистую оболочки кишки, фагоцитирует эритроциты, вызывая некроз и язвы. Е.histolytica forma magna имеет размер 20–40 мкм, а при движении амебы вытягиваются до 60–80 мкм. Большая вегетативная форма обнаруживается в копрограмме при остром амебиазе.
Просветная форма размером 15–25 мкм, не имеет деления на экто- и эндоплазму, цитоплазма содержит бактерии, мелкие вакуоли, но не содержит эритроциты. Обитает в просвете верхних отделов толстого кишечника и обнаруживается при хроническом амебиазе.
Предцистная форма имеет размер 12–20 мкм. По строению напоминает просветную форму, вакуоли отсутствуют, движение замедленное, иногда в цитоплазме видно небольшое количество бактерий. В практических условиях лаборанты относят предцистную стадию или к просветной форме, или к цисте, не дифференцируя ее микроскопически.
Циста образуется из просветной (предцистной) формы в нижних отделах толстого кишечника (рис. 2). Цисты обнаруживаются при хроническом рецидивирующем амебиазе в стадии ремиссии и у носителей амеб. Цисты неподвижны, покрыты оболочкой, бесцветны, прозрачны, имеют округлую форму. Размер — 8–15 мкм. Зрелые цисты содержат 4 ядра, в незрелой цисте 1–3 ядра, четко контурируются гликогеновая вакуоль в виде светлого пятна и палочковидные с закругленными концами хроматоидные тела черного цвета [5, 11, 12].
Жизненный цикл
Источник заражения — человек, выделяющий цисты. За сутки человек может выделять с испражнениями десятки миллионов цист. Механизм передачи фекально-оральный.
Заглоченная циста в нижних отделах тонкой кишки под влиянием кишечных ферментов эксцистируется. Освободившаяся амеба начинает делиться, образуя 8 одноядерных амеб-трофозоитов, которые опускаются к месту своего паразитирования — в верхние отделы толстой кишки. Просветные формы, пассивно передвигаясь вместе с содержимым кишечника, попадают в его концевые отделы, где неблагоприятные условия (обезвоживание, изменение бактериальной флоры, изменение среды и др.) приводят к превращению амеб в цисты. Цисты с испражнениями человека выделяются в окружающую среду, где могут длительное время сохраняться. Для человека заразны зрелые четырехъядерные цисты. Цисты, попадая в воду, на овощи, руки и пищу (на которую они заносятся, в частности, мухами), различные предметы, например посуду, игрушки, в конце концов заносятся в рот человека [2, 16].
Клиника амебиаза
Согласно рекомендациям Комитета экспертов ВОЗ (1970) выделяют три клинические формы амебиаза: кишечную, внекишечную и кожную.
Кишечный амебиаз
1. Острый амебиаз:
а) амебный колит;
б) амебная дизентерия.
2. Хронический амебиаз:
а) амебный колит;
б) амебная дизентерия.
3. Кишечные осложнения амебиаза:
а) перфорация с перитонитом;
б) амебома кишок;
в) амебный аппендицит.
Внекишечный амебиаз
1. Амебный гепатит:
а) без нагноения;
б) абсцесс печени.
2. Амебный абсцесс других органов (легких, мозга, селезенки).
3. Амебиаз кожи.
Комбинированный амебиаз
1. С бактериальной дизентерией.
2. С другими протозойными болезнями кишечника.
3. С другими инфекционными болезнями (малярия, брюшной тиф и др.).
Кишечный амебиаз является самой распространенной из клинических форм болезни. Инкубационный период длится от 1–2 недель до 3 месяцев и более. Болезнь начинается постепенно с недомогания, снижения аппетита, нерезкой боли в животе, утомляемости, субфебрилитета. Боль в животе постепенно усиливается, локализируясь в нижних его отделах справа. Появляются расстройства стула. В начальном периоде болезни кал жидкий, иногда с примесью слизи, стул около 10 раз в сутки. Фекалии имеют вид малинового желе — стекловидная слизь, равномерно окрашенная кровью вследствие высокого расположения первичных амебных язв (правосторонний колит). В случае длительного течения болезни кал приобретает шоколадный цвет за счет наличия в нем примеси гноя. Чаще болезнь протекает с поражением слепой и восходящей ободочной кишки (амебный колит). У больных с поражением сигмовидной ободочной и прямой кишок (амебная дизентерия) наблюдаются тенезмы, ложные позывы к дефекации, приступообразные боли перед дефекацией в левой половине живота. Сигмовидная ободочная кишка спазмирована, болезненна [2, 13, 19].
При ректороманоскопии (колоноскопии) выявляют незначительный отек кишок, на отдельных участках язвы с подрытыми краями, которые разделены фрагментами неповрежденной слизистой. В начальном периоде печень и селезенка, как правило, не увеличены.
В типичной клинической картине амебиаза обращает на себя внимание несоответствие объективных данных степени интоксикации. При неосложненном амебиазе проявления интоксикации незначительны, несмотря на значительные расстройства функции желудочно-кишечного тракта (кровавый понос), общее самочувствие больных остается удовлетворительным, многие из них продолжают работать, что может быть эпидемически опасным. Это несоответствие объясняется главным патогенным ферментативным, а не токсичным, как в случае бактериальной дизентерии и других кишечных инфекций, влиянием Е.histolytica.
Острый кишечный амебиаз (неосложненный) протекает без повышения температуры тела. Даже субфебрильная температура наблюдается редко, как правило, при осложнениях амебиаза или комбинированном амебиазе. Во время микроскопического исследования фекалий, кроме амеб, обнаруживают эозинофилы, кристаллы Шарко — Лейдена. Через 2–4 недели острые проявления постепенно угасают даже без специфического лечения. Возможно самоизлечение, но чаще (60–70 %) болезнь приобретает хроническое течение.
Хронический кишечный амебиаз может иметь рецидивирующее или непрерывное течение. Как и при острой форме, возможно поражение преимущественно слепой и восходящей ободочной кишки (амебный колит) или прямой и сигмовидной ободочной (амебная дизентерия). В случае рецидивирующего течения болезни периоды обострения чередуются с периодами ремиссии, во время которой стул может полностью нормализоваться и состояние больного становится удовлетворительным. Если течение болезни непрерывное, ремиссий нет, наблюдаются периоды усиления и ослабления клинических проявлений болезни. При хроническом течении амебиаза отмечается непостоянная боль внизу живота, больше в подвздошных участках. Аппетит понижен, чувство горечи во рту, иногда жгучая боль в области языка (вследствие гиповитаминоза), кожа сухая, легко собирается в складки. Живот, как правило, втянут, хотя у части больных во время обострений возможен метеоризм. Периоды поноса, иногда с примесью слизи и крови в фекалиях, чередуются с запором. Постепенно развиваются астенизация, раздражительность, головная боль, нарушение сна, белковый и витаминный дефицит, похудение. Наблюдаются приглушенность тонов сердца, лабильность пульса, дистрофические изменения в миокарде по данным электрокардиографии. При длительном течении болезни развиваются гипохромная анемия, эозинофилия, относительный лимфоцитоз. Если специфическое лечение не проводится, хронические формы амебиаза могут длиться годами.
Сравнительно часто наблюдаются случаи амебиаза-микст, который у 25 % больных вызван присоединением бактериальной дизентерии. В таких случаях начальная симптоматика болезни обусловлена бактериальной дизентерией [2, 19].
Внекишечный амебиаз
Внекишечный амебиаз чаще возникает как осложнение кишечного. Чаще проявляется в виде гепатита или абсцесса печени, протекающих остро, подостро или хронически. Поражения печени могут возникнуть в период развития острого амебного колита или спустя несколько месяцев и даже лет после заражения. Возможно развитие гепатомегалии.
При амебных абсцессах — увеличение печени, высокая температура с ознобом. При вовлечении в процесс диафрагмы — ограничение ее подвижности. Возможны ателектазы. Иногда отмечается длительное скрытое или нетипичное течение абсцесса с возможным последующим его прорывом, что может вести к развитию перитонита и поражению органов грудной полости.
При амебном абсцессе печени указания на перенесенный ранее кишечный амебиаз выявляются редко, как и на амебы в фекалиях [8].
Плевролегочный амебиаз является следствием прорыва абсцесса печени через диафрагму в легкие, реже — за счет гематогенного распространения амеб. Проявляется эмпиемой плевры, абсцессами в легких и печеночно-бронхиальной фистулой. Характерны боль в груди, кашель, одышка, гной и кровь в мокроте, озноб, лихорадка, лейкоцитоз.
Церебральный амебиаз имеет гематогенное происхождение. Абсцессы могут находиться в любом участке мозга, но чаще в левом полушарии. Начало обычно острое, течение молниеносное с летальным исходом. Прижизненно диагностируется редко.
Амебный перикардит чаще развивается при прорыве абсцесса печени через диафрагму в перикард, что ведет к тампонаде сердца и летальному исходу.
Мочеполовой амебиаз развивается за счет прямого попадания возбудителей через изъязвленную поверхность слизистой прямой кишки в гениталии. У гомо–сексуалистов возможны поражения в виде бородавчатых изъязвлений в области гениталий и заднего прохода [2, 9].
Кожный амебиаз — это преимущественно вторичный процесс в виде эрозий и язв, которые чаще располагаются возле отходников, на ягодицах вокруг свищей и послеоперационных рубцов. Язвы глубокие, с некротизированными почерневшими краями, нередко с выделениями неприятного запаха. В соскобе с поверх–ности язв выявляют дизентерийные амебы.
Диагностика
С первого дня болезни проводят микроскопию нативных мазков из свежевыделенного кала в физиологическом растворе и мазков, окрашенных раствором Люголя. Выявления только просветных форм и цист амеб в кале недостаточно для окончательного диагноза. Для повышения эффективности паразитологических исследований применяют многократное (3–6 раз) исследование свежевыделенных фекалий (не позднее 10–15 минут после дефекации) и других биологических субстратов, сбор материала в консервирующие жидкости для длительного хранения препарата, методы обогащения. При наличии клинических признаков кишечного амебиаза и отрицательных результатах паразитологических исследований применяют серологические реакции, основанные на выявлении специфических противоамебных антител. Используются реакция иммунофлюоресценции, реакция связывания комплемента, иммуноферментный анализ, реакции торможения гемагглютинации и нейтрализации с парными сыворотками (нарастание титра антител в 4 и более раза). Серологические тесты положительны у 75 % больных с кишечным амебиазом и у 95 % пациентов с внекишечным амебиазом [8, 11].
Из современных методов исследования используется выявление антигенов дизентерийных амеб в фекалиях и другом материале с помощью моноклональных антител; определение паразитарной ДНК методом полимеразной цепной реакции.
Дифференциальная диагностика амебиаза
Дифференциальная диагностика кишечного амебиаза проводится с другими протозойными инфекциями (балантидиазом), бактериальной дизентерией, неспецифическим язвенным колитом, раком кишечника, а при амебном абсцессе печени — с гнойными ангиохолитами, раком желчных путей, иногда — с малярией, висцеральным лейшманиозом. При абсцессах в легких следует иметь в виду туберкулез, абсцедирующие пневмонии другой этиологии.
Дифференциальная диагностика с бактериальной дизентерией
В отличие от кишечного амебиаза бактериальная дизентерия характеризуется коротким инкубационным периодом, острым началом, высокой температурой, частым кровянистым стулом и общей интоксикацией. При ректороманоскопии обнаруживаются поверхностные изъязвления. В эндемичных очагах амебиаза у больных нередко сочетаются амебная и бактериальная дизентерия, что значительно осложняет течение каждого из этих заболеваний. Характерные симптомы обеих инфекций как бы смешиваются. В таких случаях удается поставить диагноз только после тщательных бактериологических и протозоологических исследований.
Дифференциальная диагностика с неспецифическим язвенным колитом
Неспецифический язвенный колит отличается диффузными или очаговыми поражениями толстого кишечника, развитием интоксикации, лихорадочного состояния, тахикардии, увеличением печени, селезенки. Наблюдается частый стул со слизью и кровью. Рано возникают осложнения: полипы на слизистой оболочке толстого кишечника, стенозы, перипроктиты, кишечные кровотечения, септикопиемия. Лечение неспецифических язвенных колитов эметином не дает эффекта.
Дифференциальная диагностика с другими протозоозами и опухолями
В дифференциальной диагностике балантидиаза и амебиаза решающее значение принадлежит обнаружению в исследуемом материале вегетативных форм и цист балантидий. При раке прямой кишки путем ректороманоскопии выявляется опухоль или кровоточащая кратерообразная язва. В процессе диагностики абсцесса печени исследуют печеночный пунктат на тканевые формы амеб, используют серологические реакции, проводят рентгенографию.
Лечение
Существует несколько групп препаратов для лечения амебиаза, которые действуют на разных этапах заболевания.
1. Препараты прямого контактного действия (прямые амебоциты), которые губительно действуют на просветные формы возбудителя. Применяют для санации носителей амеб и лечения хронического амебиаза в стадии ремиссии. Это хиниофон, дийодохин. Хиниофон можно применять в виде клизм.
2. Препараты, действующие на тканевые амебоциты, то есть против тканевых и просветных форм для лечения острого кишечного (можно и внекишечного) амебиаза: эметин, дегидроэметин, амбильгар, хингамин (при амебных абсцессах печени).
3. Препараты универсального сочетанного действия, применимы при лечении всех форм амебиаза: метронидазол (трихопол), фурамид.
4. Антибиотики применяют для изменения микробного биоценоза в кишечнике при лечении амебиаза.
5. Препараты, восстанавливающие нормальную микрофлору кишечника: пребиотики, пробиотики, симбиотики, возможен комплексный иммуноглобулиновый препарат.
6. Ферментные препараты (дигестал, панзинорм) для купирования колитического синдрома.
Схемы лечения амебиаза [8]
Кишечный амебиаз: метронидазол — внутрь 30 мг/ кг/сутки в 3 приема в течение 8–10 дней, или тинидазол: до 12 лет — 50 мг/кг/сут (макс. 2 г) в 1 прием в течение 3 дней, старше 12 лет — 2 г/сут в 1 прием в течение 3 дней, или орнидазол: до 12 лет — 40 мг/кг/сут (макс. 2 г) в 2 приема в течение 3 дней, старше 12 лет — 2 г/сут в 2 приема в течение 3 дней, или секнидазол: до 12 лет —30 мг/кг/сут (макс. 2 г) в 1 прием в течение 3 дней, старше 12 лет — 2 г/сутки в 1 прием в течение 3 дней.
Амебный абсцесс: метронидазол — 30 мг/кг/сутки в 3 приема в течение 8–10 дней, или тинидазол: до 12 лет — 50 мг/кг/сут (макс. 2 г) в 1 прием в течение 5–10 дней, старше 12 лет — 2 г/сут в 1 прием в течение 5–10 дней, или орнидазол: до 12 лет — 40 мг/кг/ сут (макс. 2 г) в 2 приема в течение 5–10 дней, старше 12 лет — 2 г/сут в 2 приема в течение 5–10 дней, или секнидазол: до 12 лет — 30 мг/кг/сут (макс. 2 г) в 1 прием в течение 3 дней, старше 12 лет — 2 г/сут в 1 прием в течение 3 дней.
После завершения курса лечения 5-нитроимидазолами или дегидроэметином с целью элиминации оставшихся в кишечнике амеб применяют просветные амебоциты: этофамид — 20 мг/кг/сут в 2 приема в течение 5–7 дней или паромомицин — 1000 мг/сут в 2 приема в течение 5–10 дней.
Диспансерное наблюдение
1. Срок диспансерного наблюдения реконвалесцентов амебиаза — 12 месяцев (с клиническим осмотром и лабораторным обследованием 1 раз в квартал, а также при появлении признаков дисфункции кишечника).
2. Продолжительность диспансерного наблюдения паразитоносителей — до полной их санации.

/151-1.jpg)
/152-1.jpg)
/155-1.jpg)