Статтю опубліковано на с. 61-65
Вступ
Згідно з фактами, встановленими на сьогодні, людину (1013-клітинний макроорганізм) населяє 1014–1015 мікроорганізмів. Усі ці мікроорганізми живуть в оточенні один одного і не можуть існувати поза цим середовищем, життєво залежним від людського організму, який, у свою чергу, також не може жити без цього об’єднання: «Причем это не просто параллельное сосуществование, а жизненная необходимость в обеспечении себя питанием и получении жизненно необходимых средств, условиями для размножения, возможностями защиты и т.д.» [1]. Той факт, що бактерії здатні утворювати складні бактеріальні спільноти, був відомий давно, проте в 90-х роках минулого сторіччя було доведено існування феномену колективної поведінки бактерій, який отримав назву quorum sensing (QS) — «відчуття кворуму» [16, 17, 24 ]. Quorum sensing відбувається за участі регуляторних систем за рахунок взаємодії зі специфічними рецепторами, розташованими на поверхні мембрани бактерії, такими як N-ацил-гомосерин дегідрогенази лактон [22] та інші [10]. Склад мікрофлори генетично пов’язаний в середині біоплівки, специфічний на штамовому рівні для кожного індивідуума й навіть детермінований спадково [7]. Біота настільки індивідуальна, що за її складом можна ідентифікувати індивіда з більшою точністю, ніж за відбитками пальців. Отже, колонізуючий склад мікрофлори в дітей з певними захворюваннями генетично детермінований. Тому цікавим є вивчення відмінностей видового складу мікроорганізмів, що населяють ротоглотку хворих з гострими респіраторними епізодами та пацієнтів, які тривало хворіють, зокрема дітей з бронхіальною астмою (БА).
Близько 60 % хронічних і рецидивуючих інфекцій, торпідних до стандартної терапії, пов’язані із формуванням на різних поверхнях (передусім на слизових оболонках) біоплівок [17, 18]. На сьогодні доведена роль мікробних біоплівок в етіології й патогенезі багатьох гострих і хронічних бактеріальних інфекцій. До останніх відносять муковісцидоз [12] і вентиляційнозалежні пневмонії [24]. Тобто в етіології та патогенезі захворювань дихальної системи біоплівки відіграють особливу роль. Основними бактеріями, що входять до складу біоплівки при хронічних обструктивних захворюваннях легень (ХОЗЛ), є, як правило, H.influenzae, пневмокок і Moraxella catarrhalis [22]. Механізм формування біоплівки при ХОЗЛ пов’язаний з пошкодженням епітелію дихальних шляхів через куріння тютюну або забруднення довкілля [13]. Ці фактори сприяють розвитку запалення та активації макрофагів, нейтрофілів і дендритних клітин [11, 20]. Останнє може також активувати клітини адаптивного імунітету й запускати автоімунні механізми, що викликають хронічне запалення [11, 19, 20].
Роль інфекційних агентів у виникненні та персистуванні запального процесу у хворих із бронхіальною астмою постійно викликає інтерес і неоднозначно трактується клініцистами, мікробіологами та патоморфологами [8, 5, 14]. Невирішеними залишаються питання про первинну або вторинну роль патогенної мікрофлори у виникненні загострень та зниженні ефективності проведеного лікування, що слід враховувати при застосуванні препаратів (кортикотропні гормони, антибіотики тощо), які, у свою чергу, як побічний ефект мають порушення місцевого мікробного балансу [8].
Матеріали та методи дослідження
Метою нашого дослідження було якісно та кількісно охарактеризувати мікрофлору біотопу ротоглотки в дітей, хворих на БА та гостру респіраторну інфекцію (ГРІ).
У дослідженні брали участь 15 дітей, хворих на БА в періоді загострення легкого та середнього ступеня тяжкості, та 11 пацієнтів із ГРІ віком від 9 до 17 років, які знаходились на стаціонарному лікуванні в пульмонологічному та інфекційно-діагностичному відділеннях Комунальної установи Тернопільської обласної ради «Тернопільська обласна дитяча клінічна лікарня». У дослідження включені пацієнти, батьки яких дали згоду на обстеження дітей та аналіз медичної документації. Групи обстежених дітей були порівнянні за віком, статтю та місцем проживання.
Хворих на БА розподілено за ступенем тяжкості, їм призначено стандартну базисну терапію періоду загострення відповідно до Наказу МОЗ України від 08.10.2013 № 868. Усі хворі отримували перорально та інгаляційно кортикостероїдні препарати, інгаляційний холінолітик на тлі β2-агоністів короткої дії для зменшення симптомів астми. Мікробіологічне дослідження проводилось у перші дні періоду загострення. У 38,46 % (n = 5) хворих загострення виникло на тлі легкого персистуючого перебігу захворювання. У решти 61,54 % (n = 8), обстежуваних мала місце БА середнього ступеня. Давність захворювання становила в середньому 4,46 ± 2,50 року. Востаннє антибактеріальну терапію пацієнти отримували в строк від 1 до 7 місяців до даного обстеження. Усі обстежувані приймали лише один вид антибіотика (переважно цефалоспорини). Інгаляційні кортикостероїдні препарати застосовувались їм від кількох місяців до 1 року.
Серед проявів ГРІ переважали ураження нижніх дихальних шляхів (n = 8; 72,73 %): трахеобронхіт (n = 2; 18,18 %), бронхіт (n = 1; 9,09 %), пневмонія (n = 5; 45,45 %). У решти (n = 3; 72,73 %) хворих патологічний процес локалізувався у верхній частині дихального тракту: ринофарингіт (n = 1; 9,09 %) та фарингіт (n = 2; 18,18 %). На стаціонарне лікування діти потрапляли переважно після другої доби від початку захворювання. Комплекс лікування ГРІ складався з місцевої противірусної (лаферобіон, 5% ЕААК), симптоматичної (жарознижуючі, муколітики, бронхолітики) та антибіо–тикотерапії (у більшості хворих (n = 9; 81,81 %)). Антибіотикотерапія проводилась цефалоспоринами 3-го покоління (цефтріаксон отримували 7 хворих (63,64 %), решта — цефотаксим). Мікробіологічне дослідження проводилось у першу добу стаціонарного лікування.
Основним методами дослідження цієї групи обстежених були:
— загальноклінічні: збирання анамнезу, огляд хворого, оцінка скарг хворого;
— функціональні: дослідження функції зовнішнього дихання;
— мікробіологічні.
Усі діти з ГРІ були ретельно клінічно обстежені, що включало детальний аналіз скарг, анамнезу життя, наявності супутніх захворювань, вживання лікарських препаратів, даних об’єктивного обстеження. Комплекс лікування ГРІ складався з місцевої противірусної (лаферобіон, 5% ЕААК), симптоматичної (жарознижуючі, муколітики, бронхолітики) та антибіотикотерапії (у більшості хворих). Мікробіологічне дослідження проводилось у першу добу стаціонарного лікування.
Для оцінки біоти ротоглотки досліджуваного контингенту використані загальновживані методи з посівом харкотиння на живильні середовища (колумбійський агар, шоколадний агар, агар Мак-Конкі, жовточно-сольовий агар, середовище Сабуро, сусло-агар тощо). Кількісний підрахунок бактерій проводився шляхом вираження об’єктивної кількості колоній мікроорганізмів у колонієутворюючих одиницях на грам (КУО/г). Враховувалася кількість виділених штамів сапрофітних бактерій (Neisseria spp., St epidermidis та ін.) та умовно-патогенних бактерій (St. aureus, Klebsiella spp. та ін.) у кількості 1 • 105 і більше, дріжджових (Candida spp.) та пліснявих мікроміцетів (Aspergillus spp., Penicillus spp. тощо) [2–4]. Ступінь домінування того чи іншого мікроорганізму в угрупованні визначали за частотою його виявлення. Для цього використовували індекс постійності С, що виражається часткою добутку кількості зразків, які містять досліджуваний вид (р), на 100 % від кількості взятих зразків (Р). Види, що зустрічалися найбільш часто (понад 50 %), вважали константними; у межах 20–50 % — другорядними; такими, що зустрічаються нечасто — від 1 до 19 %; такими, що зустрічаються рідко, — менше від 1 %. Для оцінки частоти зустрічальності популяцій різних мікроорганізмів в ротоглотці використовували показник зустрічальності Рі, що становить відношення числа штамів даного виду до загальної кількості штамів [6].
Статистична обробка матеріалу проводилася за допомогою ліцензійних програмних продуктів, які входять у пакет Microsoft Office Professional 2000, ліцензія на персональному комп’ютері у програмі Excel.
Обговорення результатів дослідження
Серед обстеженого контингенту 6 дітей, хворих на ГРІ (54,54 %), були носіями стафілококів, причому 4 з них — S.аureus. Різного роду стрептококи виділені майже від половини обстежуваних: α-гемолітичні — 54,54 %, β-гемолітичні — 45,45 % (табл. 1).
Отже, до константних видів при ГРІ можна віднести стафілококи та α-гемолітичні стрептококи, до другорядних — β-гемолітичні стрептококи та E.coli (45,45 %) і Candida spp. (36,36 %) відповідно. Решта мікроорганізмів: нейсерії, мораксели, коринебактерії, клебсієли, пневмококи та бранхамели — віднесені до третьої групи — ті, що зустрічаються нечасто.
При БА ступінь домінування мікроорганізмів був дещо іншим, хоча константні види були тими ж (табл. 2). Проте порівняно з мікрофлорою при ГРІ значно зросла кількість α-гемолітичних стрептококів (80,0 % проти 54,54 %) та збільшилась питома вага автохтонних мікроорганізмів: Corynebacterium spp., Branhamella spp., Moraxella spp.
У структурі біотопу ротоглотки хворих на БА дітей не спостерігалось видимих явищ дисбіозу (наявності нехарактерних для даного біотопу мікроорганізмів або збільшення кількості тих, що зустрічаються рідко).
Отже, аналізуючи індекс постійності (С, %) можна підсумувати, що константними для біотопів ротоглотки дітей з ГРІ та БА були лише два види — стафілококи та α-гемолітичні стрептококи. Але щодо другорядних за значенням мікроорганізмів дані групи значно відрізнялися: при ГРІ виділено Streptococcus spp. з β-гемолізом, E.coli та Candida spp., при БА — представників автохтонної мікрофлори: Streptococcus spp. з β-гемолізом, Moraxella spp., Corynebacterium spp. Серед мікроорганізмів, що зустрічаються нечасто в дітей, хворих на ГРІ, були представники таких патогенів, як Neisseria spp., Klebsiella spp. та Streptococcus pneumoniае; у хворих на БА, окрім Neisseria spp., їх не зустрічалось.
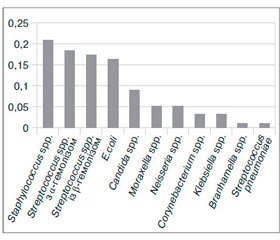
Виділені патогени респіраторної групи в обстежених дітей на 76–82 % є чинниками патології дитячого віку, посідаючи в структурі інфекційної захворюваності домінуюче місце [9]. Із ротоглотки досліджуваних дітей, хворих на ГРІ, виділено 95 різних штамів мікроорганізмів. Левову частку становили стафіло- та стрептококи (n = 7 та n = 11 відповідно). Далі за величиною показника зустрічальності (Рі) знаходились E.coli та дріжджоподібні гриби роду Candida (рис. 1). Це переконливо свідчить про наявність у значної частки обстежених (45,45 %) дисбіозу ротоглотки, оскільки і кишкова паличка, і гриби Candida не є представниками нормобіотопу ротоглотки.
/63-2.jpg)
У дітей, хворих на ГРІ, епітелій слизової оболонки не виконав свою захисну функцію, що створило оптимальні умови для контамінації останньої алохтонними мікроорганізмами та сприяло їх росту та розмноженню. Така ситуація призвела до зростання кількості умовно-патогенних мікроорганізмів, що в подальшому можуть стати причиною бактеріальних ускладнень. Ретроспективний аналіз історій хвороби обстежених дітей виявив ускладнення в понад половини (n = 7; 63,63 %) аналізованих випадків: у третини дітей (4; 36,36 %) — пневмонії та в 3 (27,27 %) — обструктивного бронхіту.
Серед 46 штамів, що виділені від 15 пацієнтів, хворих на БА, найвищий показник зустрічальності діагностовано в α-гемолітичних стрептококів, на другому місці був S.aureus та Streptococcus spp. з β-гемолізом. Решта представників зустрічались з практично однаковою частотою (рис. 2).
Тобто за даним показником суттєвих змін при порівнянні біотопів ротоглотки в обстежених хворих не виявлено, за винятком наявності E.coli та Candida spp. при ГРІ.
Отже, константними для біотопів ротоглотки дітей з ГРІ та БА були стафілококи та α-гемолітичні стрептококи. Групи дослідження відрізнялися за складом другорядних за значенням мікроорганізмів: при ГРІ виділено Streptococcus spp. з β-гемолізом, E.coli та Candida spp., при БА — представників автохтонної мікрофлори (Streptococcus spp. з β-гемолізом, Moraxella spp., Corynebacterium spp.). Варіабельність видового складу біоти ротоглотки в хворих на ГРІ майже вдвічі перевищувала таку в пацієнтів з БА. Домінуючими за показником зустрічальності Рі мікроорганізмами при обох захворюваннях були стафіло- та стрептококи.
Список литературы
1. Bogadel'nikov IV. Jetjudy o cheloveke i mikroorganizmah :мonografija. [Studies on humans and microorganisms: мonograph]. Simferopol'. IT:ARIAL; 2014.160 p. Russian.
2. Byely`x NA, Zaly`vna LA. [Current approaches to diagnosis and treatment of infectious genesis of bronchial obstruction syndrome in children]. Aktual`naya y`nfektology`ya. 2015;1(6);88-93. Ukainian.
3. Vy`shnyakova LA. Mikrobiologicheskie metody obsledovanija pul'monologicheskih bol'nyh [Microbiological methods for examination of pulmonary patients]. Metod. Rekomendacii. Leningrad; 1981. 23 p. Russian.
4. Vorob'ev AA. Medicinskaja mikrobiologija, virusologija i immunologija (2-e izd. ) [Medical Microbiology, Virology and Immunology (2nd ed.)]. M; Medicinskoe informacionnoe agentstvo; 2006. 704 р. Russian.
5. Ermolina G.B.еt al. [Research of factors of pathogenicity of bacteria isolated from children in a multidisciplinary hospital]. Sovremennye problemy jepidemiologii. Sbornik statej, posvjashhennyh 65-letiju kafedry jepidemiologii Nizhegorodskoj gos. med. akademii. N. Novgorod: Izd-vo NGMA; 2007:62-67. Russian.
6. Klimnjuk SІ. Mіkrobna ekologіja shkіri ljudini v rіznі vіkovі perіodi v normі ta pri patologії [Microbial ecology of human skin at different ages in normal and pathological].Avtoref. dis. na zdobuttja nauk. stupenja doktora med. nauk.: spec. 03.00.07. Mіkrobіologіja. K; 1995. 23 р. Ukainian.
7. Osy`pov G. [Invisible Body - human microflora]. Available from: http://www.rusmedserv.com/microbdiag/invisibleorgan.htm#b6
8. Rekalova EM. [The relationship of the microflora of the respiratory tract with clinical features of chronic obstructive pulmonary disease]. Ukr. pulmonol. Mag; 2005 (3): 23-26. Russian.
9. Julish EI, Krivushhev BI, Jaroshenko SJa. [Approaches to the treatment of acute respiratory infections in frequently and long ill children]. Zdorov'e rebenka; 2011; 2 (29): 55. Russian.
10. Bhardwaj AK, Vinothkumar K, Rajpara N. Bacterial quorum sensing inhibitors: attractive alternatives for control of infectious pathogens showing multiple drug resistance]. Recent Pat. Antiinfect. Drug Discov; 2013(8):68-83.
11. Brusselle GG, Joos GF, Bracke KR. New insights into the immunology of chronic obstructive pulmonary disease. Lancet. 2011; 378:1015-26.
12. Davies JC, Bilton D. Bugs, biofilms, and resistance in cystic fibrosis. Respir. Care. 2009; 54:628-40.
13. Eldika N, Sethi S. Role of nontypeable Haemophilus influenzae in exacerbations and progression of chronic obstructive pulmonary disease. Curr. Opin. Pulm. Med. 2006;12:118-24.
14. Miravitlles M. Exacerbations of chronic obstructive pulmonary disease when are bacteria important? Eur. Respir. J. 2002; Vol. 20:9-19.
15. Hall-Stoodley L [et al]. Evolving concepts in biofilm infections. Cell Microbiol. 2009; Vol.11:1034-1043.
16. Jakobsen TH [et al]. Qualitative and quantitative determination of quorum sensing inhibition in vitro. Quorum sensing: methods and protocols. Methods in Molecular Biology. 2011; Vol.692:253-263.
17. Nazzari E, Torretta S, Pignataro L, Marchisio P, Esposito S. Role of biofilm in children with recurrent upper respiratory tract infections. European Journal of Clinical Microbiology & Infectious Diseases. March 2015; Vol. 34; Issue 3:421-429.
18. Pintucci JP, Corno S, Garotta M. Biofilms and infections of the upper respiratory tract. Eur. Rev. Med. Pharmacol. Sci. 2010;14:683-90.
19. Rovina N, Koutsoukou A, Koulouris NG. Inflammation and immune response in COPD: where do we stand? Mediators Inflamm. 2013:413-735.
20. Dancer R, Sansom DM. Regulatory T cells and COPD. Thorax. 2013;68:1176-1178.
21. Schuster M, Sexton DJ, Diggle SP., Greenberg EP. Acyl-homoserine lactone quorum sensing: from evolution to application. Ann. Rev. Microbiol. 2013;67:43-63.
22. Sethi S, Sethi R, Eschberger K, Lobbins P, Cai X, Grant BJ [et al]. Airway bacterial concentrations and exacerbations of chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med. 2007;176:356-61.
23. Tian X. Quorum sensing and bacterial social interactions in biofilms. Sensors (Basel). 2012;12:2519-38.
24. Wiener-Kronish JP, Dorr HI. Ventilator-associated pneumonia: problems with diagnosis and therapy. Best Pract. Res Clin. Anaesthesiol. 2008;22:437-49.

/63-1.jpg)
/63-2.jpg)