Статтю опубліковано на с. 23-26
Антибіотик-асоційована діарея (ААД) — це три або більше епізоди неоформлених випорожнень протягом двох або більше послідовних днів, що розвинулися на фоні застосування антибактеріальних препаратів або протягом 8 тижнів після закінчення антибактеріальної терапії [1, 2]. ААД спостерігається в 5–30 % пацієнтів, які отримують антибактеріальну терапію [1, 2]. Зазвичай виділяють діарею, зумовлену Clostridium difficile (10–20 % випадків ААД), і ідіопатичну ААД, не пов’язану з певним інфекційним агентом [2]. Однак останніми роками в літературі з’явились дані, що як при ідіопатичній ААД, так і при ААД, яка викликана Clostridium difficile (CdAД), спостерігаються однотипні зміни в мікрофлорі кишечника: втрата Bacteroides, Lachnospiraceae, Ruminococcaceae [3]. Крім цього, у хворих з ААД, особливо при CdAД, виявляли високий рівень колонізації кишечника бактеріями роду Enterobacteriaceae з розширеним спектром β-лактамаз [4].
Для зниження частоти та вираженості негативного впливу антибіотиків на мікробіоценоз кишечника рекомендується застосувати пробіотики [1–2].
Однією з ефективних та безпечних груп пробіотичних штамів для профілактики ААД є бактерії роду Bacillus, а саме Bacillus subtilis [5, 6]. Bacillus subtilis здатні синтезувати до 70 різноманітних антибактеріальних речовин, що забезпечує високу антагоністичну активність бацил щодо багатьох патогенних і умовно-патогенних мікроорганізмів (Shigella sonnei, Salmonella typhimurium, Escherichia coli, Staphylococcus aureus, Candida albicans, Proteus vulgaris, Klebsiella pneumoniae) [6]. Крім цього, Bacillus subtilis виділяють у просвіт кишечника дипіколінову кислоту, що сприяє як ерадикації патогенної та умовно-патогенної флори, так і росту власної нормофлори [7]. Ферменти Bacillus subtilis беруть участь у процесі пристінкового травлення, допомагають руйнувати й виводити ендотоксини патогенної та умовно-патогенної флори. Важливо, що бактерії роду Bacillus не утворюють біоплівок на слизових оболонках і тому не можуть безконт–рольно персистувати в організмі, що розглядається як один із найважливіших аспектів безпеки застосування пробіотичних препаратів. Також спори бацил стимулюють активність лімфоцитів, збільшують синтез секреторного імуноглобуліну А, α‑2-інтерферону [5, 6], що сприяє прискоренню одужання хворих з інфекційною патологією.
На фармацевтичному ринку України є харчовий функціональний продукт Субалін (виробництва ТОВ «ФЗ «Біофарма»), кожний флакон якого містить 1 • 109 живих мікробних клітин Bacillus sybtilis 2335/105.
Метою нашої роботи було вивчити ефективність застосування харчового функціонального продукту Субалін у дітей на тлі антибактеріальної терапії.
Матеріали та методи
Під спостереженням перебували 60 дітей віком від 3 до 17 років, які лікувались з приводу гострої інфекційної патології на базі клініки дитячих інфекційних хвороб НМУ імені О.О. Богомольця. Усіх хворих рандомізовано розподілили на 2 групи: 1-ша група — діти, які на фоні введення антибіотиків не отримували жодних пребіотичних та пробіотичних препаратів; 2-га група — діти, які паралельно з антибіотиками отримували харчовий функціональний продукт Субалін.
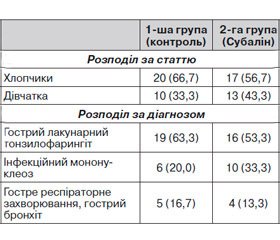
Розподіл хворих за статтю та діагнозом поданий у табл. 1. Інфекційний діагноз встановлювався на підставі клінічних та лабораторних даних відповідно до протоколів діагностики та лікування інфекційних захворювань у дітей МОЗ України. У всіх дітей захворювання мало середній ступінь тяжкості. Усі пацієнти з першого дня госпіталізації отримували антибіотик із групи цефало–споринів 3-го покоління парентерально (цефтріаксон, цефотаксим). Терапія залежно від діагнозу та тяжкості стану хворого тривала 7–10 днів. Різниця між пацієнтами 1-ї та 2-ї груп за статтю та діагнозом була невірогідною (р > 0,05).
Субалін призначався по 1 флакону 2 рази на добу протягом 10 днів, починаючи з моменту призначення антибіо–тика. Інтервал між введенням функціонального харчового продукту Субалін та антибіотиків становив не менше від 4 годин.
У першу добу при надходженні та наступного дня після останньої дози антибіотика збирали фекалії для бактеріологічного дослідження на дисбактеріоз та визначення рівня секреторного імуноглобуліну А (sIgA). Рівень sIgA визначали методом твердофазного імуноферментного аналізу (ELISA) з використанням тест-систем sIgA-ИФА-БЕСТ виробництва ЗАТ «Вектор-Бест» (Росія).
Статистичну обробку проводили за допомогою методів варіаційної статистики з використанням непараметричного критерію Манна — Уїтні (U), критерію Пірсона (χ2), коефіцієнта рангової кореляції Спірмена (rs).
Результати дослідження
Протягом курсу антибактеріальної терапії прояви діареї спостерігались у 3 (10,0 %) дітей контрольної групи. Прояви діареї з’являлись з 3-го по 6-й день від початку введення антибіотиків і зберігалися 2–3 дні. При цьому частота дефекацій коливалась від 2 до 4 разів на добу, випорожнення ставали рідкими, з домішками слизу в невеликій кількості. Стан хворих з появою діареї не погіршувався, підвищення температури та зростання лейкоцитозу в крові не спостерігалось. Антибактеріальну терапію при появі діареї продовжували, але проводили корекцію харчування, збільшували кількість рідини, додавали сорбенти. У дітей, які отримували Субалін, прояви діареї були відсутні (р > 0,05).
Результати бактеріологічного дослідження фекалій на дисбактеріоз подані в табл. 2.
Як видно з табл. 2, вже при надходженні до стаціонару в дітей виявлялись дисбіотичні порушення: дещо знижений рівень загальної кількості кишкової палички та лактобактеріїй, збільшена кількість E.coli з гемолітичними властивостями. Після курсу антибактеріальної терапії в просвітній флорі кишечника відбувались переважно якісні зміни: зростала кількість грибів роду Candida та кишкової палички з гемолітичними властивостями. Додавання до терапії харчового продукту Субалін зменшувало негативний вплив антибіотиків: зростала кількість лактобактерій (р < 0,05), стримувався ріст грибів роду Candida (р < 0,05), умовно-патогенних ентеробактерій і кишкових паличок з гемолітичними властивостями.
Ми звернули увагу на те, що за даними бактеріологічного дослідження фекалій при надходженні до стаціонару 70 % дітей у кожній групі мали порушення кількісного та/або видового складу мікрофлори кишечника різного ступеня (табл. 3).
Після курсу антибактеріальної терапії кількість дітей без дисбіотичних порушень за даними бактеріологічного дослідження фекалій у контрольній групі зменшилась на 20,0 %, а серед дітей, які вживали додатково Субалін, збільшилась на 10 % (табл. 3). При цьому в контрольній групі в 5,5 раза зросла кількість хворих із дисбіозом ІІІ ступеня (р < 0,05), чого не спостерігалось при застосуванні Субаліну.
Отримані під час дослідження рівні секреторного імуноглобуліну А (sIgA) порівнювали з показниками здорових дітей: для дітей до 8 років життя — 28,7 ± 15,5 мкг/г, для старших дітей — 115,97–317,39 мкг/г [8]. Для зручності опису ці рівні приймали за норму.
Як видно з табл. 4, вихідні рівні sIgA відповідали показникам здорових дітей лише в 13,3 % пацієнтів у контрольній групі й у 16,7 % у другій групі. У переважної більшості дітей (73,3–76,6 %) в обох групах вихідні рівні sIgA перевищували показники здорових дітей. Після курсу антибактеріальної терапії кількість дітей з нормальним рівнем sIgA у фекаліях серед хворих контрольної групи зросла на 6,7 %, а серед дітей другої групи — на 43,3 % (різниця між групами вірогідна, р < 0,05). При цьому кількість пацієнтів з підвищеним рівнем sIgA в контрольній групі не змінилась, а в групі дітей, які приймали Субалін, зменшилась на 36,6 % (р < 0,05). В 1 із 3 дітей зі зниженими вихідними показниками sIgA ці показники в динаміці не змінились, що може вказувати на знижену резистентність організму, такі діти потребують поглибленого імунологічного обстеження для проведення імунокорегуючої терапії [9, 10]. У нашому дослідженні це були хворі з інфекційним мононуклеозом. У решти хворих із зниженими вихідними показниками після курсу антибактеріальної терапії рівень sIgA підвищився до нормальних показників.
За даними літератури, підвищенні рівні sIgA у фекаліях виявляють у дітей з дисбіозом кишечника, хронічною патологією шлунково-кишкового тракту, алергічними захворюваннями, у дітей, які часто хворіють [9, 10]. Це збігається з отриманими нами результатами, згідно з якими 70 % дітей при надходженні мали дисбіотичні порушення кишечника й у 73,3–76,6 % виявлялось підвищення рівня sIgA. За даними літератури, підвищення рівня sIgA у фекаліях при дисбіозах пов’язане частіше зі зниженням кількості нормофлори (лактобактерій, біфідобактерій) та збільшенням умовно-патогенних і/або патогенних мікроорганізмів [9–11]. Тому ми провели кореляційний аналіз між рівнем секреторного імуноглобуліну А у фекаліях та даними бактеріологічного дослідження фекалій. При проведенні кореляційного аналізу встановлено, що рівень підвищення sIgA прямо пропорційно залежав від росту кількості грибів роду Candida (rs = 0,609, p < 0,01). Також тенденція до зростання рівня секреторного імуноглобуліну А спостерігалась при зростанні кількості Stphyloccocus aureus, клебсієл та гемолізуючої флори (p > 0,05). Зростання кількості дітей з нормальними показниками sIgA і зменшення кількості дітей з підвищеним рівнем sIgA у фекаліях на фоні застосування препарату Субалін може вказувати на зменшення дисбіотичних порушень у кишечнику, що збігається з даними бактеріо–логічного дослідження. При цьому нормалізація рівня секреторного імуноглобуліну відбувається швидше, ніж показників бактеріологічного дослідження.
Виявлені кореляційні зв’язки між рівнем sIgA та змінами мікробіоценозу кишечника дозволяють розглядати цей показник як один з маркерів дисбіозу кишечника.
Отже, діарея на тлі антибактеріальної терапії розвивалась у 10,0 % дітей. Вживання харчового функціонального продукту Субалін запобігало розвитку ААД. Ми виявили, що 70 % дітей мають дисбіотичні порушення різного ступеня в кишечнику вже при надходженні до стаціонару. Застосування антибіотиків поглиблює ці зміни, переважно за рахунок росту умовно-патогенної флори (грибів роду Candida) та E.coli з гемолітичними властивостями. Вживання харчового функціонального продукту Субалін на тлі антибактеріальної терапії сприяє відновленню нормофлори кишечника, але не повністю нормалізує кількісний та якісний склад мікрофлори, що може бути пов’язано з коротким курсом призначення продукту.
Список литературы
1. Wistrom J., Norrby S.R., Myhre E.B. Frequencyof antibiotic-associated diarrhoea in 2462 antibiotic-treated hospitalized patients: a prospective study // J. Antimicrob. Chemother. — 2001. — Vol. 47. — P. 43-50.
2. Bartlett J.G. Antibiotic-associated diarrhea // N. Engl. J. Med. — 2002. — Vol. 346, № 5. — Р. 334-339.
3. Schubert A.M., Rogers M.A., Ring C. et al. Microbiome data distinguish patients with Clostridium difficile infection and non-C.difficile-associated diarrhea from healthy controls // M. Bio. — 2014. — № 6(5). — Р. 1-9.
4. Knecht H., Neulinger S.C., Heinsen F.A. et al. Effectsof β-lactam antibiotics and fluoroquinolones on human gut microbiota in relation to Clostridium difficile associated diarrhea // PLoS One. — 2014. — № 2(9). — Р. 1-8.
5. Скроцька О.І. Використання рекомбінованих мікроорганізмів для створення сучасних пробіотичних препаратів / О.І. Скроцька, С.О. Старовойтова, Ю.М. Пенчук // Наукові праці НУХТ. — 2012. — № 42. — С. 41-46.
6. Марушко Ю.В., Грачова М.Г., Марушко Є.Ю. Властивості B.subtilis та їх застосування в клінічній практиці // Здоровье ребенка. — 2015. — № 2 (61). — С. 123-126.
7. Псахис И.Б. Современные возможности и перспективы использования пробиотиков группы самоэлиминирующихся антагонистов в терапии инфекционных заболеваний / И.Б. Псахис, Т.Е. Маковская // Здоровье ребенка. — 2014. — № 4(55). — С. 91-95.
8. Набор реагентов для иммуноферментного определения концентрации секреторного иммуноглобулина А. Инструкция по применению. — Новосибирск: ЗАО «Вектор-Бест».
9. Конаныхина С.Ю., Сердюк О.А. Нифурател в лечении дисбактериоза у детей: эффективность и перспективы применения // Поликлиника. — 2011. — № 1. — С. 66-68.
10. Холодова И.Н., Ильенко Л.И., Демин В.Ф. и др. Новые возможности диагностики и лечения дисбиотических нарушений кишечника у детей // РМЖ. — 2003. — № 11. — С. 20-24.
11. Пилипенко В.И. Пробиотики как сигнальные молекулы: Saccharomyces boulardii // Клиническая гастроэнтерология и гематология. — 2008. — № 1(6). — С. 456-462.

/24-1.jpg)
/24-2.jpg)
/25-1.jpg)