Журнал «Актуальная инфектология» 2 (11) 2016
Вернуться к номеру
Особенности иммунного ответа на инфекцию Helicobacter pylori у детей с бронхиальной астмой
Авторы: Каличевская М.В. - ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
Рубрики: Инфекционные заболевания
Разделы: Медицинские форумы
Версия для печати
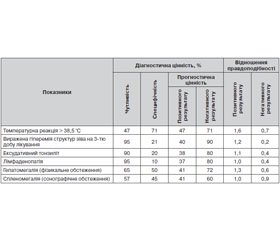
Актуальність. Перебіг бронхіальної астми в дітей нерідко супроводжується захворюваннями шлунково-кишкового тракту (ШКТ), асоційованими з Helicobacter рylori (H.pylori)-інфекцією. Наявність H.рylori сприяє активації та підтриманню запального процесу з вивільненням цитокінів і медіаторів запалення і наступними системними ефектами. Мета дослідження: вивчення особливостей продукції інтерферону-γ (IFN-γ) та інтерлейкіну‑4, -5 і -13 (IL‑4, -5, -13) як маркерів інтенсивності алергічного запалення в дітей, хворих на бронхіальну астму, інфікованих H.pylori. Матеріали та методи. Обстежено 120 дітей віком від 6 до 18 років із бронхіальною астмою. Ідентифікація H.pylori проводилася дихальним хелік-тестом (ТОВ «АМА», Росія). Сироваткові концентрації IFN-γ і IL‑4, -5 і -13 визначалися методом імуноферментного аналізу (тест-набори Diaklone, Франція) до і через 7 днів після закінчення лікування патології ШКТ. Статистичну обробку проводили за допомогою методів варіаційної статистики, реалізованих у пакеті прикладних програм Statistica 6.1. Результати. У 78 дітей із бронхіальною астмою була діагностована патологія ШКТ, у тому числі в 37 осіб — асоційована з інфекцією H.рylori. Для вивчення впливу H.pylori на перебіг бронхіальної астми діти були розділені на 3 групи: I група — 37 дітей із бронхіальною астмою і патологією ШКТ, інфікованих H.pylori, II — 41 Н.pylori-негативна дитина з бронхіальною астмою і патологією ШКТ, III — 42 Н.pylori-негативні дитини з бронхіальною астмою без патології ШКТ. Тривалість захворювання бронхіальною астмою в I групі становила 7,80 ± 0,17 року, у II — 5,90 ± 0,26 року, у III групі — 3,90 ± 0,48 року (p < 0,05). Наявність Н.рylori-інфекції в дітей із бронхіальною астмою супроводжувалася більш низькими концентраціями IFN-γ порівняно з дітьми ІІ групи (відповідно 8,47 ± 0,14 пг/мл і 9,69 ± 0,32 пг/мл, р < 0,05). Рівень IL‑13 у сироватці крові був вірогідно вищим у дітей I групи порівняно з пацієнтами ІІ групи (8,74 ± 0,22 пг/мл і 7,21 ± 0,35 пг/мл відповідно, р < 0,05). Сироваткові концентрації IL‑4 і -5 були підвищеними у всіх досліджуваних групах порівняно з групою контролю та не залежали від наявності інфекції Н.рylori. Після лікування патології травного тракту відзначалося поліпшення показників контролю над бронхіальною астмою, що супроводжувалося вірогідним зниженням концентрації IFN-γ та IL‑13 у I групі дітей і IFN-γ та IL‑5 і -13 — у II групі. Висновок. Наявність інфекції H.рylori в дітей із патологією травного тракту, що протікає на тлі бронхіальної астми, супроводжується дисбалансом імунної відповіді, що виражається в зниженні вироблення IFN-γ, IL‑4 і збільшенням IL‑13 порівняно з Н.рylori-негативними дітьми. Лікування патології ШКТ супроводжується зниженням IFN-γ та досліджуваних цитокінів, що клінічно сприяє поліпшенню параметрів контролю над бронхіальною астмою.
Актуальность. Течение бронхиальной астмы у детей нередко сопровождается заболеваниями желудочно-кишечного тракта (ЖКТ), ассоциированными с Helicobacter pylori (H.pylori)-инфекцией. Наличие H.рylori способствует активации и поддержанию воспалительного процесса с высвобождением цитокинов и медиаторов воспаления и последующими системными эффектами. Цель исследования: изучение особенностей продукции интерферона-γ (IFN-γ) и интерлейкина‑4, -5 и -13 (IL‑4, -5, -13) как маркеров интенсивности аллергического воспаления у детей, больных бронхиальной астмой, инфицированных H.pylori. Материалы и методы. Обследовано 120 детей в возрасте от 6 до 18 лет с бронхиальной астмой. Идентификация H.pylori проводилась дыхательным хелик-тестом (ООО «АМА», Россия). Сывороточные концентрации IFN-γ и IL‑4, -5 и -13 определялись методом иммуноферментного анализа (тест-наборы Diaklone, Франция) до и через 7 дней после окончания лечения патологии ЖКТ. Статистическую обработку проводили с помощью методов вариационной статистики, реализованных в пакете прикладных программ Statistica 6.1. Результаты. У 78 детей с бронхиальной астмой была диагностирована патология ЖКТ, в том числе у 37 человек — ассоциированная с инфекцией H.рylori. Для изучения влияния H.pylori на течение бронхиальной астмы дети были разделены на 3 группы: I группа — 37 детей с бронхиальной астмой и патологией ЖКТ, инфицированных H.pylori, II — 41 Н.pylori-негативный ребенок с бронхиальной астмой и патологией ЖКТ, III — 42 Н.pylori-негативных ребенка с бронхиальной астмой без патологии ЖКТ. Длительность заболевания бронхиальной астмой в I группе составила 7,80 ± 0,17 года, во II — 5,90 ± 0,26 года, в III группе — 3,90 ± 0,48 года (p < 0,05). Наличие Н.рylori-инфекции у детей с бронхиальной астмой сопровождалось более низкими концентрациями IFN-γ по сравнению с детьми II группы (соответственно 8,47 ± 0,14 пг/мл и 9,69 ± 0,32 пг/мл, р < 0,05). Уровень IL‑13 в сыворотке крови был достоверно выше у детей I группы по сравнению с пациентами II группы (8,74 ± 0,22 пг/мл и 7,21 ± 0,35 пг/мл соответственно, р < 0,05). Сывороточные концентрации IL‑4 и -5 были повышены во всех исследуемых группах по сравнению с группой контроля и не зависели от наличия инфекции Н.рylori. После лечения патологии пищеварительного тракта отмечалось улучшение показателей контроля над бронхиальной астмой, которое сопровождалось достоверным снижением концентраций IFN-γ и IL‑13 в I группе детей и IFN-γ и IL‑5 и -13 — во II группе. Вывод. Наличие инфекции H.рylori у детей с гастродуоденальной патологией, протекающей на фоне бронхиальной астмы, сопровождается дисбалансом иммунного ответа, который выражается в снижении выработки IFN-γ, IL‑4 и увеличением IL‑13 по сравнению с Н.рylori-негативными детьми. Лечение патологии ЖКТ сопровождается снижением IFN-γ и исследуемых цитокинов, что клинически способствует улучшению параметров контроля над бронхиальной астмой.
Introduction. The course of bronchial asthma in children is often accompanied by gastrointestinal (GI) diseases associated with H.pylori infection. The presence of H.pylori leads to the activation and maintenance of inflammatory process with release of cytokines and mediators of inflammation and subsequent systemic effects. Objective: to study the peculiarities of interferon gamma (IFN-γ) and interleukin (IL)-4, -5 and -13 production as markers of allergic inflammation severity in children with bronchial asthma infected with H.pylori. Materials and methods. There were examined 120 children with bronchial asthma aged 6 to 18 years. Identification of H.pylori was carried out with the help of breathing Helic-test (LLC AMA, Russia). Serum concentrations of IFN-γ and IL‑4, -5 and -13 were determined by enzyme-linked immunoassay (Diaclone test-kits, France) before and 7 days after the end of treatment for GI pathology. Statistical processing was performed using the methods of variation statistics implemented in the software package Statistica 6.1. Results. 78 children with bronchial asthma were diagnosed with GI disease, including 37 cases associated with H.pylori infection. To study the influence of H.pylori on the course of bronchial asthma, children were divided into 3 groups: I group — 37 children with bronchial asthma and GI pathology, infected with H.pylori, II — 41 H.pylori-negative children with bronchial asthma and GI pathology, III — 42 H.pylori-negative children with bronchial asthma without GI disorders. Duration of bronchial asthma in group I was 7.80 ± 0.17 years, in II — 5.90 ± 0.26 years, in group III — 3.90 ± 0.48 years (p < 0.05). The presence of H.pylori infection in children with bronchial asthma was accompanied by lower concentrations of IFN-γ compared to children of group II (8.47 ± 0.14 pg/ml and 9.69 ± 0.32 pg/ml, respectively, p < 0.05). The level of IL‑13 in the blood serum was significantly higher in children of I group versus patients of group II (8.74 ± 0.22 pg/ml and 7.21 ± 0.35 pg/ml, respectively, p < 0.05). Serum concentrations of IL‑4 and IL‑5 were increased in all studied groups compared to the control group and had no correlation with the presence of H.pylori infection. After the treatment of gastrointestinal pathology, there was an improvement in parameters of asthma control, which was associated with a significant reduction of IFN-γ and IL‑13 concentrations in group I, and IFN-γ, IL‑5 and -13 — in group II. Conclusion. The presence of H.pylori infection in children with gastroduodenal pathology occurring against the background of bronchial asthma is accompanied by an imbalance of the immune response, which manifested as reduced production of IFN-γ, IL‑4, and IL‑13 increase compared to H.pylori-negative children. Treatment of GI diseases is associated with a decrease in IFN-γ and cytokines mentioned above that clinically promotes the improvement of bronchial asthma control.
діти, бронхіальна астма, H.pylori-інфекція, цитокіни.
дети, бронхиальная астма, H.pylori-инфекция, цитокины.
children, bronchial asthma, H.pylori-infection, cytokines.
Статья опубликована на с. 166-170
Работа выполнена в рамках НИР кафедры педиатрии 3 и неонатологии ГУ «Днепропетровская медицинская академия МЗ Украины»: «Разроботка технологий диагностики, лечения и профилактики соматической и неврологической патологии у детей разных возрастных групп» (государственный регистрационный № 0113U007654).
Введение
Материалы и методы
Результаты
Обсуждение
Вывод
1. Бельмер С.В. Helicobacter pylori и аллергия / С.В. Бельмер, Т.В. Гасилина, М. Аль Хатиб // Новости медицины и фармации. — 2007. — № 13. — С. 10.
2. Бєлих Н.А. Сучасні підходи до діагностики та терапії бронхообструктивного синдрому інфекційного ґенезу в дітей / Бєлих Н.А., Заливна Л.А. // Актуальная инфектология. — 2015. — № 1(6). — С. 88-93.
3. Варюшина Е.А. Инфекция Нelicobacter pylori: регуляторная роль цитокинов при воспалении и аллергии / Е.А. Варюшина, А.С. Симбирцев // Российский аллергологический журнал. — 2010. — № 2. — С. 13-22.
4. Abadi А. Helicobacter pylori Infection and Asthma / Amin T.B. Abadi // J. Gastroenterology Hepatology Research. — 2014. — Vol. 21, № 30. — Р. 937-938. — DOI: 10.6051/j.issn.2224-3992.2014.04.434.
5. Blaser M.J. Does Helicobacter pylori protect against asthma and allergy? / M.J. Blaser, Yu Chen, J. Reibman // Gut. — 2008. — Vol. 57 — P. 561-567. — DOI: 10.1136/gut.2007.133462.
6. Global Strategy For Asthma Management And Prevention. Revised 2014. [Электронный ресурс]. — Режим доступа: http://www.ginasthma.org
7. Helicobacter pylori infection and extragastric disorders in children: A critical update / L. Pacifico, J. Osborn, V. Tromba, S. Romaggioli et al. // World J. Gastroenterol. — 2014. — Vol. 20, № 6. — Р. 1379-1401. — DOI: 10.3748/wjg.v20.i6.1379.
8. The effect of Helicobacter pylori on asthma and allergy / A. Amedei, G. Codolo, G. Del Prete et al. // J. Asthma Allergy. — 2010. — Vol. 3. — P. 139-47. — DOI: 10.2147/JAA.S8971.
9. Wang Q. The association between asthma and Helicobacter pylori: a meta-analysis / Qiang Wang, Chaoran Yu, Yi Sun // Helicobacter. — 2013. — Vol. 18, № 1. — Р. 41-53. — DOI: 10.1111/hel.12012.

/168.jpg)