Журнал «Актуальная инфектология» 2 (11) 2016
Вернуться к номеру
Стан прооксидантно-антиоксидантної регуляції у хворих на серозні менінгіти
Авторы: Задирака Д.А., Рябоконь О.В., Фурик О.О. - Запорізький державний медичний університет, м. Запоріжжя, Україна; Гостіщева О.І., Фірюліна О.М. - КУ «Обласна інфекційна клінічна лікарня» ЗОР, м. Запоріжжя, Україна
Рубрики: Инфекционные заболевания
Разделы: Медицинские форумы
Версия для печати
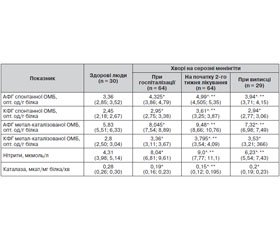
Актуальність. Серозні менінгіти займають провідне місце серед уражень центральної нервової системи, питома вага яких у структурі нейроінфекцій коливається від 25 до 70 %. Дисбаланс у функціонуванні прооксидантно-антиоксидантної системи відіграє провідну роль у пошкодженні нервових клітин та призводить до їх загибелі. Мета дослідження: дослідити показники прооксидантно-антиоксидантної регуляції в динаміці захворювання у хворих на серозні менінгіти. Матеріали і методи. Під спостереженням перебували 64 хворі на серозні менінгіти віком від 18 до 74 років. Спектрофотометричним методом визначали вміст у сироватці крові хворих на серозні менінгіти стабільних метаболітів оксиду азоту — нітритів, показників спонтанної та метал-каталізованої окисної модифікації білка, а також активність каталази. Контрольну групи становили 30 здорових осіб. Результати. У хворих на серозні менінгіти при госпіталізації на тлі домінування клінічних ознак загальноінтоксикаційного, загальномозкового, менінгеального синдромів виявлено підвищення (р < 0,0001) показників спонтанної та метал-каталізованої окисної модифікації білка, вмісту нітритів у поєднанні з низькою (р < 0,0001) активністю каталази у сироватці крові порівняно зі здоровими людьми. На початку другого тижня загальноприйнятого лікування певне регресування клінічної симптоматики у хворих на серозні менінгіти супроводжувалось поглибленням дисбалансу показників прооксидантно-антиоксидантної регуляції в бік процесів вільнорадикального окислення, який залишався й на момент виписки хворих зі стаціонару. Висновки. У хворих на серозні менінгіти при госпіталізації виявлено дисбаланс показників прооксидантно-антиоксидантної регуляції, який поглиблювався на другому тижні загальноприйнятого лікування та залишався на момент виписки хворих зі стаціонару.
Актуальность. Серозные менингиты занимают ведущее место среди поражений центральной нервной системы, удельный вес которых в структуре нейроинфекций колеблется от 25 до 70 %. Дисбаланс в функционировании прооксидантно-антиоксидантной системы играет ведущую роль в повреждении нервных клеток и приводит к их гибели. Цель исследования: исследовать показатели прооксидантно-антиоксидантной регуляции в динамике заболевания у больных серозными менингитами. Материалы и методы. Под наблюдением находилось 64 больных серозными менингитами в возрасте от 18 до 74 лет. Спектрофотометрическим методом определяли содержание в сыворотке крови больных серозными менингитами стабильных метаболитов оксида азота — нитритов, показателей спонтанной и металл-катализируемой окислительной модификации белка, а также активность каталазы. Контрольную группу составили 30 здоровых лиц. Результаты. У больных серозными менингитами при госпитализации на фоне доминирования клинических признаков общеинтоксикационного, общемозгового, менингеального синдромов выявлено повышение (р < 0,0001) показателей спонтанной и металл-катализируемой окислительной модификации белка, содержания нитритов, в сочетании с низкой (р < 0,0001) активностью каталазы в сыворотке крови по сравнению со здоровыми людьми. В начале второй недели общепринятого лечения определенное регрессирование клинической симптоматики у больных серозными менингитами сопровождалось углублением дисбаланса показателей прооксидантно-антиоксидантной регуляции в сторону процессов свободно-радикального окисления, которое сохранялось и на момент выписки больных из стационара. Выводы. У больных серозными менингитами при поступлении обнаружен дисбаланс показателей прооксидантно-антиоксидантной регуляции, который углублялся на второй неделе общепринятого лечения и сохранялся на момент выписки пациентов из стационара.
Introduction. Serous meningitis takes a leading place among the central nervous system lesions, the share of which in neuroinfections structure ranges from 25 to 70 %. The imbalance in the functioning of prooxidant-antioxidant system plays a leading role in the damage of the nerve cells and leads to their death. Objective. To explore indicators of prooxidant-antioxidant regulation in the dynamics of the disease in patients with serous meningitis. Materials and methods. We observed 64 patients with serous meningitis at the age of 18 to 74 years old. Spectrophotometric method was used to determine the blood serum stable metabolites of nitric oxide — nitrites, spontaneous performance and metal-catalyzed oxidative protein modifications and catalase activity in the patients with serous meningitis. The control group consisted of 30 healthy individuals. Results. In the patients with serous meningitis at admission on the background of the dominance of clinical signs of general intoxication, cerebral, meningeal syndromes there were increased (p < 0.0001) indicators of spontaneous and metal-catalyzed oxidative modification of protein, nitrite, in combination with low (p < 0.0001) catalase activity in serum compared to healthy individuals. At the beginning of the second week of the treatment of the patients with serous meningitis the certain regression of clinical symptoms was accompanied by a deepening imbalance of indicators of prooxidant-antioxidant regulation towards the process of free-radical oxidation, which remained at discharge from hospital. Conclusions. In the patients with serous meningitis on admission there was revealed the imbalance of the indicators of prooxidant-antioxidant regulation, which deepened on the second week and remained during the standard treatment till the discharge from hospital.
серозний менінгіт, окисна модифікація білка, нітрити, каталаза.
серозный менингит, окислительная модификация белков, нитриты, каталаза.
serous meningitis, protein oxidative modification, nitrites, catalase.
Статтю опубліковано на с. 155-159
Серозні менінгіти (СМ) займають провідне місце серед уражень центральної нервової системи, питома вага яких у структурі нейроінфекцій коливається від 25 до 70 % [4, 5, 8, 9]. Протягом останніх років відмічається збільшення захворюваності на дану патологію не тільки в Україні, але й у багатьох країнах світу [1, 3].
Матеріали і методи
Результати
Обговорення
Висновок
1. Бойко Л.Т. Современные методы лабораторной диагностики серозных менингитов / Л.Т. Бойко // Український вісник психоневрології. — 2014. — Т. 22, № 2(79). — С. 25-27.
2. Геморрагическая лихорадка с почечным синдромом / Р.А. Слонова, Е.А. Ткаченко, В.А. Иванис, Г.Г. Компанец. — Владивосток: Примполиграфкомбинат, 2006. — 246 с.
3. Евтушенко В.В. Особенности острых нейроинфекций в клинике детских инфекционных болезней г. Киева / В.В. Евтушенко, А.И. Марков, С.А. Крамарев, Н.Г. Литвиненко [и др.] // Атуальная инфектология. — 2015. — № 4(9). — С. 94-97.
4. Ланкин В.З. Окислительный стресс как фактор риска осложнения сердечно-сосудистых заболеваний и преждевременного старения при действии неблагоприятных климатических условий / В.З. Ланкин, А.Ю. Постнов, О.В. Родненков [и др.] // Кардиологический вестник. — 2013. — № 8(20). — С. 18-22.
5. Лобзин Ю.В. Энтеровирусные инфекции: [руководство для врачей] / Ю.В. Лобзин, Н.В. Скрипченко, Е.А. Мурина. — СПб.: НИИДИ, 2012. — 432 с.
6. Мітус Н.В. Аналіз помилок у діагностиці менінгеального синдрому на догоспітальному етапі / Н.В. Мітус, А.С. Скицюк // Сучасні інфекції. — 2010. — № 2. — С. 72-78.
7. Рациональная нейропротекция / И.Ф. Беленичев, В.И. Черний, Ю.М. Колесник и др. — Донецк: Издатель Заславский А.Ю., 2009. — 262 с.
8. Ремизова М.И. Роль оксида азота в норме и при патологии / М.И. Ремизова // Вестник службы крови России. — 2000. — № 2. — С. 53-57.
9. Энтеровирусная (неполио) инфекция у детей (эпидемиология, этиология, диагностика, клиника, лечение, профилактика, организация оказания медицинской помощи при возникновении вспышки заболеваний): [метод. рекомендации] / Н.В. Скрипченко, Г.П. Иванова, Е.А. Мурина и др. — СПб.: НИИДИ, 2013. — 41 с.
10. Archim-baut С. Impact of rapid enterovirus molecular diagnosis on the management of infants, children, and adults with aseptic meningitis / С. Archim-baut [et al.] // J. Med. Virol. — 2009. — V. 81, № 1. — P. 42-48. — Doi: 10.1002/jmv.21330.
11. Artinian L. Nitric oxide as intracellular modulator: internal production of NO increases neuronal excitability via modulation of several ionic conductances / L. Artinian, L. Zhong, H. Yang, V. Rehder // Eur. J. Neurosci. — 2012. — № 36(10). — Р. 3333-3343. — Doi: 10.1111/j.1460-9568.2012.08260.x.
12. Hopps E. Protein oxidation in metabolic syndrome / E. Hopps, G. Caimi // Clin. Invest. Med. — 2013. — Vol. 36, № 1. — P. E1-E8. — PMID: 23374595.
13. Hye-Lin. Oxidative stress and antioxidants in hepatic pathogenesis / Hye-Lin, Hye-Jun Shin, Mark A. Feitelson [et al.] // Wordl Journal of Gastroenterology. — 2010. — Vol. 16. — Р. 6035-6043. — Doi: 10.3748/wjg.v16.i48.6035.
14. Selvakumar K. Polychlorinated biphenyls induced oxidative stress mediated neurodegeneration in hippocampus and behavioral changes of adult rats: Anxiolytic-like effects of quercetin / K. Selvakumar, S. Bavithra, L. Ganesh [et al.] // Toxicol. Lett. — 2013. — № 222(1). — Р. 45-54. — Doi: 10.1016/j.toxlet.2013.06.237.
15. Staibano S. Critical role of CCDC6 in the neoplastic growth of testicular germ cell tumors / S. Staibano, G. Ilardi, V. Leone [et al.] // BMC Cancer. — 2013. — № 13(1). — Р. 433. — Doi: 10.1186/1471-2407-13-433.
16. Zhiyou Cai. Proten Oxidative Modifications: Beneficial Roles in Disease and Health / Cai Zhiyou, Yan LiangJun // J. Biochem. Pharmacol. Res. — 2013. — Vol. 1, № 1. — P. 15-26. — PMCID: PMC3646577, PMID: 23662248.

/156.jpg)