Статья опубликована на с. 62-66
Вступ
Останніми десятиліттями бронхіальна астма (БА) міцно посідає позиції серед найбільш частих форм хронічної патології дитячого віку. Особливо часто трапляється ця патологія у субпопуляції дітей, які мають ознаки атопії — успадкованої схильності до гіперпродукції імуноглобуліну E (IgE). В основі бронхіальної астми лежить хронічне запалення дихальних шляхів з імунними порушеннями [4], що вимагає проведення довготривалої протизапальної терапії. Симптоми та загострення БА провокуються різними факторами, зокрема інфекційними збудниками (у першу чергу вірусними), аероалергенами неінфекційного походження, фізичним навантаженням, компонентами тютюнового диму, хімічними іритантами тощо [3]. Багатофакторний характер формування БА, що включає генетичну схильність, вплив навколишнього середовища, імунні та нейрогенні ланки неспецифічної і специфічної гіперреактивності, роль інфекційних факторів, вимагає врахування кожного патогенетичного компонента, здатного впливати на перебіг астми [1]. З огляду на це детальне вивчення ролі імунних зрушень у формуванні астма-фенотипу залишається актуальним завданням сучасної педіатрії й алергології.
Відомо, що до складних імунологічних механізмів розвитку астми залучаються численні клітини [5], що відіграють ключову роль у формуванні гіперсприйнятливості дихальних шляхів у дітей. Зокрема, внаслідок антигенної стимуляції первинних ефекторних клітин вивільняються медіатори, здатні викликати алергічну реакцію негайного або сповільненого типу. Процес диференціювання В-лімфоцитів у клітини, що продукують IgE, при БА провокується впливом різноманітних алергенів та контролюється Т-лімфоцитами [2]. У свою чергу, дендритні клітини та макрофаги виконують функцію розщеплення причинно-значущих антигенів до пептидів та презентації їх Т-лімфоцитам-хелперам в асоціації з молекулами гістосумісності класу ІІ. Внаслідок цього виділяється низка цитокінів і факторів росту, що стимулюють дозрівання специфічних Т-клітин, а також переважне диференціювання CD4+ клітин у Th2-хелпери. Даний механізм є ключовим щодо розвитку IgE-опосередкованих алергічних реакцій. Водночас при активації вторинних ефекторних клітин крові відбувається їх дегрануляція з викидом агресивних внутрішньоклітинних продуктів, що поглиблюють запальний процес і сприяють формуванню гіперспри-йнятливості бронхів шляхом подразнення аферентних закінчень блукаючого нерва (набряк і гіперсекреція слизу) та безпосереднього впливу на мускулатуру бронхів (бронхоспазм).
Оскільки гострі інфекційні захворювання (у першу чергу вірусні) мають одночасно провокуючий [6, 8] та протекторний вплив на розвиток БА, [7] цікавим видається питання щодо відмінностей у патофізіологічних механізмах розвитку захворювання за тригерної ролі різних внутрішніх та зовнішніх факторів. Існує припущення стосовно наявності таких розбіжностей у патогенетичних механізмах, що сприяють формуванню астма-фенотипу під впливом різних варіантів генетичного поліморфізму, а також елементів навколишнього середовища, зокрема інфекційних тригерів.
З огляду на це метою дослідження було вивчити особливості імунограми периферійної крові у хворих на БА школярів з ознаками фебрильних загострень захворювання.
Мета роботи— вивчити імунологічні показники у дітей, хворих на бронхіальну астму, залежно від наявності підвищеної температури тіла у нападному періоді.
Матеріал і методи
Для досягнення мети роботи обстежено 119 дітей шкільного віку на базі пульмонологічного відділення обласної дитячої клінічної лікарні м. Чернівців, з яких у подальшому сформували дві групи порівняння залежно від ознак гострої респіраторної інфекції (ГРІ) під час нападу, що асоціювала з наявністю лихоманки. Першу (І, основну) клінічну групу становили 83 дитини, хворі на БА, в яких спостерігалася підвищена температура тіла при надходженні до стаціонару (середній вік 10,70 ± 0,57 року, 61,1 % хлопців, 52,8 % сільських жителів). До складу другої (ІІ) групи порівняння увійшло 36 хворих без лихоманки (середній вік 10,40 ± 0,31 року, 68,7 % хлопчиків, 62,7 % сільських мешканців). За основними клінічними характеристиками групи були порівнянними.
Комплекс імунологічних досліджень периферійної крові включав визначення рецепторів до моноклональних антитіл CD-3, CD-4, CD-8 на лімфоцитах крові, вміст Т-лімфоцитів за даними спонтанної розеткоутворювальної здатності лімфоцитів з еритроцитами барана за методикою M. Jondal і співавт. у модифікації Е.Ф. Чернушенко і співавт.; оцінку фагоцитарної активності та фагоцитарного числа нейтрофільних лейкоцитів за Е.Ф. Чернушенко; визначення киснезалежного метаболізму еозинофільних та нейтрофільних гранулоцитів крові — за даними спонтанного та стимульованого НСТ-тесту в модифікації В.В. Климова і співавт.; визначення вмісту в сироватці крові імуноглобулінів класів А, М, G — методом радіальної імунізації в агарі за Manchini G. et al. (1965); оцінку активності системи комплементу з урахуванням загальної комплементарної активності — за Е.Ф. Чернушенко; вивчення циркулюючих імунних комплексів (ЦІК) здійснювали за методикою І.Л. Константинової; визначення вмісту інтерлейкінів-4, -5 і -8 у сироватці крові — твердофазним імуноферментним методом; дослідження вмісту загального IgE у сироватці крові — шляхом двосайтового імуноферментного аналізу.
Отримані результати аналізували за допомогою пакета програм Statistica 7.0 StatSoft Inc. з використанням параметричних і непараметричних методів обчислення, а також методів біостатистики та клінічної епіде-міології. Діагностичну цінність показників оцінювали за чутливістю, специфічністю (СТ), передбачуваною цінністю позитивного і негативного результату, відношенням правдоподібності, відношенням шансів (ВШ), абсолютним ризиком (АР), посттестовою вірогідністю позитивного результату.
Результати та їх обговорення
Оцінка клінічних симптомів перебігу нападу БА у групах дітей, сформованих залежно від наявності лихоманки, що супроводжувала ГРІ, дозволила виявити значні відмінності. Так, у пацієнтів І групи у 44,4 % випадків траплялися ознаки інтоксикації, у 50,0 % визначалася гіперемія слизової оболонки зіву, у 72,1 % — ознаки риніту, що підкреслювало роль інфекційної природи тригерів, які провокували напади БА у хворих. У групі порівняння дещо рідше траплялися симптоми інтоксикації (8,4 %; P < 0,05), гіперемія слизової зіву (19,3 %, P < 0,05) та явища риніту (62,6 %, P > 0,05). Тяжкий непродуктивний кашель траплявся в 11,1 % дітей І групи; середньої сили кашель турбував 86,1 % дітей цієї групи. У групі порівняння такі симптоми відзначалися відповідно у 3,61 та 91,6 % спостережень (в усіх випадках P > 0,05).
Серед хворих І групи явища помірної задишки експіраторного характеру відзначені у 80,5 %, тяжка задишка мала місце у 5,5 % випадків. У представників ІІ групи тяжка задишка реєструвалася в 1,2 % спостережень, помірна — у 79,5 % випадків (P > 0,05). Дуже тяжкий візинг відзначався у 5,5 % у дітей І групи проти 1,2 % у ІІ групі (P > 0,05), помірно виражений — відповідно у 88,9 та 95,2 % спостережень (P > 0,05), відчуття стискання у грудях відзначали 47,2 % представників І групи і 30,1 % дітей ІІ групи порівняння (P > 0,05). Здута грудна клітка, що свідчила про значну гіперінфляцію легень, визначалася при огляді дітей груп порівняння відповідно у 77,8 і 60,2 % випадків (P < 0,05), тимпанічний перкуторний звук отримано у 69,4 та 77,1 % випадків відповідно (P > 0,05). Отже, напади БА мали типовий перебіг і принципових розбіжностей за клінічними ознаками не спостерігалось.
Беручи до уваги імунні патогенетичні механізми формування запального процесу бронхів при БА, автори вважали доцільним вивчити показники імунограми периферійної крові у пацієнтів груп порівняння. Так, встановлені певні відмінності у показниках вмісту імунокомпетентних лімфоцитів у периферійній крові, визначених методом CD-типування та розеткоутворення (табл. 1).
При цьому встановлено статистично значущі відмінності у вигляді зниження відносного вмісту субпопуляцій лімфоцитів, функція яких асоціює з хелперною, супресорною, а також зрілими В-лімфоцитами (CD4, CD8, CD22), що в цілому збігається з даними літератури та свідчить про міграцію хелперів у слизову оболонку дихальних шляхів (табл. 2).
У табл. 3 наведені показники середнього вмісту імуноглобулінів основних класів у сироватці крові дітей, які увійшли до складу клінічних груп порівняння.
Отже, у дітей із фебрильними нападами БА, можливо, спровокованими інфекційними факторами, виявляється незначно більший уміст імуноглобулінів основних класів та загального IgЕ в сироватці крові, що, можливо, відбивало неоднорідність тригерних факторів, які загострюють перебіг БА, а також наявність серед них як неінфекційних, так і інфекційних стимулів.
З огляду на встановлені тенденції видавалося доцільним вивчити концентрацію в сироватці крові хворих дітей умісту основних інтерлейкінів (ІЛ-4, -5, -8), що продукуються досліджуваними імунокомпетентними клітинами (табл. 4).
Отримані дані свідчать про те, що у хворих із фебрильними нападами БА провідну роль у реалізації запального процесу відіграє ІЛ-5, що активує еозинофільні гранулоцити, і меншу — ІЛ-8, який рекрутує з кісткового мозку нейтрофільні лейкоцити та активує їх адгезивні молекули.
Встановлено деякі відмінності у показниках умісту циркулюючих імунних комплексів та активності системи комплементу в дітей груп порівняння. Отримані дані дають підстави вважати, що в обстежених хворих із підвищеною температурою тіла у періоді нападу БА в крові відзначено збільшення вмісту ЦІК на фоні посиленої активації системи комплементу. Так, середній уміст ЦІК у представників І групи становив 164,50 ± 9,29 од.опт.щільн., ІІ групи — 148,60 ± 5,44 од.опт.щільн. (P > 0,05) при регіональній нормі вмісту ЦІК у практично здорових дітей 120,0 од.опт.щільн. Активність комплементу відповідно сягала 0,060 ± 0,008 ум.од. та 0,040 ± 0,002 ум.од. (P < 0,05).
Наявність у дитини фебрильних нападів БА перед-бачала активацію вторинних ефекторних клітин та перш за все їх киснезалежних процесів. З огляду на це проаналізовано показники спонтанного і стимульованого НСТ-тесту нейтрофільних гранулоцитів крові у групах порівняння (табл. 5).
Таким чином, виявлено статистично значущі міжгрупові відмінності у середніх показниках тесту з нітросинім тетразолієм у спонтанному і стимульованому пірогеналом варіантах зі значним зниженням індексу стимуляції нейтрофілів периферійної крові, що обчислюється шляхом віднесення результатів стимульованого НСТ-тесту до показників спонтанного варіанта (у представників І групи — 1,13 ± 0,08 ум.од., у хворих ІІ групи — 1,47 ± 0,10 ум.од.; P < 0,05). Можливо, це вказувало на певну виснаженість здатності нейтрофілів до дегрануляції у процесі нейтрофіл-опосередкованого алергічного запалення бронхів у дітей з інфекційно-залежними нападами захворювання.
Разом із тим наявність лихоманки під час нападу БА асоціювала з ризиком зростання киснезалежної мікробіцидності нейтрофілів у периферійній крові понад 35,0 % (ВШ — 2,7, ВР — 1,8, АР — 0,24), їх цитохімічним коефіцієнтом (ЦХК) понад 0,41 ум.од. (ВШ — 2,6, ВР — 1,9, АР — 0,2) та індексом стимуляції даних клітин менше ніж 1,13 ум.од. (ВШ — 2,3, ВР — 1,8, АР — 0,18).
Знижений уміст імунокомпетентних Т-лімфоцитів, зокрема Т-хелперної та супресорної їх субпопуляції, підвищення вмісту в сироватці крові IgЕ, ІЛ-5 та ЦІК, а також ознаки виснаження здатності нейтрофілів периферійної крові до респіраторного вибуху — це імунологічні ознаки, що характеризують особливості інфекційно-залежних нападів БА та міграцію ефекторних клітин і Т-хелперів 2-го типу у дихальні шляхи. Попри високий уміст у сироватці ІЛ-5, не встановлено суттєвих розбіжностей у показниках киснезалежного метаболізму еозинофілів крові у групах порівняння, хоча саме даний цитокін рекрутує з кісткового мозку, запускає проліферацію та диференціювання ацидофільних гранулоцитів крові. Цікаво, що виявлені закономірності не повторювалися при вивченні показників киснезалежного метаболізму еозинофільних гранулоцитів у крові обстежених хворих (табл. 6).
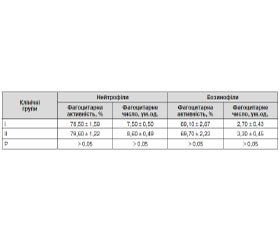
Разом із тим фагоцитарні функції гранулоцитів крові, зокрема показник фагоцитарної активності та фагоцитарного числа, мали тенденцію до зростання у дітей ІІ клінічної групи (табл. 7).
Висновки
Отже, процес хронічного запалення при БА за наявності фебрильних нападів вирізняється певними імунологічними особливостями, що полягають у тенденціях до зменшеного вмісту імунокомпетентних Т-лімфоцитів та їх субпопуляцій CD3, CD4, CD8, збільшення вмісту в сироватці крові імуноглобулінів А, М, G та E, зростанні вмісту ІЛ-5. За даними НСТ-тесту нейтрофілів крові у таких пацієнтів визначається активація киснезалежного метаболізму у поєднанні зі зменшенням їх індексу стимуляції, а також відзначається тенденція до зниження фагоцитарних функцій гранулоцитів крові.

/64.jpg)
/65.jpg)