Статья опубликована на с. 38-41
Відомо, що бешиха — це захворювання, яке часто дає рецидиви, що спричинюють повторні випадки тимчасової втрати працездатності. Лімфостаз, що формується при рецидивах бешихи, може спричиняти косметичні дефекти (якщо бешиха локалізується на обличчі) та навіть інвалідизацію (якщо формується слоновість у разі розвитку бешихи на ногах). Ушкодження на шкірі внаслідок бешихи у поєднанні з лімфостазом і місцевим порушенням кровообігу можуть бути воротами для проникнення гнійної флори, подальшого розвитку місцевих абсцесів, флегмон або навіть генералізованого процесу (сепсису). Тому особливого значення набуває не тільки своєчасне розпізнавання цього захворювання, але й адекватне сучасне лікування, що допомагає позбавити хворого від ускладнень та рецидивів [1].
Етіотропна терапія бешихи сьогодні регламентована, однак досі немає чітких рекомендацій стосовно використання багатьох патогенетичних середників, передусім імунотропних препаратів. Водночас, оскільки бешиха є інфекційно-алергічним захворюванням, засобам, здатним коригувати наявні імунні зрушення при цій патології, очевидно, належатиме дуже важлива роль. Актуальність цього напряму у підвищенні ефективності терапії хворих на бешиху визначається ще й тим, що тяжкість патологічного процесу, розвиток ускладнень або формування загрозливих для життя станів також значною мірою зумовлені глибиною порушень імунної реакції організму і зниженням його неспецифічної резистентності. До числа таких порушень належать розлади реакції цитокінового ряду.
Останніми роками відкриття цитокінів і вивчення їх ролі в патогенезі широкого кола захворювань визначили пріоритети їх дослідження при різній патології, у тому числі при інфекційних захворюваннях. У клінічній практиці дослідження цитокінового статусу дозволяє оцінити перебіг процесу і прогнозувати наслідок хвороби при багатьох інфекціях, об’єктивно оцінити ефективність терапії, особливо при використанні імуномодулювальних та імунокоригувальних засобів. Цитокіни також відображають індивідуальну первинну реакцію на етіотропний агент [2–5].
Цитокіни є групою поліпептидних медіаторів, що беруть участь у формуванні й регуляції захисних реакцій організму, вони залучені фактично в кожну ланку імунітету [5, 6].
Діагностична значущість оцінки рівня цитокінів полягає в констатації самого факту його підвищення або зниження в конкретного хворого, причому для оцінки тяжкості та прогнозування перебігу недуги доцільно визначати концентрацію як про-, так і протизапальних цитокінів у динаміці патології.
Серед прозапальних цитокінів найважливіше значення мають фактор некрозу пухлини альфа, інтерлейкін-1 (ІЛ-1), -6, -8 та -12, яким протистоять протизапальні цитокіни — ІЛ-4, -10, -11, -13. Вважають, що медикаменти, здатні відновлювати баланс між про- і протизапальними цитокінами, матимуть суттєве значення в лікуванні багатьох захворювань [7, 8].
При такій бактерійній інфекції з алергічним компонентом, як бешиха, цитокіновий дисбаланс очікуваний, тож його корекція матиме вагоме значення для досягнення максимального терапевтичного ефекту.
Нашу увагу привернув принципово новий імунотропний препарат алокін-альфа (реєстраційне посвідчення № UA/8668/01/01 від 23.09.2013 р.). Його діючою речовиною є цитокіноподібний пептид алоферон. Препарат запатентований в Україні, Росії, США, Японії, Південній Кореї і країнах Євросоюзу, випускається на потужностях виробництва «Біофарма» (м. Київ) за ліцензією фармацевтичної компанії «Геолік Фарм Маркетинг Груп» (GFMG).
В основу створення алокіну-альфа лягла еволюційно відшліфована комахами здатність алоферонів (олігопептиди імунної системи комах) «забороняти» виключення цитокінів [9].
На відміну від відомих імунотропних препаратів алокін-альфа виступає кофактором, дозволяючи лейкоцитам ефективно реагувати на вірусний чи бактерійний антиген. Це дає можливість сфокусувати дію препарату в місці розмноження збудника й уникнути надлишкової реакції лейкоцитів за межами вогнища інфекції [10].
Мета роботи — аналіз імунного статусу хворих на рецидивуючу бешиху та підвищення ефективності їх лікування шляхом включення до загальноприйнятої схеми зазначеного імунотропного препарату алокін-альфа.
Матеріал і методи
У дослідження було включено 38 хворих (15 чоловіків і 23 жінки) на еритематозну форму бешихи середнього ступеня тяжкості. Вік хворих коливався від 44 до 63 років. Першу (дослідну) групу становили 18 осіб, які на фоні традиційного лікування додатково отримували 6 підшкірних ін’єкцій алокіну-альфа в дозі 1 мг через один день. До 2-ї (конт-рольної) групи увійшло 20 пацієнтів, яким проводили тільки загальноприйняту етіотропну (бета-лактамні препарати у середньотерапевтичних дозах) та патогенетичну терапію (дезінтоксикаційні середники, дезагреганти, нестероїдні протизапальні, антигістамінні та вітамінні препарати). Будь-якого місцевого лікування хворим не призначали.
Групи були рандомізовані за статтю, віком, клінічними характеристиками. Діагностику здійснювали на підставі традиційних загальноклінічних і лабораторних методів дослідження.
У більшості осіб дослідної (61,1 %) і контрольної груп (65,0 %) бешиха була первинною. В 1/3 пацієнтів порівнюваних груп захворювання було рецидивним. Найрідше відзначали повторні випадки захворювання — по 1 випадку (5,6 і 5,0 % відповідно).
Окрім комплексного клінічного обстеження, пацієнтам здійснювали імунологічне дослідження: визначали циркулюючі імунні комплекси (ЦІК); уміст імуноглобулінів класів A, M, G — біохімічним методом за Badin, Konsselet у модифікації Е.Г. Лоренко і Н.П. Кравченко, субпопуляцій лімфоцитів, рівні інтерлейкінів-8, -10, а також класів імуноглобулінів.
Усі числові показники оцінювали з урахуванням значень 30 здорових донорів й обробляли статистично. Статистичну обробку результатів дослідження проводили за допомогою програмного комплексу Windows, Word і Excel, Statistica 6.0 з використанням методу варіаційної статистики з визначенням вірогідності за допомогою непараметричного методу Вілкоксона для незалежних сукупностей або дисперсійний аналіз Краскела — Уол-ліса. Для порівняння двох незалежних груп використовували U-критерій Манна — Уїтні.
Результати досліджень та їх обговорення
У результаті досліджень було встановлено, що в обох спостережуваних групах були фонові захворювання та ті, що сприяють бешисі (у 83,3 і 80,0 % осіб 1-ї і 2-ї груп відповідно), у числі останніх найчастіше фігурували мікози стоп і нігтів, а також хронічна венозна недостатність. Найчастіше запальний процес (55,6 і 70,0 %) розвивався на ногах. Рідше локалізацією запального вогнища були шкірні покриви обличчя (38,9 і 25,0 %) і грудей (5,6 і 5,0 %).
Після проведеного курсу лікування позитивна динаміка спостерігалася в обох групах пацієнтів, але найзначнішою вона була у групі, що отримувала, крім стандартної терапії, ще й алокін-альфа.
У процесі лікування в пацієнтів досліджуваної групи відзначене зниження загальної температури тіла до нормальних показників уже на 3-тю — 4-ту добу, тоді як у контрольній групі до цього дня ще відзначався субфебрилітет — 37,6 ± 0,6 °С. На 5-ту добу захворювання температура тіла досягала нормальних показників у пацієнтів обох порівнюваних груп. Темп зникнення симптомів інтоксикації корелював з динамікою зниження температури, при нормалізації якої, як правило, зникали й загальнотоксичні прояви захворювання. Проте у хворих, які отримували алокін-альфа, на 2–3 дні раніше зникали локальні клінічні симптоми: значно зменшилися набряк і гіперемія тканин у ділянці уражень, зникали регіональний лімфаденіт і лімфангіт.
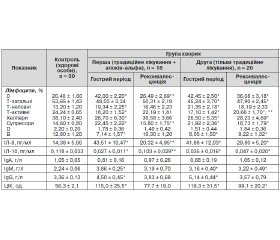
У гострому періоді хвороби виявлено значні зміни показників імунограми (табл. 1).
Загальна кількість Т-лімфоцитів і Т-хелперів була знижена (P < 0,05), а от рівень Т-супресорів вірогідно зростав, досягаючи у представників 1-ї групи рівня 22,45 ± 2,22 %, а 2-ї — 21,92 ± 2,36 %, у нормі — 14,60 ± 0,80 % (Р < 0,05). Це свідчить про розвиток при бешисі вторинного імунодефіцитного стану за відносним гіперсупресорним типом.
Відзначено затримку й порушення в диференціюванні лімфоцитів. Так, частота виявлення нульових і неповних Т-клітин у хворих обох груп суттєво перевищувала значення здорових осіб (Р < 0,05). Однак знизився рівень субпопуляції активних Т-клітин (P < 0,05), що свідчить про зміну функціональної активності лімфоцитів на початку імунної відповіді.
Кількість D-клітин, загального IgA, лізоциму і середні показники імунорегуляторного індексу (ІРІ) у зазначений період суттєво не змінювалися. Рівень В-клітин у всіх хворих був істотно меншим (P < 0,05). ІРІ коливався від 1,72 до 2,70, дорівнюючи в середньому у пацієнтів 1-ї групи 2,24 ± 0,36, а 2-ї — 2,10 ± 0,45.
У період ранньої реконвалесценції (12–14-та доба хвороби) у представників 1-ї групи нормалізувалися значення усіх досліджуваних показників клітинного і гуморального імунітету.
Однак у реконвалесцентів 2-ї групи, які отримували тільки традиційне лікування, вміст нульових лімфоцитів утримувався на рівні 36,08 ± 3,18 %, суттєво перевищуючи норму — 20,40 ± 1,60 % (Р < 0,05). Рівень Т-супресорів у представників контрольної групи також залишався істотно підвищеним навіть на 10–14-ту добу хвороби — 18,73 ± 1,79 % (Р < 0,05).
Важливо, що при традиційній терапії хворих на бешиху без використання алокіну-альфа у період ранньої реконвалесценції концентрація Т-загальних, Т-активних лімфоцитів, Т-хелперів і В-клітин, хоч і мала тенденцію до зростання, однак не досягала рівня здорових осіб (Р < 0,05).
У розпал хвороби рівень ІЛ-8 очікувано утричі перевищував нормальний показник, а значення ІЛ-10 у 3,5–4 рази було нижчим від рівня у здорових людей.
На фоні комбінованої терапії з використанням алокіну-альфа встановили значнішу корекцію рівнів досліджуваних цитокінів порівняно з традиційним лікуванням. Так, кількість прозапального цитокіну ІЛ-8 статистично суттєво знизилась, практично досягнувши нормальних значень: від 43,51 ± 10,47 пг/мл до 20,32 ± 4,95 пг/мл (Р < 0,05), а протизапального ІЛ-10 зросла — від 0,027 ± 0,011 пг/мл до 0,103 ± 0,029 пг/мл. У пацієнтів, які отримували лише традиційне лікування, вміст досліджуваних цитокінів статистично суттєво не змінювався. Це свідчить про повноцінну корекцію встановленого дисбалансу про- і протизапальних цитокінів на фоні доповнення традиційного лікування цитокіноподібним препаратом алокін-альфа. Відновлення порушеного балансу досліджуваних цитокінів веде до адекватної продукції ІЛ-8 та ІЛ-10, а значить, до швидкого ослаблення і стійкого вгамовування запального процесу. Важливо, що вплив лікування на імунні показники збігається з клінічним ефектом.
Змін рівня IgA в усіх реконвалесцентів не виявили, а вміст IgM і IgG був помірно підвищеним, причому в реконвалесцентів 2-ї групи рівень IgM залишався таким протягом усієї хвороби (P < 0,05). Оскільки IgМ є основою первинної імунної відповіді і захищеності від бактерійних інфекцій, то їх гіперпродукування при бешисі є закономірним.
Зростання рівня IgG, очевидно, пов’язане з безпосереднім їх функціональним призначенням як головних виконавців антитоксичного імунітету, що має суттєве значення при бешисі.
У гострому періоді вміст ЦІК значно перевищував рівень їх у здорових осіб (Р < 0,05). Але в період реконвалесценції середня концентрація їх знижувалась, однак у представників 2-ї групи так і не наблизилась до нормальних значень.
Отже, можна припустити, що відзначені особливості імунного статусу хворих на бешиху зумовлені не тільки проникненням інфекційного агента, але й є результатом його глибокого імуномодулювального ефекту.
У свою чергу, включення до комплексної терапії хворих на бешиху алокіну-альфа сприяє не тільки скороченню клінічних проявів хвороби, але й суттєвій корекції супутніх імунних порушень.
Проведене дослідження вказує на те, що віддалені результати були найсприятливішими саме у дослідній групі хворих, оскільки протягом 1–2 років після використання алокіну-альфа в жодного з цих пацієнтів не спостерігали випадків повторної чи рецидивної бешихи. У той же час 2 представники контрольної групи, які лікувалися без використання цього препарату, навіть попри те, що отримували сезонну біцилінопрофілактику, у цей проміжок часу були госпіталізовані повторно у зв’язку з розвитком рецидивів бешихи.
На нашу думку, варто погодитися з міркуванням інших дослідників, згідно з яким кінцевим етапом реакції цитокінового ряду є участь у специфічній імунній відповіді [11].
Вплив алокіну-альфа на продукцію специфічних противірусних та антибактерійних антитіл еквівалентний дії лікувальних вакцин. Проте, на відміну від останніх, алокін-альфа суттєво не впливає на продукцію реагінових антитіл (імуноглобулінів) класу IgE та не підсилює реакцію гіперчутливості негайного типу.
Таким чином, наше спостереження дозволяє стверджувати, що використання у комплексній терапії хворих на бешиху алокіну-альфа забезпечує суттєвий позитивний терапевтичний та імуномодулювальний ефекти, а також дозволяє досягти найбільш сприятливих віддалених наслідків.
Висновки
1. При бешисі розвивається вторинний імунодефіцит за відносним гіперсупресорним типом, зумовлений значним зниженням загальної кількості активних Т-клітин і Т-хелперів, а також зростанням числа Т-супресорів, нульових і неповних Т-лімфоцитів.
2. Відзначені закономірності імунного статусу хворих вказують на формування під час розвитку бешихи імунного дисбалансу, що є, очевидно, важливим патогенетичним чинником при цій патології.
3. Використання у комплексній терапії хворих на бешиху алокіну-альфа сприяє не тільки скороченню клінічних проявів хвороби, але й суттєвій корекції супутніх імунних порушень, а також забезпечує найбільш сприятливі віддалені результати, дозволяючи уникнути рецидивів хвороби.
4. У пацієнтів із бешихою динаміка цитокінів залежить від варіанта лікування — при застосуванні комбінованої терапії відзначається нормалізація ІЛ-8 та ІЛ-10. Рівень цитокінів доцільно вивчати в осіб із рецидивною формою бешихи з метою підбору оптимальної лікувальної схеми й для запобігання необґрунтованому перевантаженню медикаментами.

/40.jpg)