Журнал «Актуальная инфектология» 2 (7) 2015
Вернуться к номеру
Клінічно-параклінічні особливості перебігу атопічного дерматиту на тлі порушення мікробного пейзажу кишечника у немовлят
Авторы: Колоскова О.К., Марусик У.І., Кордунян Н.В. — Буковинський державний медичний університет, м. Чернівці
Рубрики: Инфекционные заболевания
Разделы: Клинические исследования
Версия для печати
Метою роботи було вивчення діагностичного значення загальноклінічних та параклінічних показників у дітей із проявами дисбактеріозу кишечника на тлі атопічного дерматиту для підвищення ефективності лікування даного захворювання. Проведене комплексне спостереження за 26 дітьми першого року життя, які мали клінічні прояви атопічного дерматиту. За даними бактеріологічного посіву випорожнень дітей розподіляли на дві клінічні групи порівняння. Першу групу становили 19 дітей зі значними порушеннями складу мікрофлори кишечника, що проявлялося дисбактеріозом ІІ–ІІІ ступеня тяжкості. Решта пацієнтів із відсутніми ознаками дисбактеріозу кишечника (за даними бактеріологічного дослідження випорожнень) увійшла до складу другої клінічної групи. Комплексне обстеження передбачало клінічну оцінку змін на шкірі за шкалою Eczema Area and Severity Index, відповідно до якої враховують площу ураження шкіри та інтенсивність морфологічних елементів висипання, а також загальний аналіз крові та визначення рівня загального імуноглобуліну E. У результаті проведених досліджень встановлено, що патологічне порушення мікробіоценозу кишечника у дітей, хворих на атопічний дерматит, підвищує ризик тяжкого перебігу цього захворювання у 2,8 раза, а ризик виявлення високої концентрації загального імуноглобуліну E у сироватці крові > 130,0 МО/мл — практично у 5 разів (відношення шансів — 4,8 (95% довірчий інтервал — 2,4–9,5)).
Целью работы стало изучение диагностического значения общеклинических и параклинических показателей у детей с проявлениями дисбактериоза кишечника на фоне атопического дерматита для повышения эффективности лечения данного заболевания. Проведено комплексное наблюдение за 26 детьми первого года жизни, которые имели клинические проявления атопического дерматита. По данным бактериологического посева кала детей распределяли на две клинические группы сравнения. В первую группу вошли 19 детей со значительными нарушениями состава микрофлоры кишечника, что проявлялось дисбактериозом II–III степени тяжести. Остальные пациенты без признаков дисбактериоза кишечника (по данным бактериологического исследования испражнений) вошли в состав второй клинической группы. Комплексное обследование предусматривало клиническую оценку изменений на коже по шкале Eczema Area and Severity Index, согласно которой учитывают площадь поражения кожи и интенсивность морфологических элементов сыпи, а также общий анализ крови и определение уровня общего иммуноглобулина E. В результате проведенных исследований установлено, что патологическое нарушение микробиоценоза кишечника у детей, больных атопическим дерматитом, повышает риск тяжелого течения данного заболевания в 2,8 раза, а риск обнаружения высокой концентрации общего иммуноглобулина E в сыворотке крови > 130,0 МЕ/мл — практически в 5 раз (отношение шансов — 4,8 (95% доверительный интервал — 2,4–9,5)).
The objective of the work was to study the diagnostic value of clinical and paraclinical indicators in children with manifestations of intestinal dysbiosis on the background of atopic dermatitis to improve the treatment efficacy in this disease. There has been carried out a comprehensive observation of 26 children of the first year of life, who had clinical signs of atopic dermatitis. According to bacteriological stool culture, children were divided into two clinical groups. First group consisted of 19 children with significant violations in composition of intestinal microflora, which manifested by dysbiosis of II–III degree. The remaining patients with no signs of intestinal dysbiosis (according to bacteriological examination of stools) were included in the second clinical group. The complex examination consisted of clinical assessment of changes in the skin by Eczema Area and Severity Index, according to which the area of skin lesion and severity of morphological elements of rashes, as well as complete blood count and the levels of total immunoglobulin E were evaluated. The studies found that the pathologic disorder of intestinal microbiota in children with atopic dermatitis increases the risk of severe course of this disease by 2.8 times, and the risk of high levels of total immunoglobulin E in blood serum > 130.0 IU/ml almost by 5 times (odds ratio — 4.8 (95% confident interval 2.4–9.5)).
дисбактеріоз, атопічний дерматит, кишечник, діти.
дисбактериоз, атопический дерматит, кишечник, дети.
dysbiosis, atopic dermatitis, intestine, children.
Статья опубликована на с. 39-42
Вступ
Протягом останніх десятиліть у світі відзначається неухильне зростання алергічної патології серед дітей [1]. Так, у країнах Європи за останні 20 років поширеність атопічної сенсибілізації збільшилась удвічі, а, згідно з прогнозами Всесвітньої організації охорони здоров’я, алергічні захворювання незабаром посідатимуть перше місце в структурі загальної патології [2]. Наразі в Україні від алергічних захворювань страждає 25–30 % дитячої популяції [3], водночас спостерігається зміщення термінів дебюту на більш ранній вік і тенденція до почастішання тяжких клінічних форм [4]. Дослідження, проведені протягом останніх 10 років, свідчать, що в Україні близько чверті дітей раннього віку мають прояви атопії, зокрема атопічного дерматиту (АД) [5].
Вважається, що АД є наслідком взаємодії кількох складових: впливу факторів зовнішнього середовища, генів схильності до захворювання, дисфункції шкірного бар’єра та імунологічних порушень [6].
Сьогодні не викликає сумнівів той факт, що алергічні захворювання у дітей провокуються патологічними кількісними та якісними змінами мікрофлори кишечника, що об’єднані терміном «дисбактеріоз». Так, за даними окремих досліджень, порушення нормального видового та популяційного складу мікрофлори кишечника виявляють у 93–98 % дітей зі шкірними проявами харчової алергії та інших алергічних захворювань [7]. Відомо, що нормальна мікрофлора травного тракту перешкоджає надходженню алергенів і токсинів до організму шляхом створення мікробної плівки на поверхні ворсин кишечника. Водночас мікробний фактор бере участь у накопиченні гістаміну в тканинах організму. Отже, одним із чинників, що беруть участь у патогенезі формування алергічного фенотипу, є стан кишкової мікрофлори [8]. Тобто дисбактеріоз у дітей може сприяти розвитку АД, проявам харчової алергії, екземи, бронхіальної астми [9]. Беручи до уваги наведене вище, актуальним слід визнати вивчення клініко-лабораторних особливостей перебігу АД у дітей із порушеннями видового складу та популяційного рівня мікрофлори кишечника.
Таким чином, метою роботи стало вивчення діагностичного значення загальноклінічних та параклінічних показників у дітей із проявами дисбактеріозу кишечника на тлі АД для підвищення ефективності лікування цього захворювання.
Матеріал і методи
Проведене комплексне спостереження за 26 дітьми першого року життя, які мали клінічні прояви АД. За даними бактеріологічного посіву випорожнень дітей розподіляли на дві клінічні групи порівняння. Першу (основну) групу становили 19 дітей зі значними порушеннями складу мікрофлори кишечника, що проявлялося дисбактеріозом ІІ–ІІІ ступеня тяжкості. Решта пацієнтів без ознак дисбактеріозу кишечника (за даними бактеріологічного дослідження випорожнень) увійшла до складу другої клінічної групи.
Середній вік представників 1-ї групи становив 5,4 ± 0,7 місяця і вірогідно не відрізнявся від даного показника у групі порівняння (5,6 ± 0,6 місяця). В основній групі хлопчиків було 68,4 %, дівчаток — 31,6 %; у групі порівняння даний розподіл становив 57,1 та 42,9 % відповідно. В обох групах переважали мешканці сільської місцевості. За основними клінічними показниками групи були порівнянні.
Комплексне обстеження передбачало клінічну оцінку змін на шкірі за шкалою EASI (Eczema Area and Severity Index) [10, 11], відповідно до якої враховують площу ураження шкіри та інтенсивність морфологічних елементів висипання, а також загальний аналіз крові та визначення рівня загального імуноглобуліну E (IgE) на підставі твердофазного імуноферментного аналізу.
Отримані результати дослідження аналізували за допомогою методів біостатистики та клінічної епідеміології. Обробку даних проводили з використанням пакета прикладних програм Stаtіstіса 7.0. Для встановлення діагностичної цінності тестів визначали їх чутливість, специфічність, позитивне (ВП+) та негативне (ВП–) відношення правомірності. З позиції клінічної епідеміології оцінювали атрибутивний та відносний ризики, а також відношення шансів (ВШ) з обчисленням їх довірчих інтервалів (95% ДІ).
Результати дослідження
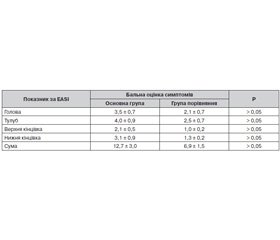
Серед особливостей ураження шкіри у дітей груп порівняння відмічався папульозний висип, на тлі якого виникали еритематозно-сквамозні плями та дрібнопластинчасте лущення. Перебіг процесу мав хвилеподібний характер. Висипання ексудативного гостро- та підгострозапального характеру переважно локалізувалися на обличчі, згинальних і розгинальних поверхнях кінцівок навколо великих суглобів та шиї. У табл. 1 наведена оцінка шкірних змін за шкалою EASI у пацієнтів обох клінічних груп.
Попри відсутність вірогідних відмінностей за вираженістю клінічних проявів атопії у представників обох груп, за наявності порушення мікрофлори кишечника у дітей 1-ї групи відзначено чітку тенденцію до більшої інтенсивності шкірних змін. Так, сума за EASI, що перевищувала 6,4 бала, реєструвалась у 52,6 % дітей 1-ї клінічної групи та лише у 28,5 % випадків у 2-й (Р > 0,05) групі порівняння. При цьому відносний ризик зазначеної вище тяжкості клінічних проявів АД, що оцінені за EASI у 6,4 бала та більше, за наявності дисбактеріозу кишечника щодо групи пацієнтів без патологічного порушення мікрофлори кишечника становив 1,6 (95% ДІ 1,1–2,3), абсолютний ризик — 0,2, при ВШ 2,8 (95% ДІ 1,5–4,9).
Оцінюючи показники загального аналізу крові, ми не виявили змін у малюків обох клінічних груп порівняння. Однак у дітей 1-ї групи з вираженими порушеннями мікрофлори кишечника виявлено вірогідно вищу кількість еозинофілів у периферичній крові щодо немовлят 2-ї групи (3,1 ± 0,6 % та 1,5 ± 0,5 % (Р < 0,05) відповідно). Водночас у пацієнтів 1-ї групи відзначена чітка тенденція до підвищення абсолютного еозинофільного числа (АЕЧ), що вказує на більш виражену відповідь організму на алергічний запальний процес. Так, АЕЧ у малюків з ознаками дисбактеріозу становило 0,20 ± 0,04 Г/л, а у немовлят без порушення мікрофлори кишечника — 0,10 ± 0,05 Г/л (Р > 0,05). Наявність більш вираженого алергічного запалення у дітей із патологічним порушенням мікробіоценозу кишечника на фоні АД збігається з думкою ряду закордонних науковців [9], однак окремі дослідники не виявили суттєвого зв’язку між тяжкістю перебігу алергічної патології та порушенням мікрофлори кишечника [12].
Згідно з даними літератури, деякі види лактобактерій, що становлять нормальний мікробний пейзаж кишечника, сприяють підвищенню вмісту CD8-лімфоцитів, а біфідумбактерії — зниженню вмісту CD4-лімфоцитів у крові [13]. Кількісний дисбаланс субпопуляцій лімфоцитів, зазначених вище (зниження рівня CD8- та підвищення вмісту CD4-лімфоцитів у крові), лежить в основі розвитку алергічних захворювань. Таким чином, дисбактеріоз кишечника призводить до порушення нормального рівня субпопуляцій даних лімфоцитів і тим самим підвищує ризик реалізації атопії. Маючи на увазі той факт, що порушення нормальної мікрофлори кишечника впливає на патогенетичні механізми розвитку атопії, ми вважали доцільним проаналізувати вміст загального імуноглобуліну Е (IgE) в сироватці крові дітей із дисбактеріозом на тлі АД. Так, виявлено вірогідно вищу концентрацію загального IgE у сироватці крові немовлят 1-ї клінічної групи щодо пацієнтів групи порівняння (315,0 ± 97,1 МО/мл та 83,3 ± 31,3 МО/мл (Р < 0,05) відповідно). Водночас концентрація загального IgE, що перевищувала 130,0 МО/мл, реєструвалась у 44,4 % дітей 1-ї клінічної групи та втричі рідше (14,2 %) у 2-й групі порівняння (Р > 0,05).
Показники діагностичної цінності підвищеного вмісту загального IgE у сироватці крові дітей із дисбактеріозом на фоні АД щодо пацієнтів без патологічних порушень мікрофлори кишечника були такими: чутливість — 44,4 % (95% ДІ 34,4–54,7), специфічність — 85,8 % (95% ДІ 77,3–92,0), ВП+ — 3,1 та ВП– — 0,6. Наявність дисбактеріозу у малюків на фоні АД підвищувала ризики виявлення високого рівня загального IgE у сироватці крові (понад 130,0 МО/мл): атрибутивний ризик становив 0,4, відносний ризик дорівнював 1,9 (95% ДІ 1,1–3,3), при ВШ 4,8 (95% ДІ 2,4–9,5).
Отримані нами дані збігаються з думкою більшості науковців, які вважають порушення мікробного пейзажу кишечника у дітей одним із факторів, що підвищують ризик реалізації атопії та сприяють більш тяжкому перебігу захворювання [11].
Висновки
1. Патологічне порушення мікробіоценозу кишечника у дітей, хворих на АД, підвищує ризик тяжкого перебігу даного захворювання у 2,8 раза.
2. Наявність дисбактеріозу у дітей на фоні АД підвищує ризик виявлення високої концентрації загального IgE у сироватці крові > 130,0 МО/мл практично у 5 разів (ВШ 4,8 (95% ДІ 2,4–9,5)).
3. Для підвищення ефективності лікування АД у малюків у комплексі терапевтичних заходів необхідно здійснювати корекцію дисбактеріозу кишечника шляхом призначення пребіотичних або пробіотичних препаратів.
1. Максимычева Т.Ю. Вскармливание детей из группы риска по пищевой аллергии: принципы подбора смеси / Т.Ю. Максимычева // Педиатрия. — 2012. — № 91(5). — С. 57–63.
2. Резніченко Ю.Г. Профілактика розвитку алергічної патології у дітей раннього віку в умовах проживання в індустріальному центрі / Ю.Г. Резніченко, М.О. Ярцева // Запорожский медицинский журнал. — 2011. — Т. 13, № 2. — С. 114–116.
3. Охотнікова О.М. Профілактика алергії у дітей: сучасні можливості та перспективи / О.М. Охотнікова // Дитячий лікар. — 2011. — № 2(9). — С. 26–35.
4. Распространенность аллергических заболеваний у детей, проживающих в различных эколого-географических условиях / Е.Л. Дыбунова, А.А. Модестов, Р.Н. Терлецкая [и др.] // Вопросы современной педиатрии. — 2007. — № 6(4). — С. 12–16.
5. Беш Л.В. Атопічний дерматит у дітей / Л.В. Беш // Здоровье ребенка. — 2012. — № 2(37). — С. 1–12.
6. Кордон Т.І. Принципи створення, механізм дії та клінічне застосування пробіотиків (огляд) / Т.І. Кордон // Annals of Mechnikov Institute. — 2014. — № 2. — С. 8–16.
7. Тяжка О.В. Диференційоване призначення пробіотиків у дітей / О.В. Тяжка, Т.В. Починок, Л.М. Казакова [та ін.] // Медицина транспорту України. — 2009. — № 4. — С. 87–90.
8. Беш Л.В. Проблема дисбактеріозу кишечника в практиці дитячого алерголога: дискусійні питання й можливості їх вирішення / Л.В. Беш // Здоровье ребенка. — 2012. — № 7(42). — С. 133–137.
9. Беш Л.В. Нефармакологічні можливості корекції «алергічного маршу» у дітей / Л.В. Беш // Madical Nature. — 2011. — № 8. — C. 26–29.
10. Камашева Г.Р. Методы оценки степени тяжести атопического дерматита у детей раннего возраста / Г.Р. Камашева, Р.Ф. Хакимова, Г.Р. Валиуллина // Земский врач. — 2010. — № 4. — С. 32–34.
11. Hanifin J.M., Thurston M., Omotо M. et al. The eczema area and severity index (EASI): assessment of reliability in atopic dermatitis // Experimental Dermatology. — 2001. — № 10(1). — Р. 11–18.
12. Sjögren Y., Jenmalm M., Böttcher M. et al. Altered early infant gut microbiota in children developing allergy up to 5 years of age // Clinical and experimental allergy. — 2009. — № 4(39). — Р. 518–526.
13. Songjina P., Nakayama J., Tateyama A. et al. Differences in developing intestinal microbiota between allergic and non-allergic infants: a pilot study in Japan // Biosci. Biotechnol. Biochem. — 2007. — № 71(9). — P. 2338–2342.

/40/40.jpg)