Газета «Новости медицины и фармации» Гастроэнтерология (337) 2010 (тематический номер)
Вернуться к номеру
Ефективність есенціальних фосфоліпідів у формі препарату Енерлів при хронічних гепатитах і цирозах печінки
Авторы: В.С. Копча, О.Я. Кадубець, О.Г. Лавра Тернопільський державний медичний університет ім. І.Я. Горбачевського, Тернопільська міська комунальна лікарня швидкої допомоги, Тернопільська університетська обласна клінічна лікарня
Версия для печати
Хронічні гепатити, передусім вірусної й токсичної етіології, а також їх безпосередній наслідок — цирози печінки є повсюдно поширеною причиною захворюваності й смертності населення. Загальне число захворювань і порушень функції печінки залишається невідомим, проте, за даними світової статистики, щорічно спостерігається ріст числа таких хворих у середньому на 15–30 % [1, 2]. Відомо, що за останні 5 років в Україні захворюваність на хронічний гепатит збільшилася на 76,6 %, а на цироз печінки — на 75,6 % [3].
Патогенетичні механізми хронічних гепатитів і цирозів печінки добре вивчені. Найбільш важливе місце серед них належить вірусному пошкодженню гепатоцитів та оксидативному стресу.
Відомо, що біологічні мембрани забезпечують найважливіші процеси життєдіяльності організму. Найбільш поширені мембранні ліпіди належать до класу фосфоліпідів. З фармакологічної точки зору найактивнішим є фосфатидилхолін, у молекулі якого є дві поліненасичені есенціальні (незамінні) жирні кислоти — лінолева і ліноленова. Патогенез ураження печінкових клітин при гепатитах полягає в пошкодженні мембран гепатоцитів за рахунок зниження вмісту в них фосфатидилхоліну; у метаболічних порушеннях окислювальних процесів (накопичення в гепатоцитах вільних жирних кислот і тригліцеридів), що призводять до оксидативного стресу; секреції купферівськими клітинами прозапальних цитокінів; трансформації ендотеліальних клітин у фібробласти; розвитку інсулінорезистентності, що веде до порушення ліпогенезу й обміну глюкози. У свою чергу, ПОЛ призводить до некрозу клітин і формування гігантських мітохондрій. Альдегіди — продукти ПОЛ — здатні активувати зірчасті клітини печінки, що є основними продуцентами колагену, а також викликати перехресне зв’язування цитокератинів із формуванням тілець Маллорі і стимулювати хемотаксис нейтрофілів [4–6].
Зміна окисно-відновного потенціалу в печінкових клітинах веде до цілого ряду порушень обміну речовин: гіперлактатемії з ацидозом, гіперурикемії і гіпоглікемії. Порушується порфіриновий обмін речовин, знижується рівень фолієвої кислоти, вітаміну В12 і вітаміну В6. Встановлено, що зменшення концентрації тіаміну і його активних фракцій в печінці призводить до накопичення проміжних продуктів обміну і зниження рівня коферментів, виникає стан метаболічного ацидозу, латентної печінкової недостатності [7, 8].
З огляду на це лікування вірусних і токсичних уражень печінки здійснюють з використанням лікарських засобів, до складу яких входять есенціальні фосфоліпіди (ЕФЛ). Препарати зазначеної групи мають широкий спектр лікувальної дії на тканину печінки [9, 10]:
1. Мембраностабілізуючу дію (активують фосфоліпідзалежні ферменти), сприяють підвищенню активності й текучості мембран, внаслідок чого нормалізується їх проникність.
2. Гепатопротекторну дію.
3. Гальмування синтезу прозапальних цитокінів.
4. Пригнічення процесів перекисного окислення ліпідів, підвищення активності антиоксидантних ферментів супероксиддисмутази і каталази.
5. Підвищення метаболічного, енергетичного та екскреторного потенціалу печінки.
6. Прискорення процесів детоксикації печінки при її токсичному ураженні.
7. Уповільнення трансформації стелатних клітин у колагенопродукувальні клітини, підвищення активності колагенази.
8. Збільшення синтезу гепатоцитами РНК і білка, прискорення регенерації тканини печінки.
9. Імуномодулювальні властивості.
10. Зменшення апоптозу гепатоцитів.
11. Участь у синтезі простагландинів.
12. Гіпохолестеринемічна дія.
Мета дослідження — обгрунтування доцільності, а також оцінка ефективності застосування препарату Енерлів, що містить знежирені та збагачені соєві фосфоліпіди, у хворих на хронічні вірусні й токсичні гепатити й цирози печінки.
Матеріали і методи
Усього обстежили 51 пацієнта (30 чоловіків і 21 жінку): у 32 хворих встановлено хронічний вірусний гепатит (у 14 з них — гепатит В у стадії інтеграції, у 18 — гепатит С), у 7 — хронічний токсичний (алкогольний) гепатит, а ще у 12 пацієнтів — субкомпенсований цироз печінки вірусної (2 хворих мали цироз печінки, асоційований з HBV-інфекцією, і 6 — з HCV-інфекцією) та змішаної етіології (4 особи).
Діагноз вірусних гепатитів і цирозу печінки вірусної етіології підтверджено за допомогою ПЛР та ІФА. Вік хворих становив у середньому 52,3 ± 3,4 року. Ступінь захворювання був тяжким у 26 осіб, середнім — у 25.
Контрольну групу склали 16 практично здорових людей відповідного віку.
Фінансова неспроможність хворих на хронічний гепатит С та фаза інтеграції HBV стали підставою для відмови від противірусної інтерферонотерапії. Відтак усім пацієнтам групи дослідження призначали базисну терапію, яка передбачала дотримання дієти, негайне припинення контакту з токсичними агентами, дезінтоксикація, прийом інгібіторів протеаз, ферментів, гепатопротекторів рослинного походження, вітамінів чи вітаміноподібних сполук, за показаннями — діуретиків (торасемід у поєднанні з верошпіроном), глюкозо-інсуліно-калієвої суміші та ін. Глюкокортикоїди, антибактеріальні засоби, бета-адреноблокатори також призначали за показаннями.
Додатково до базисної терапії хворі основної групи (31) отримували Енерлів по 2 капсули (600 мг) тричі на добу до їжі, запиваючи їх достатньою кількістю рідини. Лікування тривало 2 тижні і за необхідності подовжувалося до 1–1,5 місяця.
Критеріями ефективності лікування були такі показники: вираженість основних клінічних синдромів (астеновегетативного, больового, диспептичного, жовтяничного), дані лабораторних методів досліджень (вміст білірубіну, амінотрансфераз, лужної фосфатази, показники осадових проб, протеїно- і ліпідограми крові); дані ультразвукового дослідження (УЗД) органів черевної порожнини. Ступінь мезенхімально-запальної реакції оцінювали за вмістом загального білка і білкових фракцій сироватки крові, показниками тимолової проби.
Об’єм біохімічних досліджень включав ще й визначення рівня активності процесів ПОЛ за концентрацією малонового діальдегіду (МДА) і дієнових кон’югат (ДК) в сироватці крові і системи антиоксидантного захисту за активністю ферментів супероксиддисмутази (СОД) методом спектрофотометрії.
Отримані результати підлягали математико-статистичному аналізу.
Результати досліджень та їх обговорення
Клінічна картина захворювання супроводжувалася вираженим диспептичним, абдомінально-больовим і астеновегетативним синдромом. На сухість у роті скаржилось 90,2 % пацієнтів, спрагу — 82,4 %, свербіж шкіри — 50,9 %, сонливість — 31,4 %, кровоточивість ясен — 19,6 %, болі в ногах — 15,7 %. Збільшення печінки понад 2 см, а також синдром жовтяниці встановили в усіх хворих.
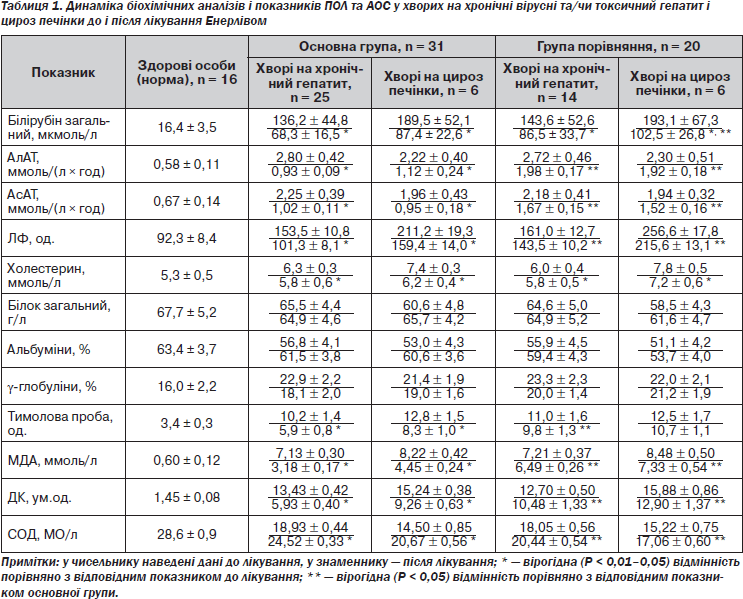
Біохімічні показники свідчать про поєднання у хворих як цитолізу із мезенхімально-запальною реакцією, так і холестатичного синдрому, частіше на другому тижні захворювання. Так, при лабораторному обстеженні в усіх хворих встановлена гіпербілірубінемія з переважанням прямої фракції. Цитолітичний синдром проявлявся мінімум триразовим підвищенням активності трансаміназ. Встановили підвищення в 1,7–2,8 раза рівня лужної фосфатази (ЛФ), а при цирозі печінки — холестерину в 1,4–1,5 раза, що вказувало на порушення естерифікуючої функції печінки. Уміст загального білка істотних змін не зазнавав, проте рівень альбуміну демонстрував тенденцію до деякого зниження, а γ-глобулінів — до підвищення (табл. 1).
Метаболічні порушення в обстежених хворих характеризувалися накопиченням у крові кінцевих і проміжних продуктів пероксидації ліпідів: при хронічних гепатитах МДА досягав рівня від 7,13 ± 0,30 до 7,21 ± 0,37 ммоль/л, при цирозі печінки — від 8,22 ± 0,42 до 8,48 ± ± 0,50 ммоль/л (норма 0,60 ± ± 0,12 ммоль/л; Р < 0,001), рівень ДК коливався в межах від 12,70 ± 0,55 до 15,88 ± 0,86 ум.од. (норма 1,45 ± ± 0,08 ум.од.; Р < 0,001). Активація процесів пероксидації ліпідів супроводжувалася пригніченням активності ферментів антиоксидантного захисту: СОД — від 14,50 ± 0,85 до 18,93 ± 0,44 МО/л (норма 28,6 ± ± 0,9 МО/л; Р < 0,05).
Через 1 міс. після початку терапії зникали або зменшувалися астеновегетативний, больовий, цитолітичний синдроми (трансаміназна активність), синдроми імунного запалення (рівень γ-глобулінів і показники тимолової проби), холестазу (концентрація в крові білірубіну й активність лужної фосфатази, табл. 1). Хворих не турбувала слабкість, підвищилася працездатність, покращився сон, відновився апетит, зникла тяжкість у правому підребер’ї, нудота й гіркота в роті.
Використання у комплексній терапії Енерліву сприяло зникненню абдомінально-больового, астеновегетативного, диспептичного синдромів в основній групі вже на 8-му — 12-ту добу, у групі порівняння — на 17–20-ту добу. Паралельно до зворотного розвитку клінічних проявів захворювання змінювалася біохімічна і метаболічна активність із значною відмінністю як у часі, так і в показниках. Відтак показники функціональних проб печінки значно зменшилися до кінця 2-го тижня лікування. У групі порівняння поліпшення функціональних проб печінки настало в кінці 3-го або 4-го тижня. Зокрема, у більшості хворих основної групи за 2 тижні лікування рівень білірубіну знизився удвічі, у представників групи порівняння зниження зазначених показників було менш значним. Так, у хворих на цироз печінки, які отримували тільки базисну терапію без Енерліву, у цей час рівень білірубіну зберігався на рівні 102,5 ± 26,8 мкмоль/л, що було достовірно вище порівняно зі значенням у пацієнтів, які отримували Енерлів, — 87,4 ± 22,6 мкмоль/л (Р < 0,05). Подібна достовірна відмінність встановлена й стосовно активності трансаміназ печінки, ЛФ і тимолової проби (Р < 0,05). Причому статистично вагомі зміни стосувалися хворих як на хронічні гепатити, так і на цироз печінки (Р < 0,05).
До моменту закінчення лікування у хворих основної групи відбулося відновлення біохімічних і метаболічних показників і значне поліпшення тих же показників у групі порівняння. Для нормалізації останніх був потрібний додатковий час.
Крім того, зменшувалася активність ПОЛ, про що свідчило зниження концентрації у крові продуктів пероксидації клітинних мембран — МДА і ДК. Так, у хворих на хронічний гепатит і цироз печінки, які отримували додатково Енерлів, МДА становив відповідно 3,18 ± 0,17 і 4,45 ± 0,24 ммоль/л проти 6,49 ± ± 0,26 і 7,33 ± 0,54 ммоль/л у групі порівняння (Р < 0,05) (норма 0,60 ± ± 0,12 ммоль/л). Рівень ДК характеризувався подібною закономірністю: у представників основної групи — відповідно 5,93 ± 0,40 і 9,62 ± ± 0,63 ум.од., а групи порівняння — 10,84 ± 1,33 і 12,90 ± 1,37 ум.од., що було вірогіднг вище (в обох випадках Р < 0,05). Підвищувалася активність ендогенної антиоксидантної системи, про що свідчило зростання з наближенням до норми значення СОД, яке в основній і групі порівняння при хронічному гепатиті й цирозі печінки становило відповідно 24,52 ± ± 0,33 і 20,67 ± 0,56 МО/л та 20,44 ± ± 0,54 і 17,06 ± 0,60 МО/л. Як видно, у разі використання Енерліву суттєво зростала активність системи антиоксидантного захисту — наближалася до нормальних значень СОД (28,6 ± ± 0,9 МО/л), достовірно перевищуючи відповідні показники у групі порівняння (Р < 0,05).
Лікування Енерлівом хворі переносили добре, побічні ефекти у вигляді проносу зареєстрували у 2 пацієнтів, що, однак, не вимагало припинення терапії. Цей препарат, на відміну від інших ЕФЛ-вмісних середників, не має комплексу вітамінів та не містить барвників і детергентів, отже, суттєво знижена небезпека алергійних реакцій та практично виключена загроза розвитку гіпервітамінозу.
Ймовірно, зазначені зміни обумовлені мембраностабілізувальною та гепатопротекторною дією ЕФЛ, яка досягається шляхом безпосереднього вбудовування молекул цих сполук у фосфоліпідну структуру пошкоджених печінкових клітин, заміщенням дефектів і відновленням бар’єрної функції ліпідного бішару мембран. Від жирнокислотного складу мембранних фосфоліпідів залежать текучість, проникність, збудливість мембран, а також рецепторна і ферментативна активність пов’язаних з мембранами білків, фізіологічна активність ряду простагландинів, тромбоксанів, що синтезуються з мембранних фосфоліпідів [9].
Ще у 2001 р. було виконано 106 експериментів з 30 різними типами моделей на 7 різних видах тварин. Такими моделями були головним чином хімічна і медикаментозна інтоксикація, зокрема хронічна інтоксикація тетрахлоридом вуглецю, постійне застосування етанолу або органічних розчинників, а також парацетамолу, тетрацикліну та індометацину. Оцінюючи дію ЕФЛ у цих фармакологічних експериментах (дослідження in vivo), були зроблені такі висновки. При вивченні електронно-мікроскопічних ознак були виявлені нормальні або в основному нормалізовані структури мембран і органели. Мікроскопічні ознаки показали зменшення або відсутність жирової дистрофії клітин печінки або зменшення чи повну відсутність некрозу гепатоцитів. Було виявлене суттєве поліпшення біохімічних показників: вплив на окислення ліпідів, активність трансаміназ, на метаболізм гепатоцитів, холінестеразу і на сироваткові ліпіди. Також відзначено посилення регенерації клітин печінки і, що особливо важливо, зменшення утворення сполучної тканини.
На відміну від інших гепатопротекторів стосовно ефективності ЕФЛ є достатня доказова база. Так, до кінця 2001 р. були опубліковані результати 186 клінічних випробувань, які включали 11 206 хворих. Серед цих випробувань були виконані: 18 подвійних сліпих досліджень; 132 дослідження, проведені з метою оцінки 3 груп критеріїв (суб’єктивні, клінічні та біохімічні); 42 дослідження, які додатково оцінювали гістологічні ознаки; 4 дослідження, у яких були використані додатково до всіх перерахованих вище критеріїв електронно-мікроскопічні ознаки [11].
У 1998 р. Niderau і співавт. опублікували результати багатоцентрового рандомізованого подвійного сліпого плацебо-контрольованого дослідження, у якому вивчали ефективність застосування ЕФЛ та α-інтерферону при лікуванні хронічних гепатитів В і С. У роботі брали участь 32 дослідницькі центри Німеччини, Австрії, Польщі та Чехії. 176 пацієнтів закінчили лікування (22/25 з хронічним гепатитом В і 70/59 з хронічним гепатитом C). Базисна терапія хворих включала підшкірне введення α-інтерферону 3 рази на тиждень тривалістю 24 тижні в дозі 5 млн МО при гепатиті В і 3 млн МО — при гепатиті С. Додаткова терапія включала прийом 2 капсул ЕФЛ 3 рази на добу (1,8 г/добу) або аналогічної дози плацебо. Пацієнти, які відповіли на лікування, отримували ЕФЛ або плацебо ще протягом 24 тижні. Позитивні результати були особливо показові при лікуванні осіб із хронічним гепатитом С. Активність аланінамінотрансферази як основного маркера ефективності лікування найбільш значущо зменшувалася у групі хворих, які приймали додатково ЕФЛ. Хворі, які відповіли на лікування α-інтерфероном у поєднанні з ЕФЛ, становили 71,4 %, а серед пацієнтів, які приймали α-інтерферон з плацебо, відповідь на лікування спостерігалася лише в 50,9 % випадків [12]. Наведені результати досліджень дозволяють зробити клінічно важливі висновки: ЕФЛ підвищують імовірність відповіді на α-інтерферон, особливо при лікуванні хронічного гепатиту С, знижують частоту рецидивів після припинення терапії α-інтерфероном і добре переносяться хворими [11].
Есенціальні жирні кислоти, які входять до складу ЕФЛ, мають ще й антиоксидантний потенціал. Подвійні зв’язки в молекулі здатні легко розриватися при атаці агресивними молекулами і встановлювати зв’язки з вільними радикалами, відіграючи для них роль «пастки». Фосфоліпіди, що містять у своєму складі поліненасичені жирні кислоти, порівнюють з водостічною трубою для вільних радикалів. Відтак, потрапляючи в організм як ліки, ці сполуки деякою мірою «віддають себе у жертву» заради виживання клітини. Крім цього, ЕФЛ є матеріалом для відновлення клітинних мембран замість ліпідів, які зазнали хімічних перетворень.
Ад’ювантну лікувальну ефективність ЕФЛ продовжують вивчати. Зокрема, у США тривають дослідження ефективності цих засобів у зниженні темпів прогресування вірусного гепатиту [13].
Таким чином, провівши аналіз досліджень попередніх років і враховуючи власний досвід застосування Енерліву, можемо сказати, що завдяки здатності ЕФЛ відновлювати цілісність мембранних структур і наявності в них антиоксидантного потенціалу цей препарат займає ключові позиції в лікуванні захворювань печінки, включаючи вірусні гепатити й цироз печінки.
Висновки
1. Енерлів є ефективним засобом лікування хворих на хронічні гепатити і цироз печінки вірусної та/або алкогольної етіології. Включення у схему лікування Енерліву сприяє швидкому регресуванню основних клінічних проявів і біохімічних синдромів цих захворювань.
2. Використання разом із препаратами базисної терапії Енерліву в добовій дозі 1800 мг (600 мг тричі на добу) сприяє відновленню вмісту продуктів ПОЛ і антирадикального захисту.
3. Застосування Енерліву в комплексному лікуванні хворих на хронічні гепатити і цироз печінки вірусної та/або алкогольної етіології патогенетично обгрунтоване і сприяє підвищенню ефективності терапії та поліпшенню якості життя пацієнтів.
1. Буеверов А.О., Маевская М.В., Ивашкин В.Т. Алкогольная болезнь печени // Бол. орг. пищевар. — 2001. — № 1. — С. 14-18.
2. Вірусні гепатити і рак печінки / М.А. Андрейчин, В.І. Дрижак, О.В. Рябоконь, В.С. Копча. — Тернопіль: ТДМУ, 2010. — 188 с.
3. Харченко Н.В. Сучасні гепатопротектори в лікуванні хворих із хронічними ураженнями печінки // Ліки України. — 2004. — № 3 (80). — С. 14-18.
4. Chen J., Schenker S., Fros- to T.A. et al. Inhibition of cytochrome С oxidase activity by 4-hydroxynonenal (HNE). Role of HNE adduct formation with enzyme catalytic site // Biochim. biophys. Acta. — 2008. — V. 1380. — P. 336-344.
5. Farinati F., Cardin R., Bortolami M. et al. Estrogen receptors and oxidative damage in the liver // J. Hepatol. — 2002. — V. 36 (Suppl. 1). — Р. 270A.
6. Fromenty В., Berson A., Pessayre D. Microvesicular steatosis and steatohepatitis: role of mitochondrial dysfunction and lipid peroxidation // J. Hepatol. — 2007. — V. 26 (Suppl. l). — P. 13-22.
7. Kaplowitz N. Mechanisms of liver cell injury // J. Hepatol. — 2000. — V. 32 (Suppl. 1). — P. 39-47.
8. Kuntz L., Kuntz H.-D. Hepatology. Principles and practice. — Berlin, Heidelberg: Springer-Verlag, 2002. — P. 56-59.
9. Григоренко Е.И., Левченко М.В., Пуздря Е.Г. Опыт лечения больных с алкогольным и неалкогольным стеатогепатитом препаратом «Энерлив» // Крымский терапевтический журнал. — 2008. — № 2. — С. 4-9.
10. Короткий В.Н., Колосович И.В., Чегусов В.В. Эссенциальные фосфолипиды в комплексном лечении больных с печеночной недостаточностью, вызванной длительной механической желтухой // Медицина сегодня. — 2008. — № 10 (245). http://novosti.mif-ua.com/archive/issue-5277/#rubric-5280
11. Ткач С.М. Эффективность и безопасность гепатопротекторов с точки зрения доказательной медицины // Здоровье Украины. — 2009. — № 6. — С. 7-10.
12. Niderau C., Strohmeyer G., Heiges T. et al. Polyunsaturated phosphatidyl-choline and interferon alpha for treatment of chronic hepatitis B and C: multi-center, randomized, double-blind, placebo-controlled trial // Hepato-Gastroenerology. — 1998. — V. 45. — P. 797-804.
13. Шульпекова Ю.О. Эссенциальные фосфолипиды в лечении заболеваний печени // Русский медицинский журнал. — 2003. — http://www.medlinks.ru/article.php?sid=10480