Газета «Новости медицины и фармации» Кардиология (314) 2010 (тематический номер)
Вернуться к номеру
Некоторые аспекты коронарной реваскуляризации при хронической ИБС
Авторы: А.Э. Багрий, д.м.н., профессор, Донецкий национальный медицинский университет им. М. Горького, кафедра внутренних болезней, общей практики и семейной медицины
Версия для печати
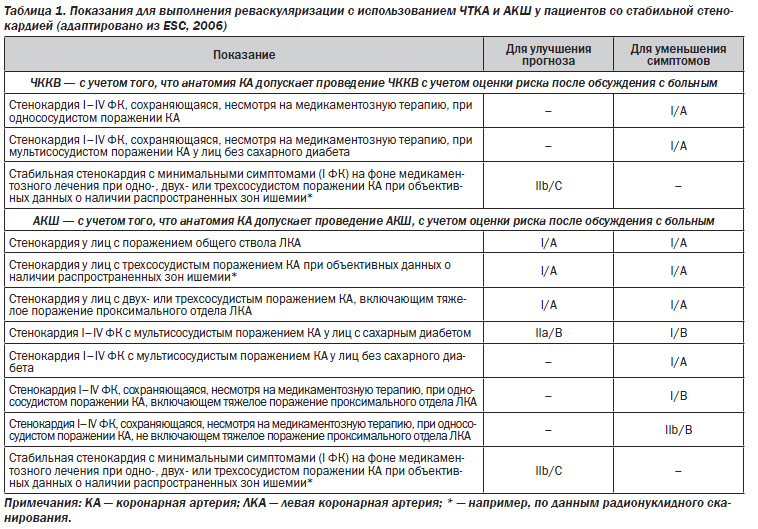
В настоящей статье мы представляем позиции реваскуляризационных подходов — чрескожного коронарного вмешательства (ЧККВ) со стентированием и аортокоронарного шунтирования (АКШ) — у больных с хронической ишемической болезнью сердца (ИБС), кратко обсуждаем проблемы выбора стентов и стент-тромбоза. В табл. 1 представлены современные показания для выполнения реваскуляризации с использованием чрескожной транслюминальной коронарной ангиопластики (ЧТКА) и АКШ у пациентов со стабильной стенокардией.
Считаем необходимым кратко прокомментировать табл. 1. Как видно из этой таблицы, у больных с хронической ИБС, имеющих стабильную стенокардию, основной целью выполнения ЧККВ со стентированием в большинстве случаев, по мнению международных экспертов, является уменьшение ангинальных симптомов. Как полагают многие, значимого улучшения прогноза (в сравнении с оптимальной медикаментозной терапией, включающей целенаправленную органопротекцию) при выполнении ЧККВ у лиц с хронической ИБС не происходит. Хорошими иллюстрациями этого взгляда могут быть результаты недавних исследований COURAGE и BARI 2D, о которых считаем важным рассказать подробнее.
Исследование COURAGE (2007) включало 2287 больных, имевших показания для проведения ЧККВ и подходящую для этого анатомию КА, с наличием ≥ 70 % стеноза не менее чем в одной КА и объективными данными о наличии ишемии миокарда. Больные были рандомизированы (распределены случайным образом) в две группы. 1-я группа (1138 больных) получала лишь оптимальную медикаментозную терапию и настойчивую рекомендацию по изменениям образа жизни (препараты — аспирин, клопидогрель, статин ± ниацин ER, ингибитор АПФ/сартан, β адреноблокатор, амлодипин, нитрат — предоставлялись бесплатно, каждый больной получал в среднем около 5 препаратов; для повышения приверженности пациентов еженедельно посещали специально обученные медсестры). 2-я группа (1149 больных) получала все, что перечислено для 1-й группы, а также ЧККВ. Двух- или трехсосудистое поражение КА было у 70 % больных в каждой из групп, значимый проксимальный стеноз ЛКА — у 37 % в 1-й группе и у 31 % — во 2-й группе. Продолжительность наблюдения за больными составила 4,6 года.
Результат: во 2-й группе (оптимальная медикаментозная терапия и ЧККВ) по сравнению с 1-й группой (только оптимальная медикаментозная терапия) не было отмечено снижения риска смерти, инфаркта миокарда, других сердечно-сосудистых осложнений. В то же время во 2-й группе в начале наблюдения (первые 3 года) достоверно лучше был контроль стенокардии (уменьшение доли больных со стенокардией с 88 до 28 % против уменьшения с 87 до 33 % в 1-й группе, р = 0,02), но эти различия между группами нивелировались к завершению периода наблюдения (26 против 28 %, р > 0,05).
Интерпретация авторов исследования состоит в следующем: «ЧККВ может быть безопасно отсрочено у больных со стабильной стенокардией даже при наличии значимого мультисосудистого поражения КА и индуцируемой ишемии, но только в случае возможности осуществления интенсивной многоцелевой медикаментозной терапии». Комментируя результаты COURAGE, кардиологи-интервенционисты (например, K.A. Skelding, B.H. Weiner, 2009, и другие) подчеркивают, однако, что в реальной лечебной практике часто невозможно добиться столь тщательного соблюдения изменений образа жизни и медикаментозной кардиопротекции (с чем сложно не согласиться); подчеркивается, что ЧККВ в полной мере сохраняет свои позиции как метод, позволяющий уменьшать симптомы стенокардии и улучшать переносимость физических нагрузок, что особенно важно для активных больных.
Исследование BARI 2D (2009) имело похожий протокол, но проводилось в группе более сложных больных — с сахарным диабетом (СД) 2-го типа. В исследование вошли 2368 больных с показаниями к проведению реваскуляризации (но без тяжелых трехсосудистых поражений КА и без поражения общего ствола ЛКА). Среди этих больных были 1605 больных (1-я группа), имевших коронарную анатомию, дающую возможность проведения ЧККВ, и 763 больных (2-я группа), коронарная анатомия которых давала возможность выполнения АКШ. В каждой из этих групп больные были рандомизированы на проведение либо только оптимальной медикаментозной терапии (подобной той, что проводилась в COURAGE) — подгруппы 1a и 2а, либо оптимальной медикаментозной терапии в сочетании с соответствующим реваскуляризационным подходом: ЧККВ — подгруппа 1b, АКШ — подгруппа 2b.
Спустя 5 лет наблюдения в группах, получавших лечение с использованием реваскуляризационных подходов (1b и 2b), по сравнению с группами, в которых эти подходы не использовались (соответственно 1а и 2а), не было различий в общей смертности. Частота сердечно-сосудистых осложнений не различалась между группами 1а и 1b (без ЧККВ и с ЧККВ), но была ниже в группе 2b (с АКШ) по сравнению с группой 2а (без АКШ). Данные BARI 2D его авторы и комментаторы интерпретируют подобно тому, как это сделано для исследования COURAGE: «Многие больные с СД 2-го типа при стабильном течении хронической ИБС после исключения наличия тяжелых трехсосудистых поражений КА и поражения общего ствола ЛКА в качестве начальной стратегии могут требовать лишь оптимальной медикаментозной терапии с изменениями образа жизни. В случаях более значимого поражения КА показано выполнение реваскуляризации; во многих случаях предпочтительно проведение АКШ, но также возможны и ЧККВ, и гибридные вмешательства (АКШ + ЧККВ)».
Чем отличаются непокрытые и покрытые стенты? Напомним читателю, что чрескожное коронарное вмешательство выполняется с помощью введенного в коронарный сосуд (например, через бедренную артерию) катетера, с помощью которого к месту сужения сосуда доставляются баллон и стент. В области сужения баллон расправляют и механически устраняют сужение (это обозначается термином «ангиопластика»). Если ограничиться таким баллонированием, то в этой области вследствие эластических свойств структур стенки с высокой вероятностью вскоре вновь разовьется сужение сосуда (применяется термин «рестеноз»). Для противодействия этому процессу и используются стенты (они представляют собой протезы достаточно сложной и разнообразной конструкции), которые вводятся в сосуд вместе с баллоном в нерасправленном состоянии. При баллонировании стент расправляется, после чего остается в месте исходного сужения, достаточно существенно уменьшая риск рестеноза.
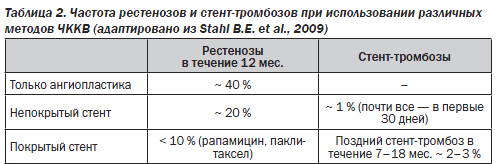
Структуры стенки сосуда, соприкасаясь со стентом в месте его расположения, взаимодействуют с ним, характер этого взаимодействия зависит от того, какой именно стент используется. При применении так называемых непокрытых стентов (bare metal stent) материал стента быстрее покрывается эндотелием. Это рассматривается как важная положительная характеристика, поскольку устраняются участки травматизации эндотелия и тем самым уменьшается риск внутристентового тромбозирования. Имеется и значимый недостаток: в части случаев процесс эндотелизации не завершается покрытием эндотелием материала стента; развивается чрезмерная пролиферация эндотелия, что вновь приводит к развитию рестеноза. Частота развития рестенозов при использовании непокрытых стентов примерно в 2–3 раза ниже, чем при простом баллонировании, но все же считается слишком высокой.
Для преодоления этой проблемы стенты покрывают длительно высвобождающимися веществами с антипролиферативным действием. Постепенно высвобождаясь, эти вещества (например, сиролимус, паклитаксел, рапамицин и др.) уменьшают пролиферацию эндотелия и значительно снижают риск рестеноза. Однако такие покрытые стенты (drug-elutingstent) также не лишены недостатка: препятствуя пролиферации эндотелия, они могут замедлять покрытие эндотелием структур стента. Это на длительный период сохраняет контакт травмируемых стентом участков сосудистой стенки с кровью, что увеличивает риск тромбоза стента. В табл. 2 представлены данные одного из регистров Германии о частоте рестенозов и стент-тромбозов при использовании различных методов ЧККВ.
Что представляет собой стент-тромбоз, каковы пути его предупреждения? Этим понятием обозначают тромбозирование, развивающееся на структурах имплантированного в сосуд (в обсуждаемом нами случае — коронарный) стента. Стент-тромбоз может развиваться при использовании как непокрытого, так и покрытого стента, однако показано, что для покрытых стентов частота развития стент-тромбозов выше. Полагают, что высвобождающиеся из покрытого стента антипролиферативные препараты увеличивают риск стент-тромбоза вследствие ряда механизмов: снижения темпов реэндотелизации, уменьшения миграции эндотелиальных клеток, угнетения функции эндотелиальных клеток-предшественников, увеличения высвобождения из структур стенки сосудов прокоагулянтного тканевого фактора.
Особенно высок риск стент-тромбоза при использовании покрытых стентов у лиц с острым коронарным синдромом — ОКС (видимо, из-за того, что при этом особенно высок риск интраваскулярной коагуляции), в связи с этим в последнее время при первичном ЧККВ у больных с ОКС многие специалисты предпочитают применять непокрытые стенты (A. Finnetal., 2009).
При хронической ИБС риск стент-тромбоза также несколько выше при применении покрытых стентов в сравнении с непокрытыми (особенно в сроки более полугода после имплантации стента, что иногда обозначают термином «поздний стент-тромбоз»). Данные крупных международных регистров о частоте стент-тромбоза при хронической ИБС весьма разноречивы; авторы сочли возможным привести несколько подобных сообщений. В регистре BASKET (2009) в сроки 7–18 месяцев после установления стентов приводятся следующие данные об осложнениях: стент-тромбоз для непокрытых стентов — 1,3 %, для покрытых — 2,6 %; смерть/инфаркт миокарда для непокрытых стентов — 1,3 %, для покрытых — 4,9 %. Привлекают внимание данные крупного (73 798 стентов) шведского регистра (Bo Lagerquist et al., 2009). За 2 года наблюдения отмечено 882 случая стент-тромбоза (несмотря на длительное применение двойной антитромбоцитарной терапии клопидогрелем и аспирином); установлена его связь с наличием сахарного диабета, курением, малым диаметром стента, позицией стента в области рестеноза. В сроки до 6 мес. частота стент-тромбоза была выше (на 21 %) при использовании непокрытых стентов, в последующем — в 2 раза выше при применении покрытых стентов. В одном из регистров США (2009; 262 700 больных в возрасте > 65 лет, наблюдение до 30 мес.), напротив, представлены данные о более низкой частоте сердечно-сосудистых осложнений при использовании покрытых стентов в сравнении с непокрытыми (на 25 % ниже общая смертность, на 24 % ниже частота инфарктов миокарда).
При обсуждении факторов риска стент-тромбоза приведем данные известных специалистов в области проблем тромбозирования и антитромботической терапии
G. Montalescot et al. (2009) из работы с обобщающим названием «Stent Trombosis: who''s guilty?» («Стент-тромбоз: кто виноват?»). Важнейшая роль в снижении риска стент-тромбоза (особенно при имплантированном покрытом стенте) отводится проведению адекватной по продолжительности двойной антитромбоцитарной терапии, которая включает аспирин и клопидогрель (более подробно этот материал изложен в разделе книги, посвященном клопидогрелю).
Факторы риска стент-тромбоза (адаптировано из G. Montalescot et al., 2009)
1. Связанные с пациентом:
2. Связанные с генетикой пациента:
3. Связанные с антитромбоцитарным препаратом:
4. Связанные со стентом:
5. Связанные с врачом:
Какой метод реваскуляризации предпочтителен у больных с хронической ИБС, имеющих значимые стенозирующие поражения общего ствола левой коронарной артерии или значимые стенозирующие трехсосудистые поражения (аортокоронарное шунтирование или ЧККВ со стентированием)? В существующих рекомендациях для таких больных в качестве стандартного метода реваскуляризации рассматривается аортокоронарное шунтирование. В то же время в ряде случаев при поражениях общего ствола левой коронарной артерии с учетом данных исследования SYNTAX (2008–2009) считают возможным (например, A. White, R. Makkar, 2008) и выполнение ЧККВ со стентированием (только при менее тяжелых вариантах поражения, т.е. при низком уровне индекса SYNTAX). В обновленных рекомендациях экспертов США (2009) по выбору подходов к коронарной реваскуляризации (табл. 3) предпочтение при подобного рода поражениях отдается шунтированию.