Газета «Новости медицины и фармации» 6(312) 2010
Вернуться к номеру
Влияние Тиодарона на показатели эхокардиографии у больных с персистирующей фибрилляцией предсердий
Авторы: В.И. Целуйко, Т.В. Мотылевская, Харьковская медицинская академия последипломного образования, кафедра кардиологии и функциональной диагностики; А.Б. Лучков, Н.И. Даваль, Городская клиническая больница № 8, г. Харьков
Версия для печати
В многочисленных эпидемиологических исследованиях наличие фибрилляции предсердий (ФП) ассоциировано с увеличением риска развития инсультов или других тромбоэмболических осложнений, а также с увеличением смертности. Доказано, что продолжительность жизни пациентов с ФП в среднем на 20 % меньше, чем при синусовом ритме [3, 5].
Наличие гипертрофии миокарда левого желудочка, очагов фиброза после перенесенных инфарктов миокарда и, наконец, отсутствие эффективной систолы предсердий во время пароксизма ФП может приводить к изменению жесткостных параметров левого желудочка и нарушению активного расслабления миокарда левого желудочка и таким образом вызывать развитие диастолической дисфункции левого желудочка (ДДЛЖ). В свою очередь, существование ДДЛЖ резко увеличивает вероятность развития фибрилляции предсердий. Поэтому появление последней требует как можно более быстрого восстановления синусового ритма (электрическая или медикаментозная кардиоверсия) с последующим как можно более долгим его удержанием [1].
Одним из универсальных антиаритмических препаратов, убедительно доказавшим свою эффективность как в восстановлении синусового ритма (фармакологическая кардиоверсия), так и в его удержании, является амиодарон. В целом ряде рандомизированных исследований было установлено, что амиодарон по своей эффективности при восстановлении синусового ритма у пациентов с персистирующей ФП эквивалентен электрической кардиоверсии, хинидину, комбинации хинидина, верапамила и пропафенона [5]. Следует отметить, что амиодарон практически не влияет на сократимость миокарда и является препаратом выбора у больных с недостаточностью кровообращения [5].
Помимо описанных выше процессов ремоделирования предсердий, большое значение в поддержании ФП имеет оксидативный стресс, развивающийся на фоне пароксизма ФП. Поэтому представляет интерес изучение целесообразности включения в схему лечения препаратов, обладающих антиоксидантным действием. В нашей стране разработан тиотриазолин — препарат, который обладает антиоксидантным, мембраностабилизирующими, антиишемическими, противовоспалительными и иммуномодулирующими свойствами. Также описана его антиаритмическая эффективность за счет способности усиливать компенсаторную активность анаэробного гликолиза, снижать степень угнетения окислительных процессов в цикле Кребса с сохранением внутриклеточного фонда АТФ [2].
Возможно, комбинация антиаритмического и метаболического препаратов в одной таблетке будет обладать более выраженными антиаритмическими свойствами.
Цель исследования: оценить наличие дополнительных эффектов Тиодарона по сравнению с амиодароном у пациентов с ФП после успешной кардиоверсии.
Материалы и методы
В исследование включены 67 пациентов с персистирующей формой ФП. Всем пациентам в начале обследования помимо общепринятого клинического обследования (сбор жалоб, анамнеза, данных физикального обследования) определяли С-реактивный белок в плазме крови с помощью набора «СРБ — латекс-тест» методом латексной агглютинации. Проводили эхокардиоскопическое обследование на аппарате Sonoscape 5000 с определением показателей трансмембранного кровотока. Оценивались размеры камер сердца: левое предсердие, толщина межжелудочковой перегородки, толщина задней стенки левого желудочка, конечный систолический, конечный диастолический размер, фракция выброса. Оценка диастолической функции левого желудочка проводилась методом допплерэхокардиографии в импульсном режиме по показателям трансмитрального кровотока сразу после восстановления синусового ритма или в межприступный период. Рассчитывались следующие показатели: E пик (м/с) — скорость раннего диастолического наполнения, A пик (м/с) — максимальная скорость во время систолы предсердий, E/A — отношение скоростей раннего и позднего диастолического наполнения, IVRT (мс) — время изоволюметрического расслабления (оценивалось по показателям трансмитрального кровотока и кровотока в выносящем тракте ЛЖ), а также фиксировали проводимую терапию на момент включения в исследование. Повторное обследование пациентов проводили через 6 месяцев. Анализировали длительность удержания синусового ритма, содержание СРБ в плазме крови и показатели эхокардиоскопического обследования. На момент включения все пациенты получали стандартную антиаритмическую, антиишемическую, гипотензивную и гипохолестеринемическую терапию (табл. 1). Антиагреганты и непрямые антикоагулянты (варфарин) назначались всем пациентам с подбором адекватных доз для достижения и поддержания МНО в пределах 2–3. На фоне проведенного лечения у 20 (30 %) пациентов в течение месяца от начала приема произошла фармакологическая кардиоверсия, 47 (70 %) пациентам была проведена плановая электрическая кардиоверсия. Уровень повреждения миокарда наносимыми разрядами после проведения электрической кардиоверсии (ЭКС) оценивали при помощи определения количественного уровня тропонина I. Для этого у всех пациентов сразу после проведенной ЭКС набирали кровь из периферической вены, откручивали на центрифуге плазму и хранили в морозильной камере при температуре –20 °С. После накопления образцов содержание тропонина определили методом твердофазового фермент-связанного иммуносорбентного анализа с помощью набора troponin I EIA test kit. Всем пациентам в те же сроки проводились клиническое и лабораторное обследования. Cледует отметить, что во всех 47 пробах уровень тропонина I в плазме крови сразу после проведения ЭКС составлял менее 0,1 нг/мл, что свидетельствует об отсутствии повреждения сердечной мышцы при проведении плановой ЭКС.
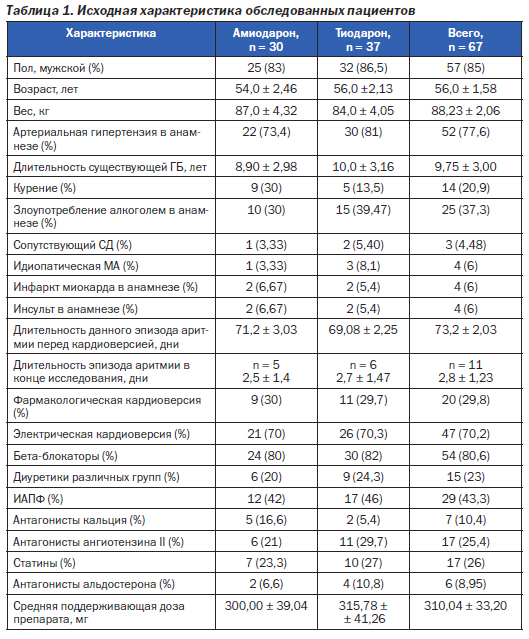
Было проведено рандомизированное исследование с участием 67 пациентов. Больному предлагалось выбрать немаркированный конверт, в котором предписывалось лечение амиодароном или Тиодароном — препаратом, содержащим 200 мг амиодарона и 100 мг тиотриазолина (производства фармацевтической компании «Артериум»). В группу амиодарона вошли 30 человек, в группу Тиодарона — 37 человек. Все пациенты в дополнение к основной терапии в первую неделю получали 800 мг соответствующего исследуемого препарата с последующим снижением дозировки под контролем показателя интервала QT корригированного. Сравнительная характеристика обследованных пациентов представлена в табл. 1.
Статистическая обработка данных проводилась с помощью программы SРSS, версия 11.0. Использовались стандартные методы статистики, в частности вычисление непарного критерия t Стьюдента, для оценки достоверности различий между группами. Данные представлены в виде M ± m, где M — средняя величина, m — ошибка среднего. Для оценки достоверности различий между показателями в группах использована однофакторная модель дисперсионного анализа (АНОВА). За статистическую достоверность различий принимали p < 0,05.
Результаты и обсуждение
Среди обследованных было 57 (85 %) мужчин и 10 (15 %) женщин, характеристика пациентов обеих групп представлена в табл. 1. Из табл. 1 видно, что группы были сопоставимы по полу, массе тела, возрасту, клинико-анамнестическим данным и сопутствующей терапии. Наиболее часто встречающейся нозологической единицей, на фоне которой развилась фибрилляция предсердий, была гипертоническая болезнь (77,6 %), идиопатическая форма ФП диагностирована у 4 (6 %). Сопутствующую сердечную недостаточность (СН) диагностировали исходя из жалоб пациентов (переносимость физических нагрузок, одышка при нагрузке, шестиминутный тест с ходьбой) и по показателям эхокардиоскопии. На момент включения СН с систолической дисфункцией левого желудочка (ФВ менее 40 %) не наблюдалась ни у одного пациента. СН с сохранной функцией левого желудочка предположительно диагностирована у 32 человек (48,3 %), в группе Тиодарона — у 13 человек (35,0 %), в группе контроля — у 19 пациентов (63,3 %). Эффективность проводимой терапии оценивали по длительности удержания синусового ритма в обеих группах. Через 6 месяцев синусовый ритм сохранился у 19 (64 %) пациентов в группе амиодарона и 25 (68,5 %) в группе Тиодарона. У 7 пациентов (23 %) и у 9 (24,3 %) из обеих групп соответственно на фоне антиаритмической терапии сохранялись пароксизмы ФП, однако продолжительность эпизода ФП значительно уменьшилась (табл. 1). У семи пациентов — 4 (13 %) из группы амиодарона и 3 (8 %) из группы Тиодарона — после срыва ритма на фоне приема исследуемых препаратов фармакологической кардиоверсии не произошло. Клинико-анамнестическая характеристика обследованных пациентов представлена в табл. 1.
Исходные уровни СРБ в обеих группах статистически значимо не различались, в динамике в обеих группах содержание СРБ осталось практически на прежнем уровне.
Анализ размеров полостей сердечной мышцы показал, что в группе Тиодарона размеры левого предсердия уменьшились на 13 % (р ≤ 0,05), та же тенденция (– 4 %) наблюдалась в группе амиодарона (статистически недостоверно).
Анализ динамики показателей трансмитрального кровотока включал в себя разделение всех обследованных на три группы в зависимости от показателя Е/А. В первую подгруппу вошли пациенты с рестриктивным типом (Е/А более 2). Известно, что при рестриктивном типе ДД прогноз пациентов наиболее неблагоприятный, однако в течение полугода срыв ритма произошел только у одного пациента. Пациентов с рестриктивным типом было 18 в обеих группах (табл. 2). В динамике в течение 6 месяцев этот показатель стал ниже 2 у 60 пациентов, причем снижение показателя Е/А произошло за счет снижения амплитуды пика Е и роста амплитуды пика А. В группе амиодарона амплитуда Е уменьшилась на 5 %, амплитуда А увеличилась на 8 %, в группе Тиодарона динамика показателей была 12 и 15 % соответственно (р ≤ 0,05). Та же тенденция наблюдалась при анализе времени изоволюметрического расслабления (IVRT). Наиболее значительное укорочение изоволюмического времени было у пациентов с рестриктивным типом нарушений диастолы. В группе амиодарона этот показатель уменьшился на 56 %, в группе Тиодарона — на 80 % (р ≤ 0,05), та же динамика наблюдалась в группах с отношением Е/А от 1–2. Анализ этих показателей в группах с нормальным типом трансмитрального кровотока продемонстрировал ту же тенденцию: снижение амплитуды Е и рост амплитуды А с укорочением времени изоволюмического сокращения, в группе Тиодарона — на 23 % (р ≤ 0,05), в группе амиодарона — на 4 % (статистически незначимо).
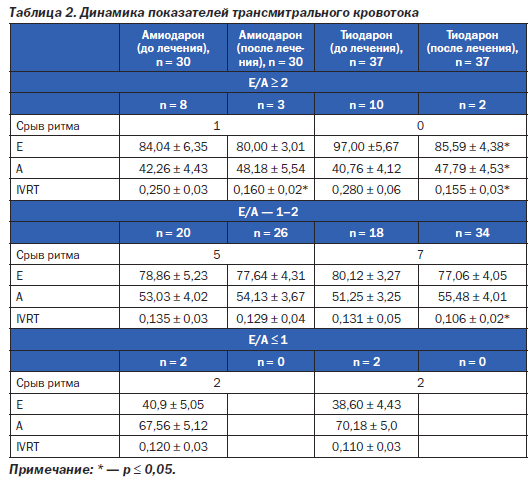
Наиболее неблагоприятное течение персистирующей ФП у пациентов с показателем Е/А меньше 1. Из семи пациентов с неблагоприятным исходом ФП (переведена в постоянную форму) у 4 показатель Е/А был меньше 1, в динамике оценить этот показатель не удалось. В то же время показатель IVRT у этих пациентов практически приближался к нормальным значениям.
Таким образом, проведенное исследование подтверждает, что антиаритмическая эффективность препарата Тиодарон сопоставима с амиодароном других производителей. Комбинация амиодарона с тиотриазолином обладает хорошим антиаритмическим эффектом и оказывает более значимое нормализующее влияние на диастолическую функцию левого желудочка.
Удержание синусового ритма в течение шести месяцев после кардиоверсии зависит от динамики показателей трансмитрального кровотока, снижения максимальной скорости раннего диастолического наполнения и увеличения максимальной скорости систолы предсердий, укорочения времени изоволюмического расслабления.
1. Березин А.Е. Диастолическая сердечная недостаточность: фенотипическая особенность или новое кардиоваскулярное заболевание? // Укр. мед. часопис. — 2008. — 2(64), III/IV. — С. 81-89.
2. Бобров В.А., Поливода С.Н. Состояние перекисного окисления липидов мембран и антиоксидантной обеспеченности на различных стадиях формирования «гипертензивного» сердца // Кардиология. — 1992. — № 3. — С. 42-44.
3. Дзяк Г.В., Локшин С.П. Мерцательная аритмия: современное состояние проблемы // Международный медицинский журнал. — 2007. — № 6.
4. Сычев О.С., Романова Е.Н., Фролов А.И. и др. Применение амиодарона у больных с персистирующей формой фибрилляции предсердий и сердечной недостаточностью (результаты многоцентрового исследования) // Украинский кардиологический журнал. — 2003. — № 1.
5. Фролов А.И. Диагностика и лечение фибрилляции предсердий // Практическая ангиология. — 2006. — № 4.
6. Шубик Ю.В. Амиодарон в международных рекомендациях по лечению аритмий // Новости медицины и фармации. — 2009. — № 305. — С. 53-59.
7. Aviles R.J., Martin D.O., Apperson-Hansen C. et al. Inflammation as a risk factor for atrial fibrillation // Circulation. — 2003. — 108. — 3006-3010.
8. Сhung M.K., Sprecher D. еt al. C-reactive protein elevation in patients with atrial arrhythmias // Circulation. — 2001. — 104. — 2886-2891.
9. Dernellis J., Panaretou M. Relationship between C-reactive protein concentrations during glucocorticoid therapy and recurrent atrial fibrillation // Eur. Heart J. — 2004. — 25. — 1100-1107.
10. Frustaci A., Chimenti C., Bellocci F. et al. Histological substrate of atrial biopsies in patients with lone atrial fibrillation // Circulation. — 1997. — 96. — 1180-1184.
