Журнал «Болезни и антибиотики» 1(1) 2009
Вернуться к номеру
Современные технологии разумного использования антибиотиков
Авторы: Березняков И.Г., Харьковская медицинская академия последипломного образования
Рубрики: Семейная медицина/Терапия, Терапия
Версия для печати
Необходимость назначения антибиотиков при бактериальных инфекциях не подвергается сомнениям. Столь же очевидно, что при вирусных инфекциях антибиотики не нужны. Во-первых, они не действуют на вирусы; во-вторых, как свидетельствуют данные современной науки, не способны предупреждать присоединение бактериальной инфекции и улучшать исходы заболевания [1, 2]. Наибольшие трудности вызывает проблема использования антибиотиков при вирусно-бактериальных инфекциях. С одной стороны, многие такие инфекции склонны к самоизлечению (причем вызванные не только вирусами, но и бактериями, как, например, Moraxella catarrhalis). С другой — отличить вирусные инфекции от бактериальных по клинико-лабораторным и/или инструментальным признакам зачастую невозможно. С третьей — не назначать антибиотики больным с тяжелым течением заболевания небезопасно. Более того, даже у пациентов с нетяжелыми инфекциями всегда имеется риск усугубления клинической симптоматики, а также развития инфекционных и/или постинфекционных осложнений. Наконец, следует учитывать ожидания больного, его родственников или опекунов, а также разного рода личностные, материальные, административные, юридические, карьерные и прочие аспекты, с которыми может столкнуться врач вследствие принятия решения о назначении/неназначении антибиотиков.
Пожалуй, наилучшими примерами подобных заболеваний могут служить острые инфекции дыхательных путей: отиты, риносинуситы, тонзиллофарингиты, бронхиты. В настоящее время разработано несколько технологий разумного использования антибиотиков, альтернативных неотложному (срочному) назначению антибиотиков либо дополняющих его. В их числе: 1) лечение без антибиотиков; 2) отложенное (отсроченное) назначение антибиотиков; 3) пациент-специфичная ротация антибиотиков. Многие из этих технологий прошли проверку в ходе рандомизированных клинических исследований (РКИ). Проиллюстрировать их можно на примере лечения тонзиллофарингита.
Поражение небных миндалин (тонзиллит) может встречаться как изолированно, так и быть частью генерализованного фарингита. Ввиду отсутствия четких клинических различий между тонзиллитом и фарингитом в литературе все чаще используется термин «тонзиллофарингит», который практически вытеснил привычную «ангину».
Оценить истинную распространенность тонзиллофарингита затруднительно. По данным зарубежных исследований (Австралия, Великобритания), примерно 10 % населения обращается ежегодно за медицинской помощью по поводу этого заболевания [3, 4]. Острый тонзиллофарингит чаще регистрируется у детей.
Актуальность проблемы тонзиллофарингита объясняется не только распространенностью заболевания и связанными с ним временной утратой трудоспособности и невозможностью посещать учебные заведения, но и нередким развитием инфекционных (перитонзиллярный абсцесс, острый отит, острый синусит) и неинфекционных осложнений (острая ревматическая лихорадка, острый гломерулонефрит).
Заболевание вызывается преимущественно вирусами. Тем не менее если возбудитель представлен единственным патогеном, то им чаще всего оказываются β-гемолитические стрептококки группы А (БГСА). На их долю приходится 15–30 % всех случаев заболевания. Среди бактериальных возбудителей можно выделить также другие стрептококки (не-БГСА), арканобактерии, нейссерии, коринебактерии, микоплазмы и хламидии.
К сожалению, тонзиллофарингит, вызванный S.pyogenes (БГСА), невозможно диагностировать по клиническим или лабораторным признакам либо их комбинации. Диагноз подтверждается с помощью посева мазка из ротоглотки или экспресс-теста. При этом выделение БГСА при культуральном исследовании не позволяет отличить истинную инфекцию от носительства [5].
В разное время предлагались различные правила клинического предсказания БГСА-инфекции, наиболее известными из которых являются критерии Центора: наличие экссудата на миндалинах, болезненность передних шейных лимфатических узлов, отсутствие кашля и лихорадка в настоящее время или в анамнезе данного заболевания [6]. Прогностическая ценность этих признаков зависит от распространенности БГСА-инфекции в популяции. В ряде исследований у взрослых больных с тонзиллофарингитом было показано, что при выявлении 3 или 4 критериев Центора вероятность того, что заболевание действительно вызвано БГСА, составляет 40–60 %, а при отрицательных результатах обследования вероятность нестрептококковой этиологии — порядка 80 % [7].
Эффективность неотложной (срочной) антибактериальной терапии (АБТ) у больных с острым тонзиллофарингитом проанализирована в недавнем систематическом обзоре [8]. В него вошли 27 РКИ (всего 2835 случаев тонзиллофарингита). На 3-й день от начала лечения в группе больных, получавших антибиотики, по сравнению с группой плацебо примерно в 2 раза реже регистрировалась головная боль и на треть реже — лихорадка. Спустя неделю от начала терапии в группе больных, получавших антибиотики, симптомы тонзиллофарингита также отмечались реже, чем в группе плацебо (относительный риск (ОР) 0,65; 95%-ный доверительный интервал (ДИ) 0,55–0,76; p < 0,00001).
Антибиотики статистически значимо превосходили плацебо и в плане предупреждения гнойных (перитонзиллярный абсцесс, острый средний отит) и негнойных осложнений (острая ревматическая лихорадка) (рис. 1). Тем не менее переоценивать эти данные не следует. Например, для предупреждения 1 случая острого среднего отита необходимо пролечить антибиотиками около 200 больных с предположительно бактериальным тонзиллофарингитом [8]. Частота госпитализаций по поводу перитонзиллярного абсцесса составляет порядка 1,66 на каждые 10 тыс. человек, переболевших инфекциями верхних дыхательных путей/тонзиллофарингитом [9]. Заболеваемость негнойными постстрептококковыми осложнениями (острая ревматическая лихорадка, острый гломерулонефрит) в последние десятилетия существенно снизилась.
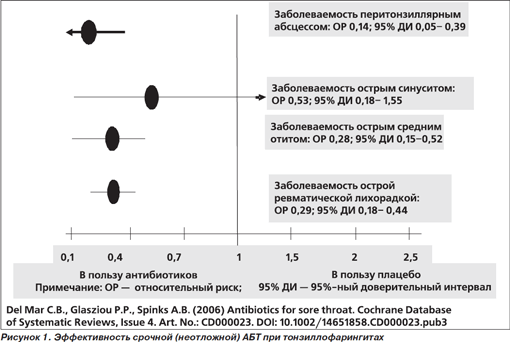
При анализе по подгруппам польза от антибиотиков демонстрировалась только при подтвержденных стрептококковых тонзиллофарингитах и не обнаруживалась (либо существенно снижалась) у больных с предположительной (≥ 3 критериев Центора) или неподтвержденной бактериальной этиологией заболевания. Наконец, доказательства пользы от антибиотиков получены в регионах, где их традиционно редко назначают при тонзиллофарингитах; следовательно, нельзя исключить, что в поле зрения врачей попадали пациенты с более тяжелыми (и вероятно, бактериальными) формами заболеваний [10]. Кроме того, не следует забывать и о возрастании риска нежелательных лекарственных явлений (НЛЯ) при лечении антибиотиками, а также об угрозе возникновения и распространения резистентности к используемым препаратам.
Технологии лечения без антибиотиков и/или отложенного (отсроченного) назначения антибиотиков сравнивались со срочной АБТ у больных с тонзиллофарингитами в 3 РКИ [11–13]. Первые 2 РКИ проведены в одной педиатрической клинике. Условия проведения исследований (больные, рандомизированные в группу отложенного назначения антибиотиков, в течение первых 2 дней лечения получали плацебо антибиотиков, вслед за чем — уже собственно антибактериальные препараты на протяжении 10 дней) не вполне адекватны тестируемой технологии. Поэтому для иллюстрации достоинств и недостатков обсуждаемых технологий лучше обратиться к многоцентровому исследованию [13], в котором новые технологии тестировались в «классическом» виде. Основные результаты этого исследования представлены на рис. 2–5.
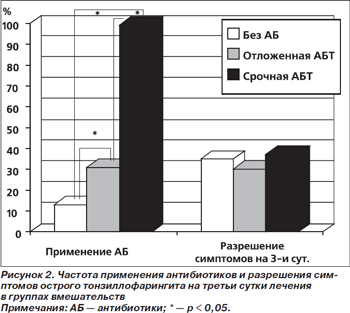
Даже в группе лечения без антибиотиков у 13 % больных в конечном итоге пришлось прибегнуть к назначению этих препаратов. Доля пациентов, получавших антибиотики, в группе отложенного их назначения составила 31 % и оказалась статистически значимо большей, чем в группе лечения без антибиотиков, и меньшей, чем в группе срочной АБТ. Тем не менее на 3-и сутки от начала терапии доля больных, у которых отсутствовали симптомы острого тонзиллофарингита, колебалась от 30 % в группе отложенной АБТ до 35 % в группе без антибиотиков и 37 % в группе срочной АБТ (все различия не достигли статистической значимости) (рис. 2). Таким образом, уже на третьи сутки от начала (лечения) заболевания почти каждый 3-й больной выздоравливает — вне зависимости от того, получал он антибиотики или нет.
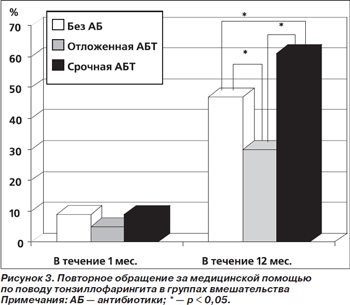
Частота повторного обращения за медицинской помощью по поводу тонзиллофарингита в течение месяца после начала заболевания в группах вмешательства не различалась и колебалась от 5 % в группе отложенной АБТ до 9 % в группах без антибиотиков и срочной АБТ. В то же время частота повторных обращений за медицинской помощью по поводу тонзиллофарингита в течение 1 года после перенесенного заболевания была наименьшей в группе отложенного назначения антибиотиков (30 %), наибольшей — в группе срочной АБТ (61 %) (рис. 3).
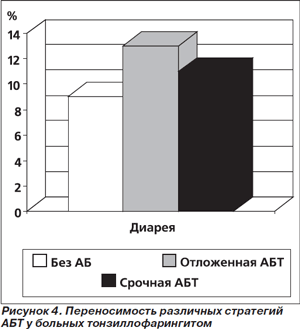
Переносимость сравниваемых стратегий использования антибиотиков оказалась сопоставимой. Самым частым НЛЯ была диарея, частота которой в группах статистически значимо не различалась (рис. 4).
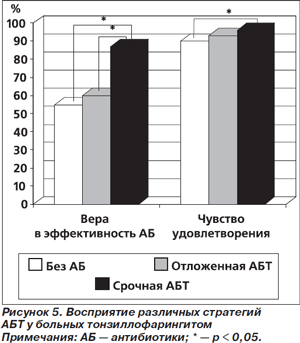
Уверенность в необходимости назначения антибиотиков для лечения острого тонзиллофарингита оказалась самой высокой в группе срочной АБТ и превосходила таковую у больных/их родственников/опекунов из групп отложенного назначения антибиотиков и лечения без антибиотиков. Не менее 90% больных (их родственников/опекунов) испытывали чувство удовлетворения при использовании всех трех стратегий назначения антибиотиков. Тем не менее удовлетворенность назначенной терапией в группе срочной АБТ (97 %) статистически значимо превосходила таковую в группе лечения без антибиотиков (90 %) (рис. 5) [13].
Таким образом, подтверждена допустимость и безопасность лечения без антибиотиков и отложенного назначения антибиотиков у больных с острым тонзиллофарингитом. При этом технология отложенного назначения представляется более перспективной. При ее использовании пациенты значительно реже принимают антибиотики, чем при срочной АБТ; повторные обращения за медицинской помощью по поводу этого заболевания в течение года после перенесенного тонзиллофарингита регистрируются также существенно реже, а удовлетворенность назначенным лечением не отличается от таковой при срочной АБТ. Кроме того, при подобном подходе устанавливаются более доверительные отношения между врачом и пациентами; последние (либо их родители или опекуны) участвуют в принятии решения о тактике лечения, а общее потребление антибиотиков снижается. И для врача, и для пациента такая технология представляется более приемлемой, нежели отказ в назначении либо неотложное назначение антибиотиков.
Если врач все же принимает решение о лечении без антибиотиков, ему следует рассказать пациенту, что они мало повлияют на течение заболевания, однако способны вызвать нежелательные реакции — диарею, рвоту, сыпь и др. Но такое решение сопряжено с определенным риском: в случае усугубления клинической симптоматики или присоединения осложнений, а также при настроенности больного (а у детей — их родителей или опекунов) на лечение антибиотиками может пострадать репутация врача. Более прагматичный подход — выписать больному рецепт на антибиотик, но убедить его не принимать (или не приобретать в аптеке) препарат сразу, а только в том случае, если процесс выздоровления затягивается либо присоединяются осложнения. Пациенту следует также посоветовать вновь обратиться за медицинской помощью, если его состояние, несмотря на отложенную АБТ, ухудшилось.
Безусловно, для использования подобных стратегий существуют определенные ограничения. Отложенное применение антибиотиков либо лечение без антибиотиков можно рекомендовать больным с тонзиллофарингитом из групп низкого риска развития осложнений. Если же при осмотре больного обнаруживается ≥ 3 критериев Центора, он сам или его родственники/опекуны настаивают на назначении антибиотиков либо заболевание протекает тяжело, целесообразно сразу же предложить ему срочное лечение антибиотиками. Именно срочная АБТ станет приоритетным выбором в перечисленных ситуациях – но, как показано выше, не единственным.
Препаратами выбора для лечения больных тонзиллофарингитом являются β-лактамы для приема внутрь (феноксиметилпенициллин, амоксициллин, цефалоспорины I поколения). Пиогенные стрептококки — ключевые бактериальные возбудители тонзиллофарингитов — не вырабатывают β-лактамазы и сохраняют практически 100%-ную чувствительность к пенициллинам. Стандартная длительность терапии составляет 10 дней. Тем не менее накапливающиеся данные свидетельствуют, что выбирать β-лактамы следует не всегда. При аллергии на антибиотики этого класса предпочтение следует отдавать макролидам, которые лишены недостатков, присущих респираторным фторхинолонам, тетрациклинам и ко-тримоксазолу. В частности, респираторные фторхинолоны не используются при беременности и в педиатрической практике. Сходные ограничения установлены и для доксициклина. Более того, доксициклин и ко-тримоксазол не обеспечивают эрадикации (истребления, уничтожения) БГСА из ротоглотки [14].
Второе важное обстоятельство, влияющее на выбор терапии, — «антибактериальный анамнез» пациента. Если нынешнему заболеванию тонзиллофарингитом предшествовала АБТ (по любому поводу) β-лактамами, макролидами или респираторными фторхинолонами, возрастает риск носительства резистентных к этим антибиотикам микроорганизмов, которые могут стать возбудителями нынешнего заболевания. Продолжительность времени, в течение которого сохраняется негативное воздействие предшествующей АБТ, точно не установлена, но, по-видимому, составляет не менее 3 месяцев. Поэтому при новом заболевании следует применять антибиотик, отличный от использованного ранее, даже если тот оказывался эффективным. Эта концепция получила название «пациент-специфичная ротация антибиотиков». Хотя она представляется вполне логичной, до настоящего времени данная гипотеза не тестировалась в проспективных исследованиях. Если истинность ее положений найдет подтверждение в клинических исследованиях, тогда предстоит отказаться от поиска какого-либо одного антибиотика (или класса антибиотиков), который бы всегда превосходил другие при лечении инфекций дыхательных путей. Напротив, оптимальной клинической практикой станет чередование антибиотиков разных классов (при условии того, что они активны в отношении предполагаемого возбудителя, а уровень приобретенной резистентности к ним остается низким).
Альтернативой β-лактамам, как уже упоминалось, являются макролиды, которые по химической структуре делятся на 14-, 15- и 16-членные. Описаны два механизма приобретенной устойчивости к макролидам: модификация мишени для действия антибиотиков (так называемый MLSB-фенотип) и активное выведение антибиотиков из бактериальной клетки (M-фенотип). В первом случае клинически неэффективными становятся не только все макролиды, но также линкосамиды и стрептограмины, во втором — только 14- и 15-членные макролиды. Если, например, БГСА обладают M-фенотипом резистентности, то они сохраняют чувствительность к 16-членным макролидам. В эту группу входят джозамицин, мидекамицин и спирамицин (Ровамицин).
К сожалению, достоверные отечественные данные о чувствительности БГСА к антибиотикам отсутствуют. В силу географической близости и общих традиций в использовании антибиотиков наибольший интерес представляют результаты микробиологических исследований, выполненных в России. В какой-то мере их можно использовать в качестве ориентира для Украины.
Высокая резистентность БГСА к тетрациклинам (> 40 %) делает невозможным эмпирическое использование этого класса антибиотиков для лечения инфекций, вызванных данными микроорганизмами. Напротив, к пенициллинам, респираторным фторхинолонам и макролидам БГСА сохраняют высокую чувствительность. При этом, согласно последним российским данным, уровень чувствительности к 14-членным макролидам (87,3 %) существенно ниже, чем к 16-членным (97,1 %) [15]. Следовательно, при использовании этого класса антибиотиков для эмпирической терапии БГСА-инфекций предпочтение следует отдавать 16-членным макролидам, в частности спирамицину (Ровамицин). Клиническая эффективность Ровамицина при острых тонзиллофарингитах превышает 90 % и сопоставима с таковой эритромицина и феноксиметилпенициллина [16–18] или превышает ее [19].
Ровамицин — один из наиболее известных и хорошо изученных препаратов с отличным профилем безопасности. В отличие от 14-членных макролидов он практически не вступает в межлекарственные взаимодействия, что существенно облегчает ведение пациентов и снижает риск НЛЯ. Во-вторых, хорошо известен «парадокс спирамицина», когда высокая клиническая эффективность антибиотика закономерно отмечается при инфекциях, вызванных даже слабо чувствительными к нему микроорганизмами. Данный эффект достигается сочетанием нескольких свойств: 1) способностью в высоких концентрациях и на протяжении длительного периода времени накапливаться в очаге воспаления (в частности, в миндалинах) и внутри нейтрофилов и макрофагов; 2) длительным постантибиотическим эффектом, в результате чего возбудители становятся более чувствительными к действию компонентов собственной иммунной системы пациента; 3) постантибиотическим суб-МПК-эффектом (когда плазменная концентрация спирамицина снижается ниже минимальной подавляющей концентрации (МПК) возбудителя, но при этом продолжает угнетать адгезивные свойства стрептококков и других патогенов); 4) повышением активности в 2–4 раза в присутствии сыворотки крови; 5) наличием противовоспалительных и иммуномодулирующих свойств [20, 21]. В-третьих, Ровамицин может использоваться у больных обоих полов и любого возраста, включая беременных женщин, хотя его не следует применять при кормлении грудью.
Немаловажным обстоятельством является также то, что Ровамицин – это оригинальный препарат, доступный по цене и присутствующий на рынке Украины более 10 лет. Препарат удобно дозировать: Ровамицин назначается внутрь 2–3 раза в сутки независимо от приема пищи. Разовая доза для взрослых составляет 3 млн МЕ. Детям с массой тела более 20 кг назначают по 1,5 млн МЕ на каждые 10 кг массы тела в 2–3 приема. Стандартный курс терапии острого тонзиллофарингита составляет 10 дней, хотя в последние годы получены доказательства сопоставимой бактериологической эффективности коротких курсов (4–5 дней) лечения макролидами (кроме азитромицина) по сравнению с традиционными 10-дневными. Напротив, краткие курсы лечения пенициллинами ассоциируются с худшей эрадикацией возбудителей по сравнению с традиционными [22].
Выводы
1. Целесообразность неотложного назначения антибиотиков при вирусно-бактериальных заболеваниях остается предметом дискуссий. В большинстве случаев отличить вирусные инфекции, например, верхних дыхательных путей от бактериальных на основании клинико-лабораторных и инструментальных признаков не представляется возможным. Определенную помощь могут оказать длительность сохранения симптомов заболевания, усугубление его течения после кратковременного улучшения и в ряде случаев — правила клинического предсказания бактериальных инфекций.
2. Альтернативами неотложному назначению антибиотиков могут быть: 1) лечение без антибиотиков; 2) отложенное (отсроченное) назначение антибиотиков. Эффективность обеих технологий продемонстрирована на примере острого тонзиллофарингита.
3. Признание значимости «антибактериального анамнеза» (недавнего использования антибиотиков того или иного класса) легло в основу концепции пациент-специфичной ротации антибиотиков, справедливость которой еще предстоит доказать в проспективных клинических исследованиях.
4. Препаратами выбора для лечения больных тонзиллофарингитом являются β-лактамы. При аллергии на антибиотики этого класса или анамнестических указаниях на их недавнее использование (в промежуток не менее 3 месяцев до возникновения нынешнего заболевания тонзиллофарингитом) предпочтение следует отдавать 16-членным макролидам, в частности Ровамицину.
1. Arroll B., Kenealy T. Antibiotics for the common cold and acute purulent rhinitis (Cochrane Review). The Cochrane Database of Systematic Reviews 2005, Issue 3. Art. No.: CD000247.
2. Fahey T., Stocks N., Thomas T. Systematic review of the treatment of upper respiratory tract infection // Arch. Dis. Child. — 1998. — 79. — 225-30.
3. Del Mar C., Pincus D. Incidence patterns of respiratory illness in Queensland estimated from sentinel general practice // Aust. Fam. Physician. — 1995. — 24. — 625-9, 32.
4. Hannaford P.C., Simpson J.A., Bisset A.F. et al. The prevalence of ear, nose and throat problems in the community: results from a national cross-sectional postal survey in Scotland // Fam. Pract. — 2005. — 22. — 227-33.
5. Kaplan E.L. Clinical guidelines for group A streptococcal throat infections // Lancet. — 1997. — 350. — 899-900.
6. Centor R.M., Witherspoon J.M., Dalton H.P. et al. The diagnosis of strep throat in adults in the emergency room // Med. Decis. Making. — 1981. — 1. — 239-46.
7. Cooper R.J., Hoffman J.R., Bartlett J.G. et al. Principles of appropriate antibiotic use for acute pharyngitis in adults: background // Ann. Intern. Med. — 2001. — 134. — 509-17.
8. Del Mar C.B., Glasziou P.P., Spinks A.B. (2006) Antibiotics for sore throat. Cochrane Database of Systematic Reviews, Issue 4. Art. No.: CD000023. DOI: 10.1002/14651858.CD000023.pub3.
9. Little P., Watson L., Morgan S. et al. Antibiotic prescribing and admissions with major suppurative complications of respiratory tract infections: a data linkage study // Br. J. Gen. Pract. — 2002. — 52. — 187-93.
10. NICE clinical guideline 69. Respiratory tract infections – antibiotic prescribing. Prescribing of antibiotics for self-limiting respiratory tract infections in adults and children in primary care. Issue date: July 2008. www.nice.org.uk/CG69
11. Pichichero M.E., Disney F.A., Talpey W.B. et al. Adverse and beneficial effects of immediate treatment of Group A beta-hemolytic streptococcal pharyngitis with penicillin // Pediat. Infect. Dis. J. — 1987. — 6. — 635-43.
12. Gerber M.A., Randolph M.F., DeMeo K.K. et al. Lack of impact of early antibiotic therapy for streptococcal pharyngitis on recurrence rates // J. Pediatr. — 1990. — 117. — 853-8.
13. Little P., Williamson I., Warner G. et al. Open randomised trial of prescribing strategies in managing sore throat // BMJ. — 1997. — 314. — 722-7.
14. Каманин Е.И., Стецюк О.У. Инфекции верхних дыхательных путей и ЛОР-органов // Практическое руководство по антиинфекционной химиотерапии / Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. — Смоленск: МАКМАХ, 2007. — 248-57.
15. Сидоренко С.В., Грудинина С.А., Филимонова О.Ю., Столярова Л.Г., Савинова Г.А. Резистентность к макролидам и линкозамидам среди Streptococcus pneumoniae и Streptococcus pyogenes в Российской Федерации // Клин. фармакол. тер. — 2008. — 17(2). — 28-32.
16. Soekrawinata T. , Ibrahim T., Driyatno E. Spiramycin and erythromycin in the treatment of acute tonsillo-pharyngitis: a comparative study // Curr. Med. Res. Opin. — 1984. — 9(5). — 296-300.
17. Suprihati, Noersinggih, Hoedijono R. Treatment of acute tonsillo-pharyngitis: a comparative study of spiramycin and erythromycin // Curr. Med. Res. Opin. — 1984. — 9(3). — 192-6.
18. Gendrel D., Bourrillon A., Bingen E. et al. Five-day spiramycin vs. seven-day penicillin V in the treatment of streptococcal tonsillitis in children // Clin. Drug. Invest. — 1997. — 13. — 338-44.
19. Manolopoulos L., Adamopoulos C., Tzagourolakis A. et al. Spiramycin versus penicillin V in the empiric treatment of bacterial tonsillitis // Br. J. Clin. Pract. — 1989. — 43. — 94-6.
20. Smith C.R. The spiramycin paradox // J. Antimicrob. Chemother. — 1988. — 22 (Suppl. B). — 141-4.
21. Страчунский Л.С., Козлов С.Н. Макролиды в современной клинической практике. — Смоленск: Русич, 1998.
22. Casey J.R., Pichichero M.E. Metaanalysis of short course antibiotic treatment for group a streptococcal tonsillopharyngitis // Pediatr. Infect. Dis. J. — 2005. — 24(10). — 909-17.
