Международный эндокринологический журнал Том 21, №7, 2025
Вернуться к номеру
Експериментальний аналіз ремоделювання міокарда під впливом комбінованого метаболічного i гемодинамічного стресу та його фармакологічна корекція
Авторы: L.Ye. Kovalchuk, O.H. Popadynets, O.M. Didushko, H.B. Kulynych, M.V. Bielinskyi, A.S. Herashchenko, I.M. Markiv
Ivano-Frankivsk National Medical University, Ivano-Frankivsk, Ukraine
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
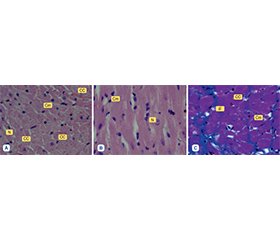
Актуальність. Цукровий діабет і серцева недостатність є поширеними коморбідними станами, які взаємно посилюють патологічне ремоделювання міокарда. Гіпертрофія кардіоміоцитів та інтерстиціальний фіброз розглядаються як ключові морфологічні прояви цієї патології. Останніми роками з’явилися нові фармакологічні засоби, зокрема інгібітори натрійзалежного котранспортера глюкози 2-го типу й інгібітори рецепторів ангіотензину/неприлізину, що довели здатність зменшувати вираженість ремоделювання і покращувати прогноз пацієнтів. Проте морфологічні кореляти дії цих препаратів на рівні кардіоміоцитів і строми залишаються недостатньо дослідженими в експериментальних моделях. Мета: вивчити гістологічні й морфометричні зміни міокарда у щурів із стрептозотоцин-індукованим діабетом у поєднанні з ізопреналін-індукованою серцевою недостатністю, а також оцінити коригуючі ефекти монотерапії емпагліфлозином порівняно з комбінованим лікуванням емпагліфлозином і сакубітрилом/валсартаном. Матеріали та методи. У дослідження включено 40 білих безпородних щурів-самців, яких було розподілено на 4 групи: 1) контроль; 2) патологія без лікування (діабет + серцева недостатність); 3) емпагліфлозин (10 мг/кг внутрішньошлунково щодня протягом 30 діб); 4) емпагліфлозин (10 мг/кг) + сакубітрил/валсартан (60 мг/кг). Зразки міокарда забарвлювали гематоксиліном і еозином та за методом Массона. Морфометричний аналіз здійснювали із застосуванням мікроскопа Axioscope і цифрового аналізатора зображень. Вимірювали площу поперечного перерізу кардіоміоцитів та їх ядер. Результати. У тварин без лікування (ІІ група) виявлено нерівномірне повнокров’я капілярів, набряк строми й виражені зміни кардіоміоцитів: гіпертрофія, атрофія, вакуолізація цитоплазми, поліморфізм ядер і збільшення інтерстиціального фіброзу. Морфометричні показники суттєво перевищували контрольні: площа кардіоміоцитів дорівнювала 351,27 ± 16,20 мкм2 (проти 217,48 ± 9,47 мкм2; p < 0,01), площа ядер — 38,19 ± 2,14 мкм2 (проти 21,06 ± 0,93 мкм2; p < 0,01). Монотерапія емпагліфлозином (ІІІ група) знижувала вираженість змін: фіброз був обмежений дрібними вогнищами, морфометричні параметри становили відповідно 293,89 ± 12,70 мкм2 i 27,34 ± 2,18 мкм2. Найбільш виражений позитивний ефект спостерігався у групі комбінованої терапії (IV): морфологічна картина міокарда ставала більш однорідною, набряк та фіброз значно зменшувались, морфометричні показники наближалися до контрольних (235,29 ± 7,51 мкм2 та 24,63 ± 3,06 мкм2). Висновки. Емпагліфлозин чинить виражену кардіопротекторну дію в умовах поєднання діабету і серцевої недостатності, зменшуючи гіпертрофію та фіброз. Водночас комбіноване застосування емпагліфлозину та сакубітрилу/валсартану виявилось більш ефективним, забезпечуючи глибшу нормалізацію структури міокарда, зменшення інтрацелюлярного й інтерстиціального набряку, а також більш значуще наближення морфометричних показників до рівня інтактних тварин. Отримані результати підкреслюють перевагу комбінованого підходу для корекції складних коморбідних станів.
Background. Diabetes mellitus and heart failure are frequently coexisting conditions that synergistically accelerate pathological myocardial remodeling. Both cardiomyocyte hypertrophy and interstitial fibrosis are recognized as hallmarks of this combined pathology. Novel pharmacological interventions, including sodium-glucose cotransporter-2 inhibitors and angiotensin receptor-neprilysin inhibitors, have been shown to attenuate adverse remodeling and improve outcomes in clinical studies. However, the precise morphological correlates of these therapies at the cardiomyocyte and stromal level remain insufficiently explored in experimental models. The purpose was to investigate histological and morphometric changes of the myocardium in a rat model of streptozotocin-induced diabetes combined with isoproterenol-induced heart failure, and to evaluate the corrective effects of empagliflozin monotherapy compared to combination therapy with empagliflozin and sacubitril/valsartan. Materials and methods. Forty white random-bred male rats were divided into four groups: 1) controls; 2) untreated pathology (diabetes + heart failure); 3) empagliflozin monotherapy (10 mg/kg daily for 30 days); 4) combination therapy with empagliflozin (10 mg/kg) and sacubitril/valsartan (60 mg/kg). Myocardial samples were processed with hematoxylin-eosin and Masson’s trichrome stain. Morphometric analysis was performed using an Axioscope microscope and digital image analysis. Perimeter and cross-sectional area of cardiomyocytes and their nuclei were measured. Statistical analysis employed StatPlus and Statistica software. Results. In untreated animals (group II), we observed heterogeneous capillary congestion, stromal edema, and marked cardiomyocyte alterations: hypertrophy, atrophy, nuclear polymorphism, vacuolization, and extensive interstitial fibrosis. Morphometric indices were significantly increased compared to controls: mean cardiomyocyte area reached 351.27 ± 16.20 µm2 (vs. 217.48 ± 9.47 µm2, p < 0.01), and nuclear area — 38.19 ± 2.14 µm2 (vs. 21.06 ± 0.93 µm2, p < 0.01). Empagliflozin monotherapy (group III) partially ameliorated these changes, reducing fibrosis to small foci and lowering morphometric indices (293.89 ± 12.70 µm2 and 27.34 ± 2.18 µm2, respectively). The combination therapy (group IV) demonstrated the most pronounced effect, with near normalization of myocardial structure: interstitial edema was minimal, fibrosis was limited to thin collagen strands, and morphometric parameters approached control values (235.29 ± 7.51 µm2 and 24.63 ± 3.06 µm2). Conclusions. Empagliflozin demonstrates a significant protective effect on myocardial morphology under combined diabetic and heart failure stress. However, the addition of sacubitril/valsartan produces superior structural normalization, particularly by reducing fibrosis and edema and restoring myofibrillar organization. These findings provide morphological evidence that combination therapy may exert greater cardioprotective efficacy than monotherapy, supporting its use in complex comorbid settings.
емпагліфлозин; сакубітрил/валсартан; ремоделювання міокарда; фіброз; діабетична кардіоміопатія; серцева недостатність; експериментальні щури
empagliflozin; sacubitril/valsartan; myocardial remodeling; fibrosis; diabetic cardiomyopathy; heart failure; rat model
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Karuna N, Kerrigan L, Edgar K, Ledwidge M, McDonald K, et al. Sacubitril/valsartan attenuates progression of diabetic cardiomyo–pathy through immunomodulation properties: an opportunity to prevent progressive disease. Cardiovasc Diabetol. 2025 May 14;24(1):206. doi: 10.1186/s12933-025-02741-5.
- Hernandez AF, Udell JA, Jones WS, Anker SD, Petrie MC, et al. Effect of Empagliflozin on Heart Failure Outcomes After Acute Myocardial Infarction: Insights From the EMPACT-MI Trial. Circulation. 2024 May 21;149(21):1627-1638. doi: 10.1161/CIRCULATIONAHA.124.069217.
- Umaña Mejia CA, Flores Valdés JR, Alvarado Corletto D, Trujillo Asturias MA, Rojo Mendoza AI, et al. Efficacy of Empagliflozin Versus Placebo in Patients With Recent Acute Myocardial Infarction: A Systematic Review. Cureus. 2025 Jul 5;17(7):e87354. doi: 10.7759/cureus.87354.
- Butler J, Jones WS, Udell JA, Anker SD, Petrie MC, et al. Empagliflozin after Acute Myocardial Infarction. N Engl J Med. 2024 Apr 25;390(16):1455-1466. doi: 10.1056/NEJMoa2314051.
- Mustafa NH, Jalil J, Zainalabidin S, Saleh MSM, Asmadi AY, Kamisah Y. Molecular mechanisms of sacubitril/valsartan in cardiac remodeling. Front Pharmacol. 2022 Aug 8;13:892460. doi: 10.3389/fphar.2022.892460.
- Khan MS, Felker GM, Piña IL, Camacho A, Bapat D, et al. Reverse Cardiac Remodeling Following Initiation of Sacubitril/Valsartan in Patients with Heart Failure with and without Diabetes. JACC Heart Fail. 2021 Feb;9(2):137-145. doi: 10.1016/j.jchf.2020.09.014.
- Carluccio E, Dini FL, Correale M, Dattilo G, Ciccarelli M, et al.; Working Group on Heart Failure of the Italian Society of Cardiology. Effect of sacubitril/valsartan on cardiac remodeling compared with other renin-angiotensin system inhibitors: a difference-in-diffe–rence analysis of propensity-score matched samples. Clin Res Cardiol. 2024 Jun;113(6):856-865. doi: 10.1007/s00392-023-02306-0.
- Furukawa N, Matsui H, Sunaga H, et al. Sacubitril/valsartan improves diastolic left ventricular stiffness with increased titin phosphorylation via cGMP-PKG activation in diabetic mice. Sci Rep. 2024;14:25081. doi: 10.1038/s41598-024-75757-8.
- Todoriv TV, Voronych-Semchenko NM, Didushko OM. Chan–ges of endothelial function and oxidant status in insulin resistance and obesity under the conditions of iodine deficiency. International Journal of Endocrinology (Ukraine). 2023;19(2):111-7. doi: 10.22141/2224-0721.19.2.2023.1255.
- Nan G, Yang CB, Jia ZK. The effect of empagliflozin on cardiac function and structure in patients with heart failure with reduced ejection fraction: a systematic review and meta-analysis. Postepy Kardiol Interwencyjnej. 2025 May 27;21(2):146-154. doi: 10.5114/aic.2025.151600.
- Carluccio E, Biagioli P, Reboldi G, Mengoni A, Lauciello R, et al. Left ventricular remodeling response to SGLT2 inhibitors in heart failure: an updated meta-analysis of randomized controlled studies. Cardiovasc Diabetol. 2023 Sep 2;22(1):235. doi: 10.1186/s12933-023-01970-w.
- Zhang Q, Deng Z, Li T, Chen K, Zeng Z. SGLT2 inhibitor improves the prognosis of patients with coronary heart disease and prevents in-stent restenosis. Front Cardiovasc Med. 2024;10:1280547. doi: 10.3389/FCVM.2023.1280547.
- Puar P, Hibino M, Mazer CD, Yan AT, Pandey AK, et al. Left ventricular mass predicts cardiac reverse remodelling in patients treated with empagliflozin. Cardiovasc Diabetol. 2023 Jun 28;22(1):152. doi: 10.1186/s12933-023-01849-w.
- Cosentino N, Trombara F, De Metrio M, Molinari C, Genovese S, et al. Cardiovascular Protection in Coronary Artery Disease: Mechanistic and Clinical Insights into SGLT2 Inhibitors and GLP-1 Receptor Agonists. Pharmaceuticals (Basel). 2025 Aug 14;18(8):1202. doi: 10.3390/ph18081202.
- Serhiyenko VA, Sehin VB, Serhiyenko LM, Serhiyenko AA. Post-traumatic stress disorder, metabolic syndrome, and chronic low-grade inflammation: A narrative review. Problemi Endocrinnoi Patologii. 2024 Mar 14;81(1):77-83. doi: 10.21856/j-PEP.2024.1.10.
- Karakasis P, Theofilis P, Vlachakis PK, Apostolos A, Milaras N, et al. SGLT2 inhibitors and cardiac fibrosis: A comprehensive review. Curr Probl Cardiol. 2025 Oct;50(10):103149. doi: 10.1016/j.cpcardiol.2025.103149.
- Koval SM, Yushko KO, Snihurska IO, Starchenko TG, Pankiv VI, et al. Relations of angiotensin-(1-7) with hemodynamic and cardiac structural and functional parameters in patients with hypertension and type 2 diabetes. Arterial Hypertension. 2019;23(3):183-189. doi: 10.5603/AH.a2019.0012.
- Albulushi A, Askari KM, Al-Abedi AM, Al-Kulaibi MA, Hasan MS, et al. Impact of SGLT2 inhibitors on myocardial fibrosis in diabetic HFpEF: a longitudinal study. Eur J Med Res. 2025 Jul 8;30(1):592. doi: 10.1186/s40001-025-02834-7.