Журнал «Боль. Суставы. Позвоночник» Том 15, №3, 2025
Вернуться к номеру
Мезенхімальні стовбурові клітини кісткового мозку в лікуванні пацієнтів з остеоартритом колінного суглоба
Авторы: Бур’янов О.А. (1) , Омельченко Т.М. (1) , Хіміон Л.В. (2) , Базаров М.О. (1) , Турчин О.А. (3) , Левицький Є.А. (1) , Соболевський Ю.Л. (1)
(1) - Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
(2) - Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
(3) - ДУ «Інститут травматології та ортопедії НАМН України», м. Київ, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Актуальність. Використання мезенхімальних стовбурових клітин (МСК) при ураженнях суглобів є надзвичайно дискусійним питанням через наявність численних невирішених проблем як у розумінні біологічних властивостей МСК, так і в аспекті їх практичного застосування. Метою дослідження було оцінити функціональні результати та клінічну ефективність застосування автологічних МСК, отриманих з кісткового мозку, при лікуванні пацієнтів з післятравматичним остеоартритом (ПТОА) колінного суглоба (КС) на ранніх стадіях протягом шестимісячного періоду спостереження. Матеріали та методи. Проліковано 28 пацієнтів з ПТОА колінного суглоба I–II стадії за Kellgren-Lawrence. Серед них 11 (39,0 %) чоловіків і 17 (61,0 %) жінок, середній вік — 44,80 ± 10,95 року. Середній термін після отриманої травми становив 7,8 ± 0,5 року. Забір МСК проводили з крила клубової кістки та культивували їх в умовах біотехнологічної лабораторії. Внутрішньосуглобове введення виконували при загостренні ПТОА одноразово (50 млн клітин). Ефективність оцінювали через 6 міс. Критерії оцінки: потреба в нестероїдних протизапальних препаратах (НПЗП), кількість загострень ПТОА; функціональний стан суглоба за шкалами Лісхольма і WOMAC. Больовий синдром оцінювали за візуальною аналоговою шкалою (ВАШ), якість життя — за шкалою 36-Item Short Form Survey (SF-36). Результати. Через 6 міс. після застосування МСК отримано позитивну динаміку за всіма категоріями оцінювання стану КС: біль за ВАШ зменшився до 2,2 ± 0,3 бала (р < 0,05); функціональна активність за шкалою Лісхольма зросла на 29,4 % (р < 0,01), загальний індекс WOMAC зменшився на 51,7 % (р < 0,01); показник якості життя (за шкалою SF-36) зріс на 57,7 ± 9,3 % (р < 0,01). Крім того, протягом наступного після застосування МСК 6-місячного періоду клінічного спостереження продемонстровано істотне зниження частоти загострень ПТОА порівняно з попереднім 6-місячним періодом і зменшення потреби в застосуванні НПЗП. Висновки. МСК є ефективним і безпечним методом лікування ПТОА КС на ранніх стадіях, супроводжується вірогідним зменшенням показників больового синдрому, покращанням функції суглоба та якості життя, а також зменшенням кількості загострень ПТОА та потреби у використанні НПЗП щонайменше протягом 6 місяців.
Background. The use of mesenchymal stem cells (MSCs) in joint lesions is an extremely controversial issue due to the presence of numerous unresolved problems both in understanding the biological properties of MSCs and in terms of their practical application. The purpose of the study was to evaluate the functional results and clinical efficacy of using autologous MSCs obtained from bone marrow in the treatment of patients with post-traumatic osteoarthritis (PTOA) of the knee joint (KS) in the early stages, during a six-month observation period. Materials and methods. 28 patients with PTOA of the knee joint of stage I–II according to Kellgren-Lawrence were treated. Among them, 11 (39.0 %) were men and 17 (61.0 %) were women, the average age was 44.80 ± 10.95 years. The average period after the injury was 7.8 ± 0.5 years. MSCs were harvested from the iliac wing and cultured in a biotechnology laboratory. Intra-articular injection was performed once during exacerbation of PTOA (50 million cells). Efficacy was assessed after 6 months. Evaluation criteria: need for NSAIDs, number of exacerbations of PTOA; functional status of the joint according to Lisholm and WOMAC. Pain syndrome was assessed using the visual analog scale (VAS), quality of life according to the 36-Item Short Form Survey (SF-36) scale. Results. After 6 months after the use of MSC, positive dynamics were obtained in all categories of assessment of the functional status of the knee joint: pain according to VAS decreased to 2.2 ± 0.3 (p < 0.05); functional activity according to the Lisholm scale increased by 29.4 % (p < 0.01), the total WOMAC index decreased by 51.7 % (p < 0.01); the quality of life index increased by 57.7 ± 9.3 % when assessed using SF-36 (p < 0.01). In addition, during the 6-month clinical observation period following the use of MSCs, a significant decrease in the frequency of exacerbations of PTOA compared to the previous 6-month period and a decrease in the need for NSAIDs were demonstrated. Conclusion. MSCs are an effective and safe method of treating PTOA of the knee in the early stages, accompanied by a significant decrease in pain syndrome indicators, improvement in joint function and quality of life, as well as a decrease in the number of PTOA exacerbations and the need for NSAIDs for at least 6 months.
остеоартрит; хондральні пошкодження; мезенхімальні стовбурові клітини; регенеративна медицина
osteoarthritis; chondral damage; mesenchymal stem cells; regenerative medicine
Вступ
Матеріали та методи
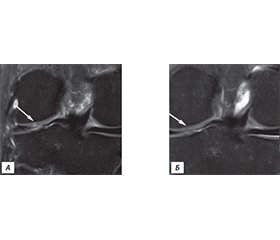
Результати
/36.jpg)
Обговорення
Висновки
- GBD 2021 Osteoarthritis Collaborators. Global, regional, and national burden of osteoarthritis, 1990-2020 and projections to 2050: a systematic analysis for the Global Burden of Disease Study 2021. Lancet Rheumatol. 2023 Aug 21;5(9):e508-e522. doi: 10.1016/S2665-9913(23)00163-7.
- Dilley JE, Bello MA, Roman N, McKinley T, Sankar U. Post-traumatic osteoarthritis: A review of pathogenic mechanisms and novel targets for mitigation. Bone Rep. 2023 Jan 30;18:101658. doi: 10.1016/j.bonr.2023.101658.
- Buryanov OA, Omelchenko TM. Treatment of osteoarthritis within the framework of evidence-based medicine. Zdorov’ja Ukrai'ny. Hirurgija, Ortopedija, Travmatologija, Intensyvna Terapija. 2011;2:12-14. Ukrainian.
- Burianov O, Omelchenko T, Levytskyi Y. Surgical techniques for the articular cartilage repair: literature review and meta-analysis. Orthopaedics, traumatology and prosthetics. 2023 Aug;(3-4):126-137. doi: 10.15674/0030-598720223-4126-137.
- Avila-Portillo LM, Aristizabal F, Riveros A, Abba MC, Correa D. Modulation of Adipose-Derived Mesenchymal Stem/Stromal Cell Transcriptome by G-CSF Stimulation. Stem Cells Int. 2020 Feb 15;2020:5045124. doi: 10.1155/2020/5045124.
- Schiavone Panni A, Vasso M, Braile A, et al. Preliminary results of autologous adipose-derived stem cells in early knee osteoarthritis: identification of a subpopulation with greater response. Int Orthop. 2019 Jan;43(1):7-13. doi: 10.1007/s00264-018-4182-6.
- Vezzani B, Shaw I, Lesme H, et al. Higher Pericyte Content and Secretory Activity of Microfragmented Human Adipose Tissue Compared to Enzymatically Derived Stromal Vascular Fraction. Stem Cells Transl Med. 2018 Dec;7(12):876-886. doi: 10.1002/sctm.18-0051.
- Mohamed-Ahmed S, Fristad I, Lie SA, et al. Adipose-derived and bone marrow mesenchymal stem cells: a donor-matched comparison. Stem Cell Res Ther. 2018 Jun 19;9(1):168. doi: 10.1186/s13287-018-0914-1.
- Yamatani Y, Nakai K. Comprehensive comparison of gene expression diversity among a variety of human stem cells. NAR Genom Bioinform. 2022 Nov 29;4(4):lqac087. doi: 10.1093/nargab/lqac087.
- He Q, Ye Z, Zhou Y, Tan WS. Comparative study of mesenchymal stem cells from rat bone marrow and adipose tissue. Turk J Biol. 2018 Dec 10;42:477-489. doi: 10.3906/biy-1802-52.
- Freitag J, Bates D, Wickham J, et al. Adipose-derived mesenchymal stem cell therapy in the treatment of knee osteoarthritis: a randomized controlled trial. Regen Med. 2019 Mar;14(3):213-230. doi: 10.2217/rme-2018-0161.
- Lee WS, Kim HJ, Kim KI, Kim GB, Jin W. Intra-Articular Injection of Autologous Adipose Tissue-Derived Mesenchymal Stem Cells for the Treatment of Knee Osteoarthritis: A Phase IIb, Randomized, Placebo-Controlled Clinical Trial. Stem Cells Transl Med. 2019 Jun;8(6):504-511. doi: 10.1002/sctm.18-0122.
- Matas J, Orrego M, Amenabar D, et al. Umbilical Cord-Derived Mesenchymal Stromal Cells (MSCs) for Knee Osteoarthritis: Repeated MSC Dosing Is Superior to a Single MSC Dose and to Hyaluronic Acid in a Controlled Randomized Phase I/II Trial. Stem Cells Transl Med. 2019 Mar;8(3):215-224. doi: 10.1002/sctm.18-0053.
- Orozco L, Munar A, Soler R, et al. Treatment of knee osteoarthritis with autologous mesenchymal stem cells: two-year follow-up results. Transplantation. 2014 Jun 15;97(11):e66-e68. doi: 10.1097/TP.0000000000000167.
- Chahal J, Gómez-Aristizábal A, Shestopaloff K, et al. Bone Marrow Mesenchymal Stromal Cell Treatment in Patients with Osteoarthritis Results in Overall Improvement in Pain and Symptoms and Reduces Synovial Inflammation. Stem Cells Transl Med. 2019 Aug;8(8):746-757. doi: 10.1002/sctm.18-0183.
- Vega A, Martín-Ferrero MA, Del Canto F, et al. Treatment of Knee Osteoarthritis With Allogeneic Bone Marrow Mesenchymal Stem Cells: A Randomized Controlled Trial. Transplantation. 2015 Aug;99(8):1681-1690. doi: 10.1097/TP.0000000000000678.
- Lamo-Espinosa JM, Mora G, Blanco JF, et al. Intra-articular injection of two different doses of autologous bone marrow mesenchymal stem cells versus hyaluronic acid in the treatment of knee osteoarthritis: long-term follow up of a multicenter randomized controlled clinical trial (phase I/II). J Transl Med. 2018 Jul 31;16(1):213. doi: 10.1186/s12967-018-1591-7.
- Khalifeh Soltani S, Forogh B, Ahmadbeigi N, et al. Safety and efficacy of allogenic placental mesenchymal stem cells for treating knee osteoarthritis: a pilot study. Cytotherapy. 2019 Jan;21(1):54-63. doi: 10.1016/j.jcyt.2018.11.003.
- Soler R, Orozco L, Munar A, et al. Final results of a phase I-II trial using ex vivo expanded autologous Mesenchymal Stromal Cells for the treatment of osteoarthritis of the knee confirming safety and suggesting cartilage regeneration. Knee. 2016 Aug;23(4):647-654. doi: 10.1016/j.knee.2015.08.013.
- Wong KL, Lee KB, Tai BC, Law P, Lee EH, Hui JH. Injectable cultured bone marrow-derived mesenchymal stem cells in varus knees with cartilage defects undergoing high tibial osteotomy: a prospective, randomized controlled clinical trial with 2 years' follow-up. Arthroscopy. 2013 Dec;29(12):2020-2028. doi: 10.1016/j.arthro.2013.09.074.
- Park YB, Ha CW, Lee CH, Yoon YC, Park YG. Cartilage Regeneration in Osteoarthritic Patients by a Composite of Allogeneic Umbilical Cord Blood-Derived Mesenchymal Stem Cells and Hyaluronate Hydrogel: Results from a Clinical Trial for Safety and Proof-of-Concept with 7 Years of Extended Follow-Up. Stem Cells Transl Med. 2017 Feb;6(2):613-621. doi: 10.5966/sctm.2016-0157.
- Dilogo IH, Canintika AF, Hanitya AL, Pawitan JA, Liem IK, Pandelaki J. Umbilical cord-derived mesenchymal stem cells for treating osteoarthritis of the knee: a single-arm, open-label study. Eur J Orthop Surg Traumatol. 2020 Jul;30(5):799-807. doi: 10.1007/s00590-020-02630-5.
- Al-Najar M, Khalil H, Al-Ajlouni J, et al. Intra-articular injection of expanded autologous bone marrow mesenchymal cells in moderate and severe knee osteoarthritis is safe: a phase I/II study. J Orthop Surg Res. 2017 Dec 12;12(1):190. doi: 10.1186/s13018-017-0689-6.
- Song Y, Du H, Dai C, et al. Human adipose-derived mesenchymal stem cells for osteoarthritis: a pilot study with long-term follow-up and repeated injections. Regen Med. 2018 Apr;13(3):295-307. doi: 10.2217/rme-2017-0152.
- Murphy JM, Fink DJ, Hunziker EB, Barry FP. Stem cell therapy in a caprine model of osteoarthritis. Arthritis Rheum. 2003 Dec;48(12):3464-3474. doi: 10.1002/art.11365.

/35.jpg)
/36_2.jpg)