Журнал «Боль. Суставы. Позвоночник» Том 15, №3, 2025
Вернуться к номеру
Функціональна активність тромбоцитів і тромбоцитарно-лейкоцитарна взаємодія при ревматоїдному артриті: зв’язок із субклінічним ураженням серця
Авторы: Узун К.С. (1) , Мальчевська Т.Й. (1) , Третяк І.В. (2) , Гнилорибов А.М. (3)
(1) - Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
(2) - ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини ім. акад. М.Д. Стражеска НАМН України», м. Київ, Україна
(3) - Національний інститут серцево-судинної хірургії імені М.М. Амосова НАМН України, м. Київ, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
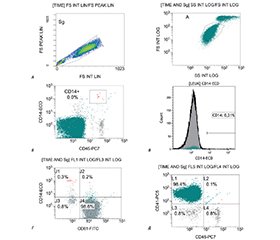
Активація тромбоцитів відіграє ключову роль у патогенезі ревматоїдного артриту (РА) та пов’язаних із ним серцево-судинних ускладнень. Вивчення функціональної активності тромбоцитів і тромбоцитарно-лейкоцитарних комплексів (ТЛК) може надати нову інформацію щодо механізмів субклінічного ураження серця при РА. Мета: oцінити активацію тромбоцитів і ТЛК у хворих на РА, дослідити їхній зв’язок із клінічною активністю захворювання та кардіальною дисфункцією, а також порівняти ці показники у пацієнтів з ішемічною хворобою серця (ІХС) і у здорових осіб. Обстежено 124 особи: 57 з РА, 55 з ІХС і 12 здорових. Методами проточної цитофлуориметрії визначали CD41+/CD62p+, CD14+/CD41+, CD45+/CD41+. Усім обстеженим проводили ехокардіографію, спекл-трекінг ехокардіографію (STE), визначали модифікований індекс DAS28 (Disease Activity Score), С-реактивний протеїн (CRP), ревматоїдний фактор (РФ), антицитрулінові антитіла (ACPA), N-кінцевий фрагмент прогормону мозкового натрійуретичного пептиду (NT-proBNP). У хворих на РА виявлено вірогідно нижчі рівні CD41+/CD62p+ (0,3 проти 1,0 % за ІХС; p = 0,002) та CD45+/CD41+ (p < 0,01), що свідчить про порушення активації тромбоцитів і взаємодії з нейтрофілами. CD14+/CD41+ залишалися стабільними. Встановлено кореляції між CD41+/CD62p+ і DAS28, CRP, РФ, GLS, NT-proBNP (r = 0,32–0,48) та обернено пропорційно до GLS (r = –0,45). Подібні кореляції були виявлені для CD14+/CD41+ та CD45+/CD41+, що вказує на їхню роль у діастолічній дисфункції та порушеннях міокардіального деформаційного тиску. Регресійний аналіз показав, що комплекс CD41+/CD62p+ був незалежним предиктором підвищеного NT-proBNP (β = 0,43; p = 0,01), а CD14+/CD41+ був пов’язаний зі зниженим рівнем глюкози в міокарді (β = 0,36; p = 0,02). Ці асоціації були відсутні при ІХС. При РА було виявлено чіткий характер порушення функції міокарда, що переважно вражає базальні сегменти. Зниження активації тромбоцитів і ТЛК характерне для РА, асоційованого із субклінічним ураженням серця. Ці показники можуть мати діагностичне та прогностичне значення й використовуватися у кардіологічному моніторингу пацієнтів з РА.
Platelet activation plays a crucial role in the pathogenesis of rheumatoid arthritis (RA) and its associated cardiovascular complications. Assessing platelet functional activity and platelet-leukocyte complexes (PLCs) may help elucidate mechanisms of subclinical myocardial involvement in RA. The purpose was to evaluate platelet activation and PLCs in RA patients and investigate their relationship with disease activity and cardiac dysfunction compared to patients with ischemic heart disease (IHD) and healthy controls. A total of 124 subjects were examined: 57 with RA, 55 with IHD, and 12 healthy subjects. Flow cytometry was used to assess CD41+/CD62p+ platelets, CD14+/CD41+ (platelet — monocyte), and CD45+/CD41+ (platelet — neutrophil) aggregates. Echocardiography, speckle-tracking echocardiography (STE), Modified DAS28 (Disease Activity Score), C-reactive protein (CRP), Rheumatoid factor (RF), Anti-citrullinated protein antibodies (ACPA), and N-terminal pro-brain natriuretic peptide (NT-proBNP) were evaluated. RA patients exhibited significantly reduced CD41+/CD62p+ levels (0.3 % vs. 1.0 % in IHD; p = 0.002) and lower CD45+/CD41+ aggregates (p < 0.01), suggesting impaired platelet activation and interaction with neutrophils. CD14+/CD41+ levels remained stable. CD41+/CD62p+ levels positively correlated with DAS28, CRP, RF, NT-proBNP (r = 0.32–0.48), and inversely with GLS (r = –0.45). Similar correlations were found for CD14+/CD41+ and CD45+/CD41+, indicating their role in diastolic dysfunction and myocardial strain abnormalities. Regression analysis revealed that CD41+/CD62p+ was an independent predictor of elevated NT-proBNP (β = 0.43; p = 0.01), and CD14+/CD41+ was linked to reduced GLS (β = 0.36; p = 0.02). These associations were absent in IHD. A distinct myocardial impairment pattern was identified in RA, predominantly affecting basal segments. Impaired platelet activation and altered PLCs are characteristic of RA and associated with subclinical myocardial dysfunction. These parameters may serve as early prognostic markers of cardiovascular risk in RA and support the development of personalized monitoring strategies.
ревматоїдний артрит; тромбоцити; активація тромбоцитів; проточна цитофлуориметрія; діастолічна дисфункція; спекл-трекінг ехокардіографія
rheumatoid arthritis; platelets; platelet activation; flow cytometry; diastolic dysfunction; speckle-tracking echocardiography
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Boilard E, Nigrovic PA, Larabee K, et al. Platelets amplify inflammation in arthritis via collagen-dependent microparticle production. Science. 2010 Jan 29;327(5965):580-583. doi: 10.1126/science.1181928.
- Habets KL, Huizinga TW, Toes RE. Platelets and autoimmunity. Eur J Clin Invest. 2013 Jul;43(7):746-757. doi: 10.1111/eci.12101.
- Ronda N, Favari E, Borghi MO, et al. Platelet activation and platelet-monocyte aggregate formation trigger tissue factor expression in patients with systemic autoimmune diseases. J Autoimmun. 2013;47:45-52. doi:10.1016/j.jaut.2013.08.005.
- Goel R, Kaplan D, Laskin DL. Critical Role of Platelets in the Pathogenesis of Systemic Inflammation in Rheumatoid Arthritis. J Immunol Res. 2020;2020:3458930. doi: 10.1155/2020/3458930.
- Gasparyan AY, Ayvazyan L, Pretorius E, Kitas GD. Platelets in rheumatic diseases: friend or foe? Curr Pharm Des. 2014;20(4):552-566. doi: 10.2174/138161282004140213143843.
- Łukasik ZM, Makowski M, Makowska JS. From blood coagulation to innate and adaptive immunity: the role of platelets in the physiology and pathology of autoimmune disorders. Rheumatol Int. 2018 Jun;38(6):959-974. doi: 10.1007/s00296-018-4001-9.
- Aatonen M, Grönholm M, Siljander PR. Platelet-derived microvesicles: multitalented participants in intercellular communication. Semin Thromb Hemost. 2012 Feb;38(1):102-113. doi: 10.1055/s-0031-1300956.
- Zhu L, Huang Z, Stålesen R, Hansson GK, Li N. Platelets provoke distinct dynamics of immune responses by differentially regulating CD4+ T-cell proliferation. J Thromb Haemost. 2014 Jul;12(7):1156-1165. doi: 10.1111/jth.12612.
- Guo H, Wang Y, Zhao Z, Shao X. Platelet factor 4 limits Th17 differentiation and ischaemia-reperfusion injury after liver transplantation in mice. Scand J Immunol. 2015 Feb;81(2):129-134. doi: 10.1111/sji.12257.
- Jenabian MA, Patel M, Kema I, et al. Soluble CD40-ligand (sCD40L, sCD154) plays an immunosuppressive role via regulatory T cell expansion in HIV infection. Clin Exp Immunol. 2014 Oct;178(1):102-111. doi: 10.1111/cei.12396.
- Dinkla S, van Cranenbroek B, van der Heijden WA, et al. Platelet microparticles inhibit IL-17 production by regulatory T cells through P-selectin. Blood. 2016 Apr 21;127(16):1976-1986. doi: 10.1182/blood-2015-04-640300.
- Simon DI, Chen Z, Xu H, et al. Platelet glycoprotein ibalpha is a counterreceptor for the leukocyte integrin Mac-1 (CD11b/CD18). J Exp Med. 2000 Jul 17;192(2):193-204. doi: 10.1084/jem.192.2.193.
- Starossom SC, Veremeyko T, Yung AW, et al. Platelets Play Differential Role During the Initiation and Progression of Autoimmune Neuroinflammation. Circ Res. 2015 Oct 9;117(9):779-792. doi: 10.1161/CIRCRESAHA.115.306847.
- Boilard E, Blanco P, Nigrovic PA. Platelets: active players in the pathogenesis of arthritis and SLE. Nat Rev Rheumatol. 2012 Aug;8:534-542. doi: 10.1038/nrrheum.2012.118.
- Zhang Y, Ehrlich SM, Zhu C, Du X. Signaling mechanisms of the platelet glycoprotein Ib-IX complex. Platelets. 2022 Aug 18;33(6):823-832. doi: 10.1080/09537104.2022.2071852.
- Schmitt-Sody M, Metz P, Gottschalk O, et al. Platelet P-selectin is significantly involved in leukocyte-endothelial cell interaction in murine antigen-induced arthritis. Platelets. 2007 Aug;18(5):365-372. doi: 10.1080/09537100701191315.
- Eriksson AC, Jonasson L, Lindahl TL, Hedbäck B, Whiss PA. Static platelet adhesion, flow cytometry and serum TXB2 levels for monitoring platelet inhibiting treatment with ASA and clopidogrel in coronary artery disease: a randomised cross-over study. J Transl Med. 2009 Jun 9;7:42. doi: 10.1186/1479-5876-7-42.
- Pamuk GE, Vural O, Turgut B, Demir M, Pamuk ON, Cakir N. Increased platelet activation markers in rheumatoid arthritis: are they related with subclinical atherosclerosis? Platelets. 2008 Mar;19(2):146-154. doi: 10.1080/09537100701210057.
- Koupenova M, Vitseva O, MacKay CR, et al. Platelet-TLR7 mediates host survival and platelet count during viral infection in the absence of platelet-dependent thrombosis. Blood. 2014 Jul 31;124(5):791-802. doi: 10.1182/blood-2013-11-536003.
- Widlansky ME, Gokce N, Keaney JF Jr, Vita JA. The clinical implications of endothelial dysfunction. J Am Coll Cardiol. 2003 Oct 1;42(7):1149-1160. doi: 10.1016/s0735-1097(03)00994-x.
- Gasparyan AY, Stavropoulos-Kalinoglou A, Mikhailidis DP, Douglas KM, Kitas GD. Platelet function in rheumatoid arthritis: arthritic and cardiovascular implications. Rheumatol Int. 2011 Feb;31(2):153-164. doi: 10.1007/s00296-010-1446-x.
- Zamora C, Cantó E, Nieto JC, et al. Binding of Platelets to Lymphocytes: A Potential Anti-Inflammatory Therapy in Rheumatoid Arthritis. J Immunol. 2017 Apr 15;198(8):3099-3108. doi: 10.4049/jimmunol.1601708.
- Smiseth OA, Morris DA, Cardim N, et al.; Reviewers: This document was reviewed by members of the 2018–2020 EACVI Scientific Documents Committee. Multimodality imaging in patients with heart failure and preserved ejection fraction: an expert consensus document of the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2022 Jan 24;23(2):e34-e61. doi: 10.1093/ehjci/jeab154.
- Rudski LG, Lai WW, Afilalo J, et al. Guidelines for the echocardiographic assessment of the right heart in adults: a report from the American Society of Echocardiography endorsed by the European Association of Echocardiography, a registered branch of the European Society of Cardiology, and the Canadian Society of Echocardiography. J Am Soc Echocardiogr. 2010 Jul;23(7):685-713; quiz 786-788. doi: 10.1016/j.echo.2010.05.010.
- Prevoo ML, van 't Hof MA, Kuper HH, van Leeuwen MA, van de Putte LB, van Riel PL. Modified disease activity scores that include twenty-eight-joint counts. Development and validation in a prospective longitudinal study of patients with rheumatoid arthritis. Arthritis Rheum. 1995 Jan;38(1):44-48. doi: 10.1002/art.1780380107.
- World Health Organization (WHO). WHO Laboratory Manual for the Examination and Processing of Human Blood Specimens Using Flow Cytometry. 2nd ed. Geneva: World Health Organization; 2021.