Международный эндокринологический журнал Том 21, №5, 2025
Вернуться к номеру
С-реактивний протеїн як можливий прогностичний фактор прогресування діабетичної ретинопатії
Авторы: Сердюк А.В. (1), Могілевський С.Ю. (2), Зябліцев С.В. (3)
(1) - Дніпровський державний медичний університет, м. Дніпро, Україна
(2) - Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
(3) - Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
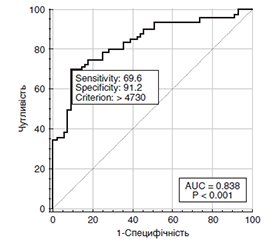
Актуальність. Сучасні дані показують важливу роль С-реактивного протеїну (СРП) у виникненні та прогресуванні діабетичної ретинопатії (ДР), що спонукало вивчення можливості застосування його вмісту у сироватці крові як можливого фактора виникнення та прогресування ДР. Мета: встановити вміст СРП при різних стадіях ДР та можливість його використання як прогностичного фактора її прогресування. Матеріали та методи. Обстежено 136 пацієнтів з цукровим діабетом 2-го типу, яких розподілили на групи: перша — з непроліферативною ДР (НПДР, 60 очей), друга — з препроліферативною ДР (ППДР, 42 ока) та третя — з проліферативною ДР (ПДР, 34 ока). Проведено обстеження та лікування пацієнтів протягом двох років. У сироватці крові проводили визначення високочутливого СРП (вч-СРП) імуноферментним методом. Вміст вч-СРП виражали у мікрограмах/літр. Аналіз результатів дослідження проводився в пакеті EZR v.1.54 (Австрія). Результати. У пацієнтів з ЦД 2-го типу та ДР встановлено значне збільшення вмісту вч-СРП у сироватці крові порівняно з особами без ЦД. При НПДР він перевищував контрольний рівень у 1,9 раза, при ППДР — у 3,2 раза, при ПДР — у 4,9 раза (p < 0,001 для всіх порівнянь). Вибір оптимальних порогів багатокласової класифікації методом One-vs-All з побудовою ROC-кривих визначив межові рівні вч-СРП при різних стадіях ДР. Значення, менші за 1977 мкг/л, були характерні для контрольної групи. У пацієнтів з НПДР значення становили від 1978 до 3683,5 мкг/л, при ППДР — від 3683,6 до 5523 мкг/л і при ПДР — більше 5523 мкг/л. Вміст вч-СРП прямо корелював з глікемією натще (r = 0,194), центральними товщиною (r = 0,517) та об’ємом сітківки (r = 0,486), вмістом глікованого гемоглобіну (r = 0,774), загального холестерину (r = 0,385), ліпопротеїнів високої (r = 0,260), низької (r = 0,361) та дуже низької щільності (r = 0,493), а також тригліцеридів (r = 0,374). Ризик прогресування ДР через 2 роки спостереження збільшувався у 2,3 раза на кожні 1000 мкг/л збільшення вмісту в крові вч-СРП (р < 0,001; ВШ = 2,33; 95% ВІ 1,74–3,14). Площа під кривою операційних характеристик прогнозу AUC = 0,84 (95% ВІ 0,77–0,90), чутливість моделі становила 69,6 % (95% ВІ 60,7–81,8), специфічність — 91,2 % (95% ВІ 83,7–97,4%). Висновки. Отримані результати обґрунтовують можливість застосування показника С-реактивного протеїну як високоінформативного біомаркера для діагностики стадії ДР та прогнозу її прогресування.
Background. Current data show an important role of C-reactive protein (CRP) in the onset and progression of diabetic retinopathy (DR), which necessitated the study of using its serum content as a possible contributing factor. Aim of the study was to determine the content of CRP at different stages of DR and the possibility of using it as a prognostic factor of its progression. Materials and methods. 136 patients with type 2 diabetes mellitus were examined and divided into groups: first — with non-proliferative DR (NPDR; 60 eyes), second — with preproliferative DR (PPDR; 42 eyes) and third — with proliferative DR (PDR; 34 eyes). Patients were examined and treated for 2 years. Serum content (in μg/l) of high-sensitivity (hs) CRP was determined by the enzyme-linked immunosorbent assay. The analysis of the study results was performed in the EZR v.1.54 package (Austria). Results. Patients with type 2 diabetes and DR reported a significant increase in serum hs-CRP compared to individuals without diabetes. In NPDR, it exceeded the control level by 1.9 times, in PPDR — by 3.2 times, in PDR — by 4.9 times (p < 0.001 for all comparisons). The selection of optimal thresholds for multi-class classification by the One-vs-All method with the construction of receiver operating characteristic (ROC) curves determined the cut-off levels of hs-CRP at different stages of DR. Values less than 1977 μg/l were characteristic of the control group. In patients with NPDR, the indicators ranged from 1978 to 3683.5 μg/l, in PPDR — from 3683.6 to 5523 μg/l, and in PDR, they were more than 5523 μg/l. The content of hs-CRP directly correlated with fasting glycemia (r = 0.194), central retinal thickness (r = 0.517) and volume (r = 0.486), glycated hemoglobin (r = 0.774), total cholesterol (r = 0.385), high-density lipoprotein (r = 0.260), low-density lipoprotein (r = 0.361), and very low-density lipoprotein (r = 0.493), as well as triglycerides (r = 0.374). The risk of DR progression after 2 years of observation increased 2.3 times for every 1000 μg/l increase in the hs-CRP blood content (p < 0.001; odds ratio = 2.33; 95% confidence interval (CI) 1.74–3.14). The area under the ROC curve was 0.84 (95% CI 0.77–0.90), the sensitivity of the model was 69.6 % (95% CI 60.7–81.8), specificity — 91.2 % (95% CI 83.7–97.4). Conclusions. The results obtained justify the possibility of using C-reactive protein as a highly informative biomarker for diagnosing the stage of DR and predicting its progression.
цукровий діабет 2-го типу; діабетична ретинопатія; прогноз; моделювання; високочутливий С-реактивний протеїн; біомаркери
type 2 diabetes mellitus; diabetic retinopathy; prognosis; modeling; high-sensitivity C-reactive protein; biomarkers
Абревіатури
Вступ
Матеріал та методи
Результати
/30_2.jpg)
/31.jpg)
Обговорення
/32_2.jpg)
Висновки
- Schiborn C, Schulze MB. Precision prognostics for the development of complications in diabetes. Diabetologia. 2022;65(11):1867-1882. doi: 10.1007/s00125-022-05731-4.
- Dai L, Wu L, Li H, et al. A deep learning system for detecting diabetic retinopathy across the disease spectrum. Nat Commun. 2021;12(1):3242. doi: 10.1038/s41467-021-23458-5.
- Ghamdi AHA. Clinical predictors of diabetic retinopathy progression; A systematic review. Curr Diabetes Rev. 2020;16(3):242-247. doi: 10.2174/1573399815666190215120435.
- Serdiuk AV. Glycated hemoglobin as a prognostic factor for the progression of non-proliferative diabetic retinopathy in type 2 diabetes. Archives of Ophthalmology of Ukraine. 2024;2(12):26-30. [Ukrainian] https://doi.org/10.22141/2309-8147.12.2.2024.377.
- Bhutia CU, Kaur P, Singh K, Kaur S. Evaluating peripheral blood inflammatory and metabolic biomarkers as predictors in diabetic retinopathy and diabetic macular edema. Indian J Ophthalmol. 2023 Jun;71(6):2521-2525. doi: 10.4103/IJO.IJO_345_23.
- Sproston NR, Ashworth JJ. Role of C-Reactive Protein at Sites of Inflammation and Infection. Front Immunol. 2018 Apr 13;9:754. doi: 10.3389/fimmu.2018.00754.
- Ansar W, Ghosh S. C-reactive protein and the biology of disease. Immunol Res. 2013 May;56(1):131-42. doi: 10.1007/s12026-013-8384-0.
- Pohanka M. Diagnoses Based on C-Reactive Protein Point-of-Care Tests. Biosensors (Basel). 2022 May 17;12(5):344. doi: 10.3390/bios12050344.
- Mehta A, Blumenthal RS, Gluckman TJ, Feldman DI, Kohli P. High-sensitivity C-reactive Protein in Atherosclerotic Cardiovascular Disease: To Measure or Not to Measure? US Cardiol. 2025 Mar 21;19:e06. doi: 10.15420/usc.2024.25. PMID: 40171210; PMCID: PMC11959579.
- Song J, Chen S, Liu X, Duan H, Kong J, Li Z. Relationship between C-Reactive Protein Level and Diabetic Retinopathy: A Systematic Review and Meta-Analysis. PLoS One. 2015 Dec 4;10(12):e0144406. doi: 10.1371/journal.pone.0144406.
- Gameil MA, Elsherbiny HA, Youssry IE, Gawad SA, Arafat AAE. Potential impact of epicardial fat thickness, pentraxin-3, and high-sensitive C-reactive protein on the risk of non-proliferative diabe–tic retinopathy. J Diabetes Metab Disord. 2023 Feb 22;22(1):735-742. doi: 10.1007/s40200-023-01195-4.
- Mathala N, Akula A, Hegde S, Bitra R, Sachedev V. Assessment of Circulating Biomarkers in Relation to Various Stages of Diabetic Retinopathy in Type 2 Diabetic Patients — A Cross Sectional Study. Curr Diabetes Rev. 2020;16(4):402-409. doi: 10.2174/1573399815666190823155534.
- Jeong Y, Lee BJ, Hur W, Lee M, Han SH. Associations of Insulin Resistance and High-Sensitivity C-Reactive Protein with Metabolic Abnormalities in Korean Patients with Type 2 Diabetes Mellitus: A Preliminary Study. Metabolites. 2024 Jun 30;14(7):371. doi: 10.3390/metabo14070371.
- Aryan Z, Ghajar A, Faghihi-Kashani S, Afarideh M, Nakhjavani M, Esteghamati A. Baseline High-Sensitivity C-Reactive Protein Predicts Macrovascular and Microvascular Complications of Type 2 Diabetes: A Population-Based Study. Ann Nutr Metab. 2018;72(4):287-295. doi: 10.1159/000488537.
- Kanda Y. Investigation of the freely available easy-to-use software ‘EZR’ for medical statistics. Bone Marrow Transplant. 2013 Mar;48(3):452-8. doi: 10.1038/bmt.2012.244. Epub 2012 Dec 3. PMID: 23208313; PMCID: PMC3590441.
- Pace-Loscos T, Gal J, Contu S, Schiappa R, Chamorey E, Culié D. StatiCAL: an interactive tool for statistical analysis of biome–dical data and scientific valorization. BMC Bioinformatics. 2024 Jun 12;25(1):210. doi: 10.1186/s12859-024-05829-z. PMID: 38867185; PMCID: PMC11167775.
- Ramírez J, Górriz JM, Ortiz A, Martínez-Murcia FJ, et al.; Alzheimer’s Disease Neuroimaging Initiative. Ensemble of random forests One vs. Rest classifiers for MCI and AD prediction using ANOVA cortical and subcortical feature selection and partial least squares. J Neurosci Methods. 2018 May 15;302:47-57. doi: 10.1016/j.jneumeth.2017.12.005. Epub 2017 Dec 11. PMID: 29242123.
- Robin X, Turck N, Hainard A, et al. pROC: an open-source package for R and S+ to analyze and compare ROC curves. BMC Bioinformatics. 2011;12:77. https://doi.org/10.1186/1471-2105-12-77.
- Mogilevskii SI, Serdiuk AV, Zyablitsev SV. Prognostic biomarkers of non-proliferative diabetic retinopathy progression in type 2 diabetes mellitus. J Ophthalmol (Ukraine). 2024;(4):38-45. https://doi.org/10.31288/oftalmolzh202443845.
- Serdiuk AV, Mogilevskyy SYu, Zyablitzev SV, Deni–siuk OYu. Effectiveness of treatment for different stages of diabetic retinopathy in type 2 diabetes. Mìžnarodnij endokrinologìčnij žurnal. 2024;7(20):491-498. [Ukrainian] https://doi.org/10.22141/2224-0721.20.7.2024.1447.
- Gupta R, Pamecha H. To Study Relationship of Serum hsCRP with Type 2 Diabetes Mellitus, its Vascular Complications and Non-Diabetics — Case Control Study. J Assoc Physicians India. 2020 Aug;68(8):25-29. PMID: 32738836.
- Zhang Y, Chen G, Wang W, Jing Y. C-reactive protein to high-density lipoprotein cholesterol ratio: an independent risk factor for diabetic retinopathy in type 2 diabetes patients. Front Nutr. 2025 Mar 4;12:1537707. doi: 10.3389/fnut.2025.1537707.
- Tao T, Liu K, Yang L, et al. Predicting diabetic retinopathy based on biomarkers: Classification and regression tree models. Diabetes Res Clin Pract. 2025 Apr;222:112091. doi: 10.1016/j.diabres.2025.112091.
- Khaloo P, Qahremani R, Rabizadeh S, et al. Nitric oxide and TNF-α are correlates of diabetic retinopathy independent of hs-CRP and HbA1c. Endocrine. 2020 Sep;69(3):536-541. doi: 10.1007/s12020-020-02353-x.
- Shi X, Yang M, Jiang X, et al. Correlation of MMP-2, TIMP-1, β2-MG and hs-CRP with the progression of retinopathy in patients with type 2 diabetes. Cell Mol Biol (Noisy-le-grand). 2023 Apr 30;69(4):147-151. doi: 10.14715/cmb/2023.69.4.23.
- Wei J, Zhang J, Shi Y, et al. Serum VEGF, high-sensitivity CRP, and cystatin-C assist in the diagnosis of type 2 diabetic retino–pathy complicated with hyperuricemia. Open Med (Wars). 2023 Dec 7;18(1):20230857. doi: 10.1515/med-2023-0857.
- Nalini M, Raghavulu BV, Annapurna A, et al. Correlation of various serum biomarkers with the severity of diabetic retinopathy. Diabetes Metab Syndr. 2017 Nov;11(Suppl 1):S451-S454. doi: 10.1016/j.dsx.2017.03.034.
- Tomić M, Vrabec R, Vidas Pauk S, et al. Systemic inflammation and dyslipidemia are associated with retinopathy in type 2 but not in type 1 diabetes. Scand J Clin Lab Invest. 2020 Oct;80(6):484-490. doi: 10.1080/00365513.2020.1789921.
- Chuengsamarn S, Rattanamongkolgul S, Sittithumcharee G, Jirawatnotai S. Association of serum high-sensitivity C-reactive protein with metabolic control and diabetic chronic vascular complications in patients with type 2 diabetes. Diabetes Metab Syndr. 2017 Apr — Jun;11(2):103-108. doi: 10.1016/j.dsx.2016.08.012.
- Jonas JB, Wei WB, Xu L, Wang YX. Systemic inflammation and eye diseases. The Beijing Eye Study. PLoS One. 2018 Oct 3;13(10):e0204263. doi: 10.1371/journal.pone.0204263.

/30.jpg)
/31_2.jpg)
/32.jpg)