Журнал «Почки» Том 14, №1, 2025
Вернуться к номеру
Синергічний вплив екстрактів леспедези та артишоку в терапії хронічного захворювання нирок: механізми та перспективи
Авторы: Серебровська З.О., Толстун Д.О., Сикало Н.В., Фархідінов І.О., Кропива В., Мигован С.А., Чижова В.П., Ковтонюк Т.І., Самоць І.А., Маньковський Б.М.
ДУ «Інститут геронтології ім. Д.Ф. Чеботарьова» НАМН України, м. Київ, Україна
Рубрики: Нефрология
Разделы: Справочник специалиста
Версия для печати
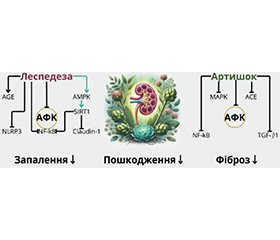
Хронічне захворювання нирок (ХЗН) є однією з провідних глобальних проблем охорони здоров’я, що супроводжується оксидативним стресом, запаленням і фіброзом. Традиційні фармакологічні підходи мають певні обмеження через побічні ефекти та недостатню ефективність на пізніх стадіях захворювання. У цьому дослідженні розглянуто потенціал комбінованого використання екстрактів леспедези (Lespedeza spp.) та артишоку (Cynara scolymus) у лікуванні ХЗН. Нефропротекторний ефект екстракту леспедези проявляється у зменшенні альбумінурії, азоту та креатиніну в сечі. Цей ефект забезпечується як прямим антиоксидантним впливом, що захищає мембранні структури, ДНК та мітохондрії, так і опосередкованим антизапальним впливом, зменшуючи активність NF-kB та інфламасом, вивільнення прозапальних цитокінів та хемокінів. Нефропротекторний ефект артишоку зумовлений пригніченням сигнального шляху Wnt/β-катеніну, що сприяє зменшенню фіброзу, а також зниженням рівня прозапальних цитокінів (IL-1β, IL-2, IL-6, TNF-α, NF-κB, TGF-β1), що запобігає прогресуванню хронічного запалення в нирках. Додатково артишок інгібує ангіотензинперетворюючий фермент, зменшуючи ниркову гіпертензію та захищаючи ниркову тканину від ушкоджень. Синергія впливу леспедези та артишоку може забезпечити багатофакторний захист нефронів, мінімізуючи запалення та гальмуючи прогресування фіброзу. Огляд літератури підтверджує перспективність такого підходу та необхідність подальших доклінічних і клінічних досліджень для визначення оптимальних схем застосування екстрактів у терапії ХЗН.
Chronic kidney disease (CKD) is a major global health issue associated with oxidative stress, inflammation, and fibrosis. Traditional pharmacological approaches have limitations due to side effects and insufficient efficacy in the late stages of the disease. This study explores the potential of combining Lespedeza (Lespedeza spp.) and artichoke (Cynara scolymus) extracts in CKD treatment. The nephroprotective effect of Lespedeza extract is manifested in the reduction of albuminuria, nitrogen, and creatinine levels in urine. This is achieved through both direct antioxidant action, protecting membrane structures, DNA, and mitochondria, and indirect anti-inflammatory action, reducing NF-κB and inflammasome activity, as well as the release of pro-inflammatory cytokines and chemokines. The nephroprotective effect of artichoke extract is primarily attributed to the inhibition of the Wnt/β-catenin signaling pathway, which reduces fibrosis, and the suppression of pro-inflammatory cytokines (IL-1β, IL-2, IL-6, TNF-α, NF-κB, TGF-β1), preventing the progression of chronic inflammation in the kidneys. Additionally, artichoke extract inhibits angiotensin-converting enzyme, reducing renal hypertension and protecting kidney tissue from damage. The synergistic effect of Lespedeza and artichoke extracts may provide multifactorial nephron protection, minimizing inflammation and slowing fibrosis progression. A literature review confirms the promise of this approach and highlights the necessity of further preclinical and clinical studies to determine optimal dosing regimens for CKD therapy.
нефропротекція; оксидативний стрес; запальний каскад; гіпоазотемічний ефект; фітотерапія; поліфенольні сполуки; огляд
nephroprotection; oxidative stress; inflammatory cascade; hypoazotemic effect; phytotherapy; polyphenolic compounds; review
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Hauwanga WN, Abdalhamed TY, Ezike LA, Chukwulebe IS, Ko Oo A, Wilfred A, et al. The Pathophysiology and Vascular Complications of Diabetes in Chronic Kidney Disease: A Comprehensive Review. Cureus. 2024 Dec 28;16(12):e76498. doi: 10.7759/cureus.76498. PMID: 39872596; PMCID: PMC11770394.
- Romagnani P, Agarwal R, Chan JCN, Levin A, Kalyesubula R, Karam S, et al. Chronic kidney disease. Nat Rev Dis Primers. 2025 Jan 30;11(1):8. doi: 10.1038/s41572-024-00589-9. PMID: 39885176.
- Hanaoka H, Aoki T, Kosaka T, Yoshinaga S, Shibata A, Sakai R, et al. Chronic kidney disease and inflammatory cytokines in rheumatoid arthritis: a potential pathogenic link. Immunol Med. 2025 Jan 31:1-10. doi: 10.1080/25785826.2025.2460267. Epub ahead of print. PMID: 39887000.
- Minutolo R, et al. Risk of ESRD and death in patients with CKD not referred to a nephrologist: a 7-year prospective study. Clin. J. Am. Soc. Nephrol. 2014;9(9):1586-1593. doi: 10.2215/CJN.10481013.
- Mazzieri A, Timio F, Patera F, Trepiccione F, Bonomini M, Reboldi G. Aldosterone Synthase Inhibitors for Cardiorenal Protection: Ready for Prime Time? Kidney Blood Press Res. 2024;49(1):1041-1056. doi: 10.1159/000542621. Epub 2024 Nov 18. PMID: 39557029.
- Rakotoarison A, Kepinska M, Konieczny A, Władyczak K, Janczak D, Hałoń A, et al. Endothelin Inhibitors in Chronic Kidney Disease: New Treatment Prospects. J Clin Med. 2024 Oct 11;13(20):6056. doi: 10.3390/jcm13206056.
- Зайченко Г., Кисличенко В., Процька В., Федосов А., Сімонов П. Перспективи застосування нефропротекторів рослинного походження на основі леспедези двоколірної. Сімейна медицина. Європейські практики. 2024;(2):55-61. https://doi.org/10.30841/2786-720X.2.2024.307535.
- Di Cerbo A, Iannitti T, Guidetti G, Centenaro S, Canello S, Cocco R. A nutraceutical diet based on Lespedeza spp., Vaccinium macrocarpon and Taraxacum officinale improves spontaneous feline chronic kidney disease. Physiol Rep. 2018 Jun;6(12):e13737. doi: 10.14814/phy2.13737. PMID: 29906338; PMCID: PMC6003637.
- Yarnell EL. Botanical medicines used for kidney disease in the United States. Iran J Kidney Dis. 2012 Nov;6(6):407-18. PMID: 23146977.
- Wang CY, Deng HZ, Li H. [Experimental study on treatment of minimal change nephropathy with Lespedeza michx]. Zhongguo Zhong Yao Za Zhi. 2005 Apr;30(8):614-7. Chinese. PMID: 16011289.
- Zhang R, Wang J, Wu C, Wang L, Liu P, Li P. Lipidomics-based natural products for chronic kidney disease treatment. Heliyon. 2025 Jan 2;11(1):e41620. doi: 10.1016/j.heliyon.2024.e41620. PMID: 39866478; PMCID: PMC11758422.
- Mitchell S, Vargas J. Signaling via the NFkappaB system. Wiley Interdiscip Rev. Syst. Biol. Med. 2016;8:227-241. doi: 10.1002/wsbm.1331.
- Ratliff BB, Abdulmahdi W, Pawar R, Wolin MS. Oxidant Mechanisms in Renal Injury and Disease. Antioxid. Redox Signal. 2016;25:119-146. doi: 10.1089/ars.2016.6665.
- Jha JC, Banal C, Chow BS, Cooper ME, Jandeleit-Dahm K. Diabetes and Kidney Disease: Role of Oxidative Stress. Antioxid. Redox Signal. 2016;25:657-684. doi: 10.1089/ars.2016.6664.
- DeWolf SE, Shigeoka AA, Scheinok AS, Kasimsetty G, Welch AK, McKay DB. Expression of TLR2, NOD1, and NOD2 and the NLRP3 Inflammasome in Renal Tubular Epithelial Cells of Male versus Female Mice. Nephron. 2017;137:68-76. doi: 10.1159/000456016.
- Kim S-M, Kim YG, Kim N-J, Park SH, Jeong K-H, Lee YH, et al. Inflammasome-Independent Role of NLRP3 Mediates Mitochondrial Regulation in Renal Injury. Front. Immunol. 2018;9:2563. doi: 10.3389/fimmu.2018.02563.
- Park HS, Lim JH, Kim MY, Kim Y, Hong YA, Choi SR, et al. Resveratrol increases AdipoR1 and AdipoR2 expression in type 2 diabetic nephropathy. J. Transl. Med. 2016;14:176. doi: 10.1186/s12967-016-0922-9.
- Zhou L, Xu D-Y, Sha W-G, Shen L, Lu G-Y, Yin X, et al. High glucose induces renal tubular epithelial injury via Sirt1/NF-kappaB/microR-29/Keap1 signal pathway. J. Transl. Med. 2015;13:352. doi: 10.1186/s12967-015-0710-y.
- Chou X, Ding F, Zhang X, Ding X, Gao H, Wu Q. Sirtuin-1 ameliorates cadmium-induced endoplasmic reticulum stress and pyroptosis through XBP-1s deacetylation in human renal tubular epithelial cells. Arch. Toxicol. 2019;93:965-986. doi: 10.1007/s00204-019-02415-8.
- Lee JH, Parveen A, Do MH, Lim Y, Shim SH, Kim SY. Lespedeza cuneata protects the endothelial dysfunction via eNOS phosphorylation of PI3K/Akt signaling pathway in HUVECs. Phytomedicine. 2018;48:1-9. doi: 10.1016/j.phymed.2018.05.005.
- Baek J, Lee TK, Song JH, Choi E, Ko HJ, Lee S, et al. Lignan Glycosides and Flavonoid Glycosides from the Aerial Portion of Lespedeza cuneata and Their Biological Evaluations. Molecules. 2018 Aug 1;23(8):1920. doi: 10.3390/molecules23081920. PMID: 30071639; PMCID: PMC6222362.
- Dyshlovoy SA, Tarbeeva D, Fedoreyev S, Busenbender T, Kaune M, Veselova M, et al. Polyphenolic Compounds from Lespedeza Bicolor Root Bark Inhibit Progression of Human Prostate Cancer Cells via Induction of Apoptosis and Cell Cycle Arrest. Biomo–lecules. 2020 Mar 14;10(3):451. doi: 10.3390/biom10030451. PMID: 32183314; PMCID: PMC7175281.
- Ruiz PA, Braune A, Hölzlwimmer G, Quintanilla-Fend L, Haller D. Quercetin inhibits TNF-induced NF-kappaB transcription factor recruitment to proinflammatory gene promoters in murine intestinal epithelial cells. J Nutr. 2007 May;137(5):1208-15. doi: 10.1093/jn/137.5.1208. PMID: 17449583.
- Joma N, Zhang I, Righetto GL, McKay L, Gran ER, Kakkar A, Maysinger D. Flavonoids Regulate Redox-Responsive Transcription Factors in Glioblastoma and Microglia. Cells. 2023 Dec 12;12(24):2821. doi: 10.3390/cells12242821. PMID: 38132142; PMCID: PMC10871111.
- Yao C, Xi C, Hu K, Gao W, Cai X, Qin J, et al. Inhibition of enterovirus 71 replication and viral 3C protease by quercetin. Virol J. 2018 Jul 31;15(1):116. doi: 10.1186/s12985-018-1023-6. PMID: 30064445; PMCID: PMC6069798.
- Bhattacharya K, Bordoloi R, Chanu NR, Kalita R, Sahariah BJ, Bhattacharjee A. In silico discovery of 3 novel quercetin derivatives against papain-like protease, spike protein, and 3C-like protease of SARS-CoV-2. J Genet Eng Biotechnol. 2022 Mar 9;20(1):43. doi: 10.1186/s43141-022-00314-7. PMID: 35262828; PMCID: PMC8905286.
- Zhang RM, Oh J, Wice BM, Dusso A, Bernal-Mizrachi C. Acute hyperglycemia induces podocyte apoptosis by monocyte TNF-α release, a process attenuated by vitamin D and GLP-1 receptor agonists. J Steroid Biochem Mol Biol. 2025 Jan 14;247:106676. doi: 10.1016/j.jsbmb.2025.106676. Epub ahead of print. PMID: 39818342.
- Tan X, Chen P, Xiao L, Gong Z, Qin X, Nie J, et al. Extraction, purification, structural characterization, and anti-inflammatory activity of a polysaccharide from Lespedeza formosa. Int J Biol Macromol. 2025 Jan 22;300:140154. doi: 10.1016/j.ijbiomac.2025.140154. Epub ahead of print. PMID: 39855506.
- Woo HS, Lee KH, Park KH, Kim DW. Flavonoids Derived from the Roots of Lespedeza bicolor Inhibit the Activity of SARS-CoV Papain-like Protease. Plants (Basel). 2024 Nov 26;13(23):3319. doi: 10.3390/plants13233319. PMID: 39683112; PMCID: PMC11644518.
- Sami U. Methanolic extract from Lespedeza bicolor: potential candidates for natural antioxidant and anticancer agent. J Tradit Chin Med. 2017 Aug;37(4):444-451. PMID: 32188202.
- Дудар І.О., Лобода О.М. Ефективність застосування Lespedeza capitata у хворих на хронічну хворобу нирок ІІІ–ІV ст. Нирки. 2023;12(3).
- Соколова Л.К., Бельчіна Ю.Б., Цимбал Т.С., Черв’я–кова С.А., Соколова А.М. Застосування екстракту леспедези головчастої в комплексному лікуванні хронічної хвороби нирок. Нирки. 2023;12(3).
- Do MH, Lee JH, Cho K, Kang MC, Subedi L, Parveen A, Kim SY. Therapeutic Potential of Lespedeza bicolor to Prevent Me–thylglyoxal-Induced Glucotoxicity in Familiar Diabetic Nephropathy. J. Clin. Med. 2019;8:1138. doi: 10.3390/jcm8081138.
- Do MH, Lee JH, Wahedi HM, Pak C, Lee CH, Yeo E-J, et al. Lespedeza bicolor ameliorates endothelial dysfunction induced by methylglyoxal glucotoxicity. Phytomedicine. 2017;36:26-36. doi: 10.1016/j.phymed.2017.09.005.
- Park JE, Lee H, Kim SY, Lim Y. Lespedeza bicolor Extract Ameliorated Renal Inflammation by Regulation of NLRP3 Inflammasome-Associated Hyperinflammation in Type 2 Diabetic Mice. Antioxidants (Basel). 2020 Feb 10;9(2):148. doi: 10.3390/antiox9020148. PMID: 32050658; PMCID: PMC7071116.
- Song W, Wei L, Du Y, Wang Y, Jiang S. Protective effect of ginsenoside metabolite compound K against diabetic nephropathy by inhibiting NLRP3 inflammasome activation and NF-kappaB/p38 signaling pathway in high-fat diet/streptozotocin-induced diabetic mice. Int Immunopharmacol. 2018;63:227-238. doi: 10.1016/j.intimp.2018.07.027.
- Hong Q, Zhang L, Das B, Li Z, Liu B, Cai G. Іncreased podocyte Sirtuin-1 function attenuates diabetic kidney injury. Kidney Int. 2018;93:1330-1343. doi: 10.1016/j.kint.2017.12.008.
- El-Houseiny W, Basher AW, Mahmoud YK, Bayoumi Y, Abdel-Warith AA, Younis EM, et al. Mitigation of sodium fluoride-induced growth inhibition, immunosuppression, hepatorenal damage, and dysregulation of oxidative stress, apoptosis, and inflammation-related genes by dietary artichoke (Cynara scolymus) leaf extract in Oreochromis niloticus. Comp Biochem Physiol B Biochem Mol Biol. 2024 Dec 28:111068. doi: 10.1016/j.cbpb.2024.111068. Epub ahead of print. PMID: 39736455.
- Ben Salem M, Affes H, Dhouibi R, Charfi S, Turki M, Hammami S, et al. Preventive effect of Artichoke (Cynara scolymus L.) in kidney dysfunction against high fat-diet induced obesity in rats. Arch Physiol Biochem. 2022 Jun;128(3):586-592. doi: 10.1080/13813455.2019.1703755. Epub 2019 Dec 19. PMID: 31855072.
- Eassawy MMT, Ismail AFM. Protective effect of chicory and/or artichoke leaves extracts on carbon tetrachloride and gamma-irradiation-induced chronic nephrotoxicity in rats. Environ Toxicol. 2024 Mar;39(3):1666-1681. doi: 10.1002/tox.24060. Epub 2023 Nov 30. PMID: 38031637.
- Khaled A, Ahmed E, Mamdouh M, Saad H, Mohamed A, Sobhy M, et al. Natural angiotensin converting enzyme inhibitors: A safeguard against hypertension, respiratory distress syndrome, and chronic kidney diseases. Phytother Res. 2023 Dec;37(12):5464-5472. doi: 10.1002/ptr.7987. Epub 2023 Sep 7. PMID: 37675925.
- Kim DB, Unenkhuu B, Kim GJ, Kim SW, Kim HS. Cynarin attenuates LPS-induced endothelial inflammation via upregulation of the negative regulator MKP-3. Anim Cells Syst (Seoul). 2022 May 20;26(3):119-128. doi: 10.1080/19768354.2022.2077438. PMID: 35784390; PMCID: PMC9246029.