Международный эндокринологический журнал Том 21, №1, 2025
Вернуться к номеру
Стан імунофенотипу лімфоцитів крові у хворих із вперше виявленим цукровим діабетом 2-го типу у постковідному періоді
Авторы: Попова В.В., Гетьман Н.В., Лабанець Я.І., Куліковська Г.В., Лавріненко О.Е., Фурманова О.В., Ковзун О.І., Тронько М.Д.
ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
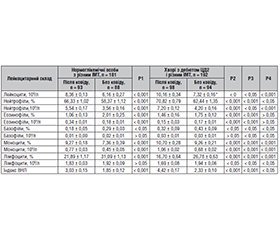
Актуальність. Показники субпопуляційного складу крові на сьогодні є одними із ключових характеристик функції імунітету. Особливе значення ці параметри мають у хворих на вперше виявлений цукровий діабет 2-го типу (ЦД2) у постковідному періоді. Проте дані досліджень щодо стану імунофенотипу лімфоцитів у хворих на вперше виявлений ЦД2 з різним індексом маси тіла (ІМТ) в постковідному періоді вкрай нечисленні та дискутабельні. Мета: визначення показників імунофенотипу лімфоцитів (CD3+, CD4+, CD8+, CD20+ і CD56+ Т-клітин) крові у пацієнтів з вперше виявленим ЦД2 і різним ІМТ в постковідному періоді. Матеріали та методи. У дослідження були залучені 98 хворих з дебютом ЦД2, що відбувся протягом трьох місяців після перенесеного COVID-19, з різним ІМТ та 94 пацієнти з дебютом ЦД2 в допандемічний період і різним ІМТ. Групи порівняння становили 93 нормоглікемічних особи після перенесеного коронавірусного захворювання з різним ІМТ та 88 нормоглікемічних з різним ІМТ без COVID-19 в анамнезі. Обстежені залежно від ІМТ були розділені на 4 підгрупи. Визначення імунофенотипу лімфоцитів крові було виконане проточно-цитометричним методом із використанням лазерного цитофлюориметра FACStar plus і панелі моноклональних антитіл до мембранних антигенів лімфоцитів. Результати. Для хворих на ЦД2 у постковідному періоді характерне вірогідне зниження абсолютної кількості всіх субпопуляцій лімфоцитів порівняно з хворими в доковідному періоді та групами нормоглікемічних осіб в доковідному та постковідному періодах. При розподілі хворих залежно від ІМТ на 4 підгрупи: 1) < 25,5 кг/м2; 2) 25,9–29,9 кг/м2; 3) 30,0–34,9 кг/м2; 4) > 35,0 кг/м2 — виявлено прогресуюче зниження CD3+, CD4+, CD8+, CD20+ і CD56+ Т-клітин порівняно з хворими на вперше виявлений ЦД2 в доковідному періоді, у яких відзначалося, навпаки, прогресуюче збільшення всіх субпопуляцій лімфоцитів. Подібне підвищення абсолютного числа CD4+ Т-клітин залежно від ІМТ відзначали також і в нормоглікемічних осіб, але воно було менш вираженим. Висновки. Для пацієнтів з вперше виявленим ЦД2 у постковідному періоді характерне зниження вмісту в периферичній крові всіх субпопуляцій лімфоцитів, яке максимально виражене при супутньому ожирінні, що свідчить про імуносупресивний вплив коронавірусного захворювання на стан імунної системи у хворих з дебютом ЦД2 у постковідному періоді і різним ІМТ.
Background. Today, the indicators of the subpopulation blood composition are one of the key characteristics of immune function. These parameters are of particular importance in patients with newly diagnosed type 2 diabetes mellitus (T2DM) in the post-COVID period. However, research data on the state of the lymphocyte immunophenotype in patients with newly diagnosed T2DM with different body mass index (BMI) in the post-COVID period are extremely scarce and controversial. Aim of the study: to determine the lymphocyte immunophenotype (CD3+, CD4+, CD8+, CD20+ and CD56+ T cells) in the blood of patients with newly diagnosed T2DM with different BMI in the post-COVID period. Materials and methods. The study involved 98 individuals with the onset of T2DM that occurred within 3 months after COVID-19, with different BMI, and 94 patients with the onset of T2DM in the pre-pandemic period and with different BMI. The comparison groups consisted of 93 normoglycemic people who have suffered coronavirus disease, with different BMI, and 88 normoglycemic people with different BMI without COVID history. The examined subjects were divided into 4 subgroups depending on BMI: 1) < 25.5 kg/m2; 2) 25.9–29.9 kg/m2; 3) 30.0–34.9 kg/m2; 4) > 35.0 kg/m2. The lymphocyte immunophenotype in the blood was determined by flow cytometry using a FACStar plus laser cytofluorimeter and a panel of monoclonal antibodies to lymphocyte membrane antigens. Results. Patients with TD2M in the post-COVID period were characterized by a significant decrease in the absolute number of all lymphocyte subpopulations compared to pre-COVID patients and normoglycemic people before and after COVID. When distributing patients into 4 subgroups according to BMI, a progressive decrease in CD3+, CD4+, CD8+, CD20+ and CD56+ T cells was revealed compared to those with newly diagnosed T2D before COVID-19, in whom, on the contrary, a progressive increase in all lymphocyte subpopulations was noted. A similar increase in the absolute number of CD4+ T cells depending on BMI was also noted in normoglycemic individuals, but it was less pronounced. Conclusions. Patients with newly diagnosed T2DM in the post-COVID period were characterized by a decrease in the number of all lymphocyte subpopulations in the peripheral blood, which is most pronounced in concomitant obesity. It indicates the immunosuppressive effect of coronavirus disease on the state of the immune system in patients with the onset of T2DM in post-COVID period and with different BMI.
цукровий діабет 2-го типу; ожиріння; імунітет; імунофенотип лімфоцитів; COVID-19
type 2 diabetes mellitus; obesity; immunity; lymphocyte immunophenotype; COVID-19
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Donath MY. Multiple benefits of targeting inflammation in the treatment of type 2 diabetes. Diabetologia. 2016;59(4):679-82. doi: 10.1007/s00125-016-3873-z.
- Zak K, Popova V, Orlenko V, Furmanova O, Tronko M. Cytokines in the blood of patients with type 2 diabetes mellitus depending on the level of overweight/obesity (literature review and own data). International Journal оf Endocrinology (Ukraine). 2021;17(7):534-551. https://doi.org/10.22141/2224-0721.17.7.2021.244969.
- Shitole SG, Biggs ML, Reiner AP, Mukamal KJ, Djoussé L, Ix JH, et al. Soluble CD14 and CD14 variants, other inflammatory markers, and glucose dysregulation in older adults: The Cardiovascular Health Study. Diabetes Care. 2019 Nov;42(11):2075-2082. doi: 10.2337/dc19-0723.
- Tronko M, Zak K. Current advances in clinical pathophysiology in the study of the pathogenesis of type 1 and type 2 diabetes mellitus in humans. International Journal of Endocrinology (Ukraine). 2019;15(6):422-34. https://doi.org/10.22141/2224-0721.15.6.2019.185403.422.
- Rezaei M, Marjani M, Mahmoudi S, Mortaz E, Mansouri D. Dynamic changes of lymphocyte subsets in the course of COVID-19. Int Arch Allergy Immunol. 2021;182(3):254-62. doi: 10.1159/000514202.
- Furmanova O, Zak K, Popova V, Tronko M. Blood leukocyte composition and neutrophil to lymphocyte ratio in patients with newly diagnosed type 2 diabetes mellitus depending on the degree of overweight/obesity. International Journal of Endocrinology (Ukraine). 2020;16(7):526-33. https://doi.org/10.22141/2224-0721.16.7.2020.219006.
- Lee YH, Kim SR, Han DH, Yu HT, Han YD, Kim JH, et al. Senescent T cells predict the development of hyperglycemia in humans. Diabetes. 2019 Jan;68(1):156-62. doi: 10.2337/db17-1218.
- Yi H-S, Lee Y, Ku B. Metabolic reprogramming of CD8+T cells regulates systemic glucose metabolism. Diabetologia. 2018;61(Suppl 1):S3. doi: 10.1007/s00125-018-4693-0.
- Fabbrini E, Cella M, McCartney SA, Fuchs A, Abumrad NA, Pietka TA, et al. Association between specific adipose tissue CD4+ T-cell populations and insulin resistance in obese individuals. Gastroenterology. 2013 Aug;145(2):366-74.e1-3. doi: 10.1053/j.gastro.2013.04.010.
- Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020 Apr 30;382(18):1708-20. doi: 10.1056/NEJMoa2002032.
- Diao B, Wang C, Tan Y, Chen X, Liu Y, Ning L, et al. Reduction and functional exhaustion of T cells in patients with coronavirus disease 2019 (COVID-19). Front Immunol. 2020 May 1;11:827. doi: 10.3389/fimmu.2020.00827.
- Bailin SS, McGinnis KA, McDonnell WJ, So-Armah K, Wellons M, Tracy RP, et al. T Lymphocyte subsets associated with prevalent diabetes in veterans with and without human immunodeficiency virus. J Infect Dis. 2020 Jun 29;222(2):252-62. doi: 10.1093/infdis/jiaa069.
- Diagnosis and Classification of Diabetes: Standards of Care in Diabetes — 2024. American Diabetes Association Professional Practice Committee. Diabetes Care. 2024;47(Suppl 1):S20-S42. https://doi.org/–10.2337/dc24-S002.
- Jasti N, Mn LR, Pothireddy NK, Sankepalli MR, Jagathkar GM, Pratap Singh U. Changes and rate of change in neutrophil-lymphocyte ratio (∆NLR) as an early prognostic marker for the severity of outcomes in patients with COVID-19 and its applicability in other viral and bacterial diseases. Cureus. 2023 Jul 12;15(7):e41774. doi: 10.7759/cureus.41774.
- Tay MZ, Poh CM, Rénia L, MacAry PA, Ng LFP. The trinity of COVID-19: immunity, inflammation and intervention. Nat Rev Immunol. 2020 Jun;20(6):363-374. doi: 10.1038/s41577-020-0311-8.
- Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ. HLH Across Speciality Collaboration, UK. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet. 2020 Mar 28;395(10229):1033-4. doi: 10.1016/S0140-6736(20)30628-0.
- Pantea Stoian A, Bica IC, Salmen T, Al Mahmeed W, Al-Rasadi K, Al-Alawi K, et al. New-onset diabetes mellitus in COVID-19: A Scoping Review. Diabetes Ther. 2024 Jan;15(1):33-60. doi: 10.1007/s13300-023-01465-7. Erratum in: Diabetes Ther. 2024 Jan;15(1):297-9. doi: 10.1007/s13300-023-01494-2.
- Lim S, Bae JH, Kwon HS, Nauck MA. COVID-19 and diabetes mellitus: from pathophysiology to clinical management. Nat Rev Endocrinol. 2021 Jan;17(1):11-30. doi: 10.1038/s41574-020-00435-4.
- Keerthi BY, Sushmita G, Khan EA, Thomas V, Cheryala V, Shah C, et al. New onset diabetes mellitus in post-COVID-19 patients. J Family Med Prim Care. 2022 Oct;11(10):5961-8. doi: 10.4103/jfmpc.jfmpc_316_22.
- Popova VV, Het’man NV, Labanets YaA I, Kulikovs’ka HV, Furmanova OV. Leukocyte composition of blood and the VNL inflammation index (the ratio of neutrophils to lymphocytes) in patients with newly diagnosed type 2 diabetes mellitus with different body mass index on a post-covid background. Endocrynologia. 2024;29(3):269-82. DOI: 10.31793/1680-1466.2024.29-3.269.
- Furmanova OV, Kulykovs’ka AV, Popova VV, Zak KP, Tronko MD. Immunophenotype of blood lymphocytes in patients with type 2 diabetes mellitus with normal body weight and obesity. International Journal of Endocrinology (Ukraine). 2021;17(2):108-15. https://doi.org/–10.22141/2224-0721.17.2.2021.230564.
- Alberti A, Schuelter-Trevisol F, Iser BPM, Traebert E, Freiberger V, Ventura L, et al. Obesity in people with diabetes in COVID-19 times: Important considerations and precautions to be ta–ken. World J Clin Cases. 2021 Jul 16;9(20):5358-5371. doi: 10.12998/wjcc.v9.i20.5358.
- Zhao R, Sun Y, Zhang Y, Wang W, Wang S, Wang C, et al. Distinguishable immunologic characteristics of COVID-19 patients with comorbid type 2 diabetes compared with nondiabetic individuals. Mediators Inflamm. 2020 Sep 29;2020:6914878. doi: 10.1155/2020/6914878.
- Tang L, Wang H, Cao K, Xu C, Ma A, Zheng M, et al. Dysfunction of circulating CD3+CD56+ NKT-like cells in type 2 diabetes mellitus. Int J Med Sci. 2023 Apr 2;20(5):652-662. doi: 10.7150/ijms.83317.
- Nhau PT, Gamede M, Sibiya N. COVID-19-induced diabetes mellitus: Comprehensive cellular and molecular mechanistic insights. Pathophysiology. 2024 Apr 8;31(2):197-209. doi: 10.3390/pathophy–siology31020016.