Международный эндокринологический журнал Том 21, №1, 2025
Вернуться к номеру
Зв’язок трансформуючого фактора росту β1 з діабетичною ретинопатією при цукровому діабеті 2-го типу
Авторы: A.S. Hudz (1), V.A. Serhiyenko (1), I.V. Kudryl (1), V.G. Guryanov (2), M.I. Kovtun (3), S.V. Ziablitsev (2)
(1) - Danylo Halytsky Lviv National Medical University, Lviv, Ukraine
(2) - Bogomolets National Medical University, Kyiv, Ukraine
(3) - Shupyk National Healthcare University of Ukraine, Kyiv, Ukraine
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
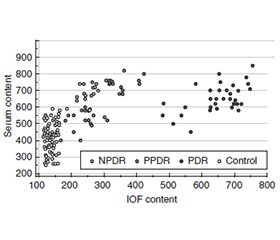
Актуальність. Відомо, що при діабетичній ретинопатії (ДР) порушення сигналінгу трансформуючого фактора росту β1 (TGF-β1) супроводжується патологічним ангіогенезом, порушенням гематоофтальмічного бар’єра, активацією запалення і фіброзу тканин. Мета: шляхом нейромережевого моделювання встановити зв’язок вмісту TGF-β1 у сироватці крові та внутрішньоочній рідині (ВОР) із прогресуванням ДР при цукровому діабеті 2-го типу (ЦД2). Матеріали та методи. У дослідження було включено результати обстеження 102 осіб із ЦД2, яких за стадіями ДР розділили на 3 групи: першу — з непроліферативною ДР (НПДР, 35 пацієнтів), другу — з препроліферативною (ППДР, 34 особи) і третю — з проліферативною (ПДР, 33 пацієнти). У контрольну групу ввійшла 61 особа. Пацієнтам проводили стандартні офтальмологічні обстеження. Рівень TGF-β1 у сироватці крові і ВОР визначали методом імуноферментного аналізу (Invitrogen Thermo Fisher Scientific, США). Статистичний аналіз результатів проводили за допомогою пакета програм MedCalc (MedCalc SoftWare bvba, 1993–2013) і нейромережевої двошарової моделі з лінійною постсинаптичною потенціальною функцією. Результати. Методом генетичного алгоритму відбору було виділено 3 ознаки, що пов’язані з ДР: компенсація діабету та вміст ТGF-β1 у крові і ВОР. ЦД2 був компенсованим у 38 (37,3 %) пацієнтів, тоді як у 64 (62,7 %) — некомпенсованим. Частка останнього була більшою при ПДР, ніж при НПДР і ППДР (p < 0,05). При ПДР уміст ТGF-β1 у ВОР був суттєво вищим, ніж при НПДР і ППДР (p < 0,05). На виділених ознаках було створено трифакторну модель класифікації, що включала систему рівнянь, яка з точністю 100 % прогнозувала ПДР. Загальна точність прогнозування моделі становила 88,2 % (95% ВІ 80,4–93,8 %). Висновки. У цьому дослідженні методом нейромережевого моделювання було показано значення для прогресування ДР у ПДР таких показників, як компенсація цукрового діабету й вміст ТGF-β1 у сироватці крові і ВОР.
Background. It is known that in diabetic retinopathy (DR), impaired transforming growth factor β1 (TGF-β1) signaling is accompanied by pathological angiogenesis, disruption of the blood-eye barrier, activation of inflammation and tissue fibrosis. The purpose of the study was to establish the relationship between the content of TGF-β1 in blood serum and intraocular fluid (IOF) and the progression of DR in type 2 diabetes mellitus (T2DM) using neural network modeling. Materials and methods. The study included the results of the examination of 102 people with T2DM, who were divided into 3 groups according to the stages of DR: the first one — non-proliferative DR (NPDR, 35 people), the second one — preproliferative (PPDR, 34 people) and the third one — proliferative (PDR, 33 people). The control group consisted of 61 individuals. The patients underwent standard ophthalmic examinations. TGF-β1 in blood serum and IOF was evaluated by enzyme-linked immunosorbent assay (Invitrogen Thermo Fisher Scientific, USA). Statistical analysis of the results was performed using the MedCalc software package (MedCalc SoftWare bvba, 1993–2013) and a two-layer neural network model with a linear postsynaptic potential function. Results. Using the genetic selection algorithm, 3 features were identified that were associated with DR: diabetes compensation and TGF-β1 content in blood and IOF. T2DM was compensated in 38 (37.3 %) patients, while in 64 cases (62.7 %), it was uncompensated. The proportion of the latter was higher in PDR than in NPDR and PPDR (p < 0.05). In PDR, the TGF-β1 content in IOF was significantly higher than in NPDR and PPDR (p < 0.05). A three-factor classification model was created on the identified features, which included a system of equations that predicted PDR with 100% accuracy. The overall prediction accuracy of the model was 88.2 % (95% CI 80.4–93.8 %). Conclusions. In this study, the value of indicators such as diabetes compensation and TGF-β1 content in serum and IOF for the progression of DR to PDR was shown using the method of neural network modeling.
проліферативна діабетична ретинопатія; цукровий діабет; трансформуючий фактор росту β1; внутрішньоочна рідина; нейромережеве моделювання
proliferative diabetic retinopathy; diabetes mellitus; transforming growth factor β1; intraocular fluid; neural network modeling
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- American Diabetes Association Professional Practice Committee; 2. Diagnosis and Classification of Diabetes: Standards of Care in Diabetes — 2025. Diabetes Care. 2025;48(Suppl 1):S27-S49. doi: 10.2337/dc25-S002.
- NCD Risk Factor Collaboration (NCD-RisC). Worldwide trends in diabetes prevalence and treatment from 1990 to 2022: a pooled analysis of 1108 population-representative studies with 141 million participants. Lancet. 2024;404(10467):2077-2093. doi: 10.1016/S0140-6736(24)02317-1.
- Sun H, Saeedi P, Karuranga S, Pinkepank M, Ogurtsova K, Duncan BB, Stein C, et al. IDF Diabetes Atlas: Global, regional and country-–level diabetes prevalence estimates for 2021 and projections for 2045. Diabetes Res Clin Pract. 2022;183:109119. doi: 10.1016/j.diabres.2021.109119.
- Pushparani DS, Varalakshmi J, Roobini K, Hamshapriya P, Livitha A. Diabetic retinopathy — a review. Curr Diabetes Rev. 2024. doi: 10.2174/0115733998296228240521151050.
- Pankiv V, Yuzvenko T, Pashkovska N, Pankiv I. The relationship between serum vitamin D concentrations and development of diabetic retinopathy in type 2 diabetes mellitus. Mìžnarodnij Endokrinologìčnij Žurnal (Ukraine). 2022;18(8):432-435. doi: 10.22141/2224-0721.18.8.2022.1221.
- Tan TE, Wong TY. Diabetic retinopathy: looking forward to 2030. Front Endocrinol (Lausanne). 2023;13:1077669. doi: 10.3389/fendo.2022.1077669.
- Kropp M, Golubnitschaja O, Mazurakova A, Koklesova L, Sargheini N, Vo TKS, et al. Diabetic retinopathy as the leading cause of blindness and early predictor of cascading complications — risks and miti–gation. EPMA J. 2023;14(1):21-42. doi: 10.1007/s13167-023-00314-8.
- Wang W, Lo ACY. Diabetic retinopathy: pathophysiology and treatments. Int J Mol Sci. 2018;19(6):1816. doi: 10.3390/ijms19061816.
- Rossino MG, Dal Monte M, Casini G. Relationships between neurodegeneration and vascular damage in diabetic retinopathy. Front Neurosci. 2019;13:1172. doi: 10.3389/fnins.2019.01172.
- Wang X, Hui Q, Jin Z, Rao F, Jin L, Yu B, et al. Roles of growth factors in eye development and ophthalmic diseases. Zhejiang Da Xue Xue Bao Yi Xue Ban. 2022;51(5):613-625. doi: 10.3724/zdxbyxb-2022-0603.
- Hachana S, Larrivée B. TGF-β superfamily signaling in the eye: implications for ocular pathologies. Cells. 2022;11(15):2336. doi: 10.3390/cells11152336.
- Mesquida M, Drawnel F, Fauser S. The role of inflammation in diabetic eye disease. Semin Immunopathol. 2019;41(4):427-445. doi: 10.1007/s00281-019-00750-7.
- Saucedo L, Pfister IB, Zandi S, Gerhardt C, Garweg JG. Ocular TGF-β, matrix metalloproteinases, and TIMP-1 increase with the deve–lopment and progression of diabetic retinopathy in type 2 diabetes mellitus. Mediators Inflamm. 2021;2021:9811361. doi: 10.1155/2021/9811361.
- Pankiv VI. New guidelines of the American Diabetes Association 2018 on the diagnosis and treatment of diabetes mellitus. Mìžnarodnij Endokrinologìčnij Žurnal. 2018;14(1):93-98. doi: 10.22141/2224-0721.14.1.2018.127099.
- He T, Fu W, Xu J, Zhang Z, Zhou J, Yin Y, Xie Z. Discovering interdisciplinary research based on neural networks. Front Bioeng Biotechnol. 2022;10:908733. doi: 10.3389/fbioe.2022.908733.
- Holland JH. Adaptation in natural and artificial systems. Ann Arbor, MI: The University of Michigan Press. 2nd ed. Boston, MA: MIT Press, 1992. 227 p. doi: 10.7551/mitpress/1090.001.0001.
- Ogawa K, Tsurutani M, Hashimoto A, Soeda M. Simple pro–pagation method for resident macrophages by co-culture and subculture, and their isolation from various organs. BMC Immunol. 2019;20(1):34. doi: 10.1186/s12865-019-0314-z.
- Mogilevskyy SIu, Serdiuk AV, Ziablitsev SV. Prognostic biomarkers of non-proliferative diabetic retinopathy progression in type 2 diabetes mellitus. J Ophthalmol (Ukraine). 2024;4(519):38-45. doi: 10.31288/oftalmolzh202443845.
- Rykov SO, Chugaiev DI, Ziablitsev SV. Blood selectin levels as a predictive factor for diabetic retinopathy and diabetic macular edema in type 2 diabetes. J Ophthalmol (Ukraine). 2023;3(512):19-26. doi: 10.31288/oftalmolzh202331926.
- Lee CS, Lee AY, Baughman D, Sim D, Akelere T, Brand C, et al.; UK DR EMR Users Group. The United Kingdom Diabetic Retinopathy Electronic Medical Record Users Group: Report 3: baseline reti–nopathy and clinical features predict progression of diabetic retinopathy. Am J Ophthalmol. 2017;180:64-71. doi: 10.1016/j.ajo.2017.05.020.
- Liu Y, Yang J, Tao L, Lv H, Jiang X, Zhang M, Li X. Risk factors of diabetic retinopathy and sight-threatening diabetic retino–pathy: a cross-sectional study of 13 473 patients with type 2 diabetes mellitus in mainland China. BMJ Open. 2017 Sep 1;7(9):e016280. doi: 10.1136/bmjopen-2017-016280.
- Ghamdi AHA. Clinical predictors of diabetic retinopathy progression: a systematic review. Curr Diabetes Rev. 2020;16(3):242-247. doi: 10.2174/1573399815666190215120435.
- Sabanayagam C, Banu R, Chee ML, Lee R, Wang YX, Tan G, et al. Incidence and progression of diabetic retinopathy: a systematic review. Lancet Diabetes Endocrinol. 2019 Feb;7(2):140-149. doi: 10.1016/S2213-8587(18)30128-1.
- Sun P, Xu N, Li Y, Han Y. Destruction of the blood-retina barrier in diabetic retinopathy depends on angiotensin-conver–ting enzyme-mediated TGF-β1/Smad signaling pathway activation. Int Immunopharmacol. 2020 Aug;85:106686. doi: 10.1016/j.intimp.2020.106686.
- Khuu LA, Tayyari F, Sivak JM, Flanagan JG, Singer S, Brent MH, et al. Aqueous humour concentrations of TGF-β, PLGF and FGF-1 and total retinal blood flow in patients with early non-proliferative diabetic retinopathy. Acta Ophthalmol. 2017 May;95(3):e206-e211. doi: 10.1111/aos.13230.
- Bonfiglio V, Platania CBM, Lazzara F, Conti F, Pizzo C, Reibaldi M, Russo A, et al. TGF-β serum levels in diabetic retinopathy patients and the role of anti-VEGF therapy. Int J Mol Sci. 2020 Dec 15;21(24):9558. doi: 10.3390/ijms21249558.
- Zhang H, Liang L, Huang R, Wu P, He L. Comparison of inflammatory cytokines levels in the aqueous humor with diabetic retinopathy. Int Ophthalmol. 2020 Oct;40(10):2763-2769. doi: 10.1007/s10792-020-01463-9.