Перед тим як заглибитись у проблему спондилоартриту, треба прийняти важливу парадигму, яку все частіше в контексті раціональної психотерапії доводиться озвучувати пацієнтам: «Усе матеріальне в цьому світі колись починається і колись закінчується». На жаль, це ж стосується і тканин людського організму, у яких з віком збільшується кількість і швидкість дегенеративних змін. Та, мабуть, найважливіше в цьому — саме швидкість, яку, до речі, можливо уповільнити завдяки певним практикам і підходам. Дегенеративні зміни хребта перебігають за трьома взаємопов’язаними паралельними сценаріями: спондильоз, остеохондроз, спондилоартроз, являючи собою єдиний континуум. Спондильоз — процес інволютивної дегенерації анатомічних структур хребта у вигляді дистрофії зовнішніх волокон передніх і бокових відділів фіброзного кільця, його випинання під тиском пульпозного ядра з осифікацією передньої поздовжньої зв’язки та формуванням остеофітів по передньобоковій поверхні хребців [3, 6]. Остеохондроз — це дегенерація суглобового хряща (міжребцевого диска) у вигляді його дегідратації, фізико-хімічних змін та реорганізації волокнисто-гіалінової структури з подальшим розтріскуванням фіброзного кільця та герніацією пульпозного ядра. Відповідно до сучасних уявлень спондильоз і остеохондроз — вік-асоційовані процеси, які характеризуються послідовною стадійністю перебігу. Патологічний процес розвивається в хребцево-рухових сегментах (ХРС), коли внаслідок різноманітних впливів (травма, перенавантаження, гіподинамія, метаболічні та ішемічні порушення тощо) змінюється постава і виникають функціональні, а згодом і структурні деформації, через що періартикулярні тканини й суглоби зазнають надлишкових навантажень, що провокує активізацію дегенеративних процесів, які спочатку мають пристосувально-компенсаторний характер [7, 9, 14].
Прогресування дегенеративного процесу ХРС супроводжується їх блокуванням, герніацією міжхребцевих дисків, розвитком стенозів міжхребцевих отворів, пролабуванням замикальних пластинок (появою кіст Шморля), появою остеофітів, спондилолістезу і спондилолізу, інших неврологічних та ортопедичних ускладнень. Водночас зміна осьового й кутових навантажень призводить до формування спондилоартрозу — дегенеративного ураження дуговідросткових (фасеткових) суглобів як однієї з форм остеоартриту із залученням усіх його структурних частин, включно із хрящем, кісткою, зв’язками і м’язами навколо [3, 4]. Вирішальним фактором є саме перерозподіл та асиметричне збільшення навантаження, унаслідок чого спочатку відбувається компенсаторна гіпертрофія фасеток з подальшим прискоренням дегенеративно-запального процесу і залученням у цей процес усього комплексу аксіальних сполучень і оточуючих тканин. Фіксація нової патобіомеханіки відбувається шляхом активації певних міофасціальних ланцюгів, які надалі викликають зрушення в інших відділах скелетно-м’язової системи. Формування патобіомеханічних змін постави потребує вчасної корекції, оскільки зволікання призводить до прискореної дегенерації вже в інших залучених у цей процес відділах скелетно-м’язової системи, розвитку ускладнень і хронізації болю, а отже, до подальшого погіршення якості життя і зростання соціоекономічного тягаря. Формуються патологічні структурно-функціональні дегенеративно-запальні синдромокомплекси, як-то коксо-вертебральний синдром та інші. Більше того, зміни постави супроводжуються також зміною міофасціальних лож внутрішніх органів, що негативно впливає на їх функцію. При формуванні так званого нижнього перехресного синдрому, який є саме м’язовою патобіомеханічною конструкцією, сформоване перенавантаження в сагітальній площині через декілька років реалізується в клінічну картину коксо-вертебрального синдрому, гіперлордотичний варіант якого за рахунок збільшення кіфозу грудопоперекового переходу змінює положення діафрагми, що спричиняє порушення функції зовнішнього дихання за рестриктивним типом тощо. І це лише зміни в сагітальній площині, які в переважній більшості випадків поєднуються зі змінами постави у фронтальній площині за типом сколіозу, патернів скошеного і скрученого таза, зупинених падінь вбік тощо [14, 25].
У більшості випадків подальший розвиток патобіомеханічних м’язово-функціональних конструкцій при неправильному менеджменті реалізується в різноманітні варіанти дегенеративно-дистрофічних порушень. Тому сьогодні проблема системності менеджменту больових синдромів є пріоритетною в сучасній медицині, оскільки хронізація болю сягає 40 % у розвинених країнах, а окрім пандемії коронавірусної інфекції вже багато років існує ще й пандемія залежності від опіоїдної аналгезії, що свідчить про значні недоліки ранньої первинної діагностики та менеджменту болю, незважаючи на всі досягнення медицини в цій галузі.
Згідно з клініко-епідеміологічними даними, серед людей, старших за 60 років, понад 95 % чоловіків і 70 % жінок страждають від рентгенологічно підтвердженого СА [24, 25]. При цьому найчастіше уражаються сегменти L4-L5 і L5-S1, що пов’язано з найбільшим осьовим навантаженням на них. Крім того, простежуються і певні етнічні особливості: у представників азійської раси порівняно з представниками європеоїдної спостерігається менший відсоток ураження суглобів, що, імовірно, пов’язано з меншим індексом маси тіла і, відповідно, меншим навантаженням на суглоби й періартикулярні тканини, а також зазвичай вищим рівнем фізичної активності.
Спондилопатії запального, дегенеративного та іншого генезу за частотою звернень до лікаря посідають третє місце серед усіх причин болю в спині, що обумовлює їх високу медико-соціальну значущість [24–26].
До основних етіологічних чинників СА належать: хронічне перевантаження суглобів хребта, його травми, а також вроджені й набуті захворювання (спондилоліз, spina bifida тощо), патологія нервової системи з порушенням м’язового тонусу та сили, особливо осьової мускулатури та м’язів-стабілізаторів, інші ортопедичні порушення. Захворювання внутрішніх органів також є досить частою причиною рефлекторних змін постави, що через вегетотрофічні механізми порушують метаболізм в ХРС, так само як і метаболічні й ішемічні порушення, особливо ті, що пов’язані з мінералізацією кісткової тканини [3, 5, 8].
Факторами ризику виступають: вік, жіноча стать, професійні, спортивні, а сьогодні — і військові травми, надмірне навантаження і вимушені пози, надлишкова вага, шкідливі звички, дефіцит фізичної активності, вплив вібрації та хронічний стрес [3, 4, 24–26].
Менеджмент больових синдромів, пов’язаних з дегенеративно-запальними захворюваннями хребта, починається з якомога більш раннього встановлення етіо-топічного діагнозу і роз’яснення пацієнту причин і механізмів захворювання, можливих наслідків, методів і перспектив лікування. Акцент робиться на необхідності модифікації способу життя: боротьбі зі шкідливими звичками, раціональному харчуванні, систематичному виконанні фізичних вправ та аеробних навантажень, копінг-стратегіях відновлення і збереження психічного здоров’я, уникненні вимушених робочих поз і надмірного навантаження тощо. За необхідності при клінічно сформованій емоційній дисфункції рекомендують психотерапевтичні й психофармакологічні методи корекції як складову комплексного підходу в лікуванні [23, 26].
Окремо серед факторів ризику слід виділити надмірну вагу: зростання індексу маси тіла не лише прямо корелює зі збільшенням інтенсивності дегенеративних процесів і ступенем невротизації, але також є потужним прозапальним тригером, який провокує імуноопосередковані порушення. Так, зменшення ваги на 6–7 кг асоційоване зі зменшенням ризику ураження фасеткових суглобів майже на 45 % [24–26].
У клінічній діагностиці СА досить чутливим є розгинально-поворотний тест Кемпа, або тест поперекового квадранта, який провокує іпсилатеральний локальний ноцицептивний біль в уражених фасетках [5, 7, 24–26]. Іноді спостерігаються ознаки запального процесу і підвищення запальних маркерів у периферичній крові (лейкоцитоз, швидкість осідання еритроцитів, С-реактивний протеїн, фібриноген). Проте вираженість запального процесу при дегенеративному остеоартриті унковертебральних суглобів зазвичай невелика.
Типовим проявом фасеткового синдрому є рефлекторний спазм глибоких м’язів, який значно посилює больову симптоматику і замикає порочне коло «біль — спазм — біль», у подальшому виступаючи потужним фактором хронізації процесу. Саме біль призводить до розвитку сегментарного дефансу м’яза — розгинача спини і приєднання рефлекторного сколіозу, ще більше змінюючи загальний патерн деформацій і перевантаження ХРС [1, 2, 7, 9, 24].
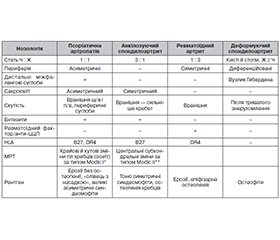
Не викликає сумніву, що важливою складовою успішної терапії є корекція психоемоційного стану пацієнта, оскільки персистуюча гіперкортизолемія в подальшому викликає порушення імунної регуляції та розвиток автоімунних ревматологічних патологій через певний період часу [24–26]. Тому актуальною проблемою клінічної практики є диференціальна діагностика дегенеративних та автоімунно-запальних спондилоартропатій. Ураження хребта найчастіше відбувається при хворобі Бехтерєва (анкілозуючому спондилоартриті), псоріазі й ревматоїдному артриті. Основні критерії диференціальної діагностики ревматологічних і дегенеративних артропатій, при яких зустрічається ураження хребта, подані в табл. 1 [1, 2, 4, 14, 17, 25].
/107.jpg)
Ініціальним критерієм диференціальної діагностики є запальний характер болю, критерії якого були сформульовані Американською асоціацією спондилоартриту (ASAS) у 2009 році: поступовий початок, вік до 45 років, нічний біль, поліпшення після фізичних вправ, погіршення або відсутність поліпшення після відпочинку. Наявність чотирьох критеріїв з п’яти свідчить про запальний характер болю.
Характерними візуалізаційними МРТ-ознаками ревматичних спондилітів є кутові та крайові остеїти тіл хребців, гіперінтенсивні в режимі Т2 і гіпоінтенсивні в режимі Т1 (Modic I). Водночас дегенеративно-деформуючим ураженням більше притаманні центральні й рівномірні субхондральні зміни тіл хребців з гіперінтенсивним сигналом як у Т1-, так і в Т2-зважених режимах (Modic II) [1, 2, 24–26].
Діагностика спондилоартриту повинна включати такі етапи:
— збір анамнезу та скарг — першочергово необхідно визначити тип болю (ноцицептивний, нейропатичний, ноципластичний), його інтенсивність і тривалість, обставини появи й посилення, засоби, що допомагають від болю, його вплив на повсякденну активність і сон, виключити запальний характер і відзначити невротичні патерни скарг та анамнезу, а за їх наявності рекомендувати пройти тестування за невротичними шкалами;
— огляд — ознаки запалення, постава, симетрія, біомеханіка, деформації, м’язовий дефанс, стан шкіри, атрофії тощо;
— терапевтичний і неврологічний огляд, провокативні тести (тест Кемпа при СА, Шпурлінга, Патріка тощо);
— інструментальна діагностика (візуалізація, денситометрія, електронейроміографія тощо);
— лабораторний скринінг (загальний і біохімічний аналіз крові, загальний аналіз сечі, тиреоїдна панель, ревмопроби, остеопоротична панель після 65 років тощо) [1, 2, 13, 14, 24–26].
Менеджмент спондилоартриту повинен включати такі складові:
1. Роз’яснення пацієнту сутності захворювання, особливостей його перебігу, причин і можливих наслідків з подальшим навчанням — інструктажем щодо модифікації способу життя тощо.
2. Функціональний спокій, бандажування й ортопедичні пристрої в період загострення або фізична терапія, постізометрична релаксація, акупунктура, масаж у випадку відсутності й невираженості запального процесу, переважання міофасціальних порушень у клінічній картині захворювання.
3. Психотерапія та психофармакотерапія за наявності верифікованого афективного розладу задля нормалізації емоційного стану й розриву порочного кола, створення мотивації до виконання вправ фізичної терапії, зменшення сенситизації та, відповідно, профілактики розвитку хронічного болю.
4. Корекція коморбідних станів.
5. Фармакотерапія болю за наявності запального компонента повинна включати нестероїдні протизапальні препарати (НПЗП) і симптоматичні препарати сповільненої дії при остеоартриті (SYSADOA), блокади фасеткових суглобів і додавання ад’ювантних засобів, як-от габапентиноїди, нуклеотиди, вітаміни групи В тощо.
6. Апаратна фізіотерапія.
7. Хірургічне лікування та мініінвазивні вручання використовуються, якщо консервативна терапія виявилася неуспішною, і сьогодні мають досить велике поширення. Так, радіочастотна абляція медіальної гілки спинно-мозкового нерва, що іннервує унковертебральний суглоб, є високоефективним методом знеболювання при СА [1, 2, 18, 20, 21, 24, 26].
Не викликає сумніву, що наріжним каменем застосування НПЗП є керування ризиками терапії. Результати систематичних оглядів і метааналізів свідчать про порівнянну протизапальну й аналгетичну активність більшості НПЗП, але нагальною проблемою залишається профіль безпеки препаратів і спектр їхніх побічних ефектів [22, 28, 31].
Відомо, що основною проблемою неселективних НПЗП залишаються гастроінтестинальні ризики й хондротоксичність, тоді як високоселективні інгібітори ЦОГ-2 чинять несприятливий вплив на серцево-судинну систему. Отже, на сьогодні найбільш збалансованими щодо ефективності й профілю безпеки є помірно селективні інгібітори ЦОГ-2 (набуметон, препарат Сінметон), які не виявляють гастро-, кардіо- і хондротоксичності, але водночас мають потужний протизапальний та аналгетичний вплив. Набуметон надає хондронейтральний ефект, не порушуючи утворення і метаболізм складових компонентів як інтактного, так і дегенеративно зміненого хряща, навіть за умов тривалої терапії [16, 22, 29–31].
За результатами метааналізу впливу НПЗП на виникнення гострого коронарного синдрому набуметон мав найнижчий показник ризику (1,26) при найбільш тривалому використанні. Згідно з даними іншого метааналізу, набуметон не викликав шлунково-кишкових небажаних подій у пацієнтів на відміну від інших НПЗП, що свідчить про його високу гастроінтестинальну безпеку [10, 12, 16].
Набуметон є єдиним некислотним НПЗП-пролікарським препаратом, який перетворюється в активний метаболіт вже після абсорбції. Завдяки цьому він демонструє низький ризик гастроінтестинальних впливів. Аналіз рандомізованих клінічних досліджень продемонстрував, що при тривалому використанні набуметону в пацієнтів з остеоартритом (1140 пацієнтів приймали препарат протягом 1 року і 927 пацієнтів — протягом 2 років) сукупна частота розвитку пептичної виразки становила 0,3 % через 3–6 місяців терапії, 0,5 % — через 1 рік і 0,8 % — через 2 роки. Зазначені цифри є дуже низькими для НПЗП, для яких гастротоксичність є частиною механізму дії. Отже, набуметон є одним з найбезпечніших НПЗП щодо ризику ускладнень з боку шлунково-кишкового тракту [12, 31].
Крім того, ще однією перевагою набуметону є особливості біотрансформації — він не метаболізується системою цитохрому Р450, що зводить до мінімуму ризик небажаних лікарських взаємодій. Зокрема, набуметон не конкурує з інгібіторами протонної помпи, які є субстратами ферментів системи цитохрому Р450, що особливо важливо для пацієнтів з гіперацидними станами в анамнезі, при коморбідних станах або для пацієнтів похилого віку, які отримують супутню терапію [15].
Проте ініціальною хворобомодифікуючою фармакологічною терапією при остеоартриті згідно із сучасними рекомендаціями мають бути препарати групи SYSADOA, серед яких найвищий рівень доказовості мають комбінації глюкозаміну сульфату і хондроїтину сульфату. На фармацевтичному ринку України ця комбінація подана в препараті Протекон, який не лише забезпечує суглоб складовими компонентами для регенеративних процесів, але й нормалізує склад синовіальної рідини (наслідком чого є зменшення запальної реакції в синовіальній рідині, синовіальній оболонці та самому хрящі). Протекон Фаст, що містить додатково диклофенак калію 50 мг, доцільно призначати в період загострення захворювання або як компонент ступеневої терапії — пригнічення запалення короткотривалою терапією (Протекон Фаст) і тривале лікування хондропротективним компонентом (Протекон) [11, 19, 27, 32].
Висновки
Отже, спондилопатії залишаються актуальною медико-соціальною проблемою, а больовий синдром, що супроводжує цей стан, суттєво знижує якість життя пацієнтів. Менеджмент спондилоартриту має поєднувати комплексну терапію функціональних порушень постави та корекцію існуючих деформуючих змін скелетно-м’язової системи, методи психокорекції та ефективні стратегії знеболювання. Одним з найбільш ефективних і безпечних нестероїдних протизапальних препаратів для купірування болю і запалення в період загострення спондилоартриту залишається набуметон, а препарати SYSADOA (комбінація глюкозаміну сульфату і хондроїтину сульфату) сьогодні розглядаються як ініціальна хворобомодифікуюча терапія дегенеративних захворювань суглобів.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 01.11.2024
Рецензовано/Revised 05.12.2024
Прийнято до друку/Accepted 12.12.2024
Список литературы
1. Priyanka А, Machado PM. Recent advances in managing axial spondyloarthritis. F1000Research. 2020;9:F1000 Faculty Rev-697.
2. Baraliakos X, et al. Treatment overview of axial spondyloarthritis in 2023. Best Practice & Research Clinical Rheumatology. 2023:101858.
3. Bernstein IA, et al. Low back pain and sciatica: summary of NICE guidance. BMJ. 2017;356.
4. Breivik Н, Borchgrevink РС, Allen SM. Assessment of pain. British Journal of Anesthesia. 2008;101(1):17-24.
5. Bruyère O, et al. An updated algorithm recommendation for the management of knee osteoarthritis from the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO). Seminars in Arthritis and Rheumatism. 2019;49(3).
6. Danve A, Deodhar A. Treatment of axial spondyloarthritis: an update. Nature Reviews Rheumatology. 2022;18(4):205-216.
7. Ebrahimiadib N, et al. Ankylosing spondylitis. Journal of Ophthalmic & Vision Research. 2021;16(3):462.
8. Flores-Robles B-J, et al. Concurrence of rheumatoid arthritis and ankylosing spondylitis: Analysis of seven cases and literature review. Case Reports in Rheumatology. 2022;2022(1):8500567.
9. Fragoulis GE, Siebert S. Treatment strategies in axial spondyloarthritis: what, when and how? Rheumatology. 2020;59(Suppl 4):iv79-iv89.
10. Helin-Salmivaara A, et al. NSAID use and the risk of hospitalization for first myocardial infarction in the general population: a nationwide case-control study from Finland. European Heart Journal. 2026;27(14):1657-1663.
11. Honvo G, et al. Safety of symptomatic slow-acting drugs for osteoarthritis: outcomes of a systematic review and meta-analysis. Drugs Aging. 2019;36:65-99.
12. Huang J-Q, Sridhar S, Hunt RH. Gastrointestinal safety profile of nabumetone: a meta-analysis. The American Journal of Medicine. 1999;107(6):55-61.
13. Hunter T, et al. Pain medication and corticosteroid use in ankylosing spondylitis, psoriatic arthritis, and rheumatoid arthritis in the United States: a retrospective observational study. Rheumatology and Therapy. 2021;8:1371-1382.
14. Last AR, Hulbert К. Chronic low back pain: evaluation and management. American Family Physician. 2009;79(12):1067-1074.
15. Matsumoto K, et al. A metabolic pathway for the prodrug nabumetone to the pharmacologically active metabolite, 6-methoxy-2-naphthylacetic acid (6-MNA) by non-cytochrome P450 enzymes. Xenobiotica. 2020;50(7):783-792.
16. McGettigan P, Henry D. Cardiovascular risk and inhibition of cyclooxygenase. JAMA. 2006;296:1633-44.
17. Meer E, et al. Risk factors for diagnosis of psoriatic arthritis, psoriasis, rheumatoid arthritis, and ankylosing spondylitis: a set of parallel case-control studies. The Journal of Rheumatology. 2022;49(1):53-59.
18. Nava T. Physiotherapy rehabilitation in patients with ankylo–sing spondylitis. Beyond Rheumatology. 2019;1(2):37-46.
19. Philippi AF, et al. Glucosamine, chondroitin, and manganese ascorbate for degenerative joint disease of the knee or low back: a randomized, double-blind, placebo-controlled pilot study. Military medicine. 1999;164(2):85-91.
20. Poddubnyy D, Sieper J. Current unmet needs in spondyloarthritis. Current Rheumatology Reports. 2019;21:1-8.
21. Poddubnyy D, Sieper J. Treatment of axial spondyloarthritis: what does the future hold? Current Rheumatology Reports. 2020;22:1-8.
22. Price MR, Cupler ZA, Hawk C, Bednarz EM, Walters SA, Daniels CJ. Systematic review of guideline-recommended medications prescribed for treatment of low back pain. Chiropr Man Therap. 2022;30(1):26. doi: 10.1186/s12998-022-00435-3.
23. Qaseem A, et al. Noninvasive treatments for acute, subacute, and chronic low back pain: a clinical practice guideline from the American College of Physicians. Annals of Internal Medicine. 2017;166(7):514-530.
24. Ramiro S, et al. ASAS-EULAR recommendations for the ma-nagement of axial spondyloarthritis: 2022 update. Annals of the rheumatic diseases. 2023;82.1:19-34.
25. Reveille JD. Spondyloarthritis. Clinical Immunology. Elsevier, 2019. Р. 769-787.
26. Ritchlin C, Adamopoulos IE. Axial spondyloarthritis: new advances in diagnosis and management. BMJ. 2021;372.
27. Singh G, et al. Combination Treatment With Glucosamine-chondroitin Sulfate Reduces Pain, Disability And NSAID Consumption In Patients With Chronic Low Back Pain: Final Results From A Large, Community-based, Pilot, Open Prospective Interventional Study. 2014. DOI: 10.1136/annrheumdis-2014-eular.1035.
28. Subacute, and Chronic Low Back Pain: A Clinical Practice Guideline From the American College of Physicians. Ann Intern Med. 2017;166(7):514-530. doi: 10.7326/M16-2367.
29. Wang H, Zheng Н, Ma Y. Drug treatment of ankylosing spondylitis and related complications: an overlook review. Annals of Palliative Medicine. 2020;9(4):2279285-2272285.
30. Zhu W, et al. Ankylosing spondylitis: etiology, pathogenesis, and treatments. Bone Research. 2019;7(1):22.
31. Проценко Г.О., Іванова К.А. Досвід застосування синметону (набуметону) в клінічній практиці. Травма. 2011. Т. 12. № 2. С. 26-30.
32. Свиридова Н.К., Середа В.Г. Хронічний біль в неврологічній практиці. Східно-європейський неврологічний журнал. 2019. № 2(26). С. 1-14.

/107.jpg)