Вступ
Мінно-вибухові поранення — поєднані травми, що виникають у результаті імпульсного впливу комплексу вражаючих факторів мінно-вибухового боєприпасу і часто обумовлюють виникнення синдрому взаємного обтяження. Перебіг мінно-вибухових поранень характеризується глибоким і об’ємним руйнуванням тканин і контузією [1].
Міністерство оборони США визначає п’ять механізмів ушкодження головного мозку та інших органів, що пов’язані з вибухом:
1. Первинне ураження виникає внаслідок дії високого тиску і викликає розчавлення тіла та внутрішні пошкодження. Саме цей механізм є унікальним для мінно-вибухових травм.
2. Тиск газо-полум’яної суміші після вибухової хвилі викликає зміщення уламків, що супроводжується тупими проникними ушкодженнями.
3. Градієнт тиску викликає зміщення самого тіла і спричиняє травми, схожі на травми при автомобільних аваріях.
4. Дія інших вибухонебезпечних продуктів (наприклад, тепла та світла) та вплив токсичних речовин із палива, металів і газів може спричинити опіки, сліпоту і травми при вдиханні.
5. Клінічні наслідки забруднення навколишнього середовища після детонації, включно з хімічними (наприклад, зарин), біологічними (наприклад, сибірська виразка) та радіологічними (наприклад, брудні бомби) речовинами [1, 2].
З початку повномасштабної воєнної агресії РФ проти України значно зросла кількість осіб з мінно-вибуховою травмою порівняно з періодом проведення Операції об’єднаних сил (ООС) на Сході України. У результаті збройного конфлікту травма голови внаслідок вибухів стає все більш критичною проблемою для здоров’я, особливо серед військовослужбовців [3]. Причини вибухової черепно-мозкової травми (ЧМТ) внаслідок інцидентів, пов’язаних з вибухом, багатогранні, оскільки фізична рана мозку може бути результатом прямого і/або опосередкованого впливу середовища з надлишковим тиском [4].
Черепно-мозкова травма, пов’язана з вибухом, є важливою причиною захворюваності та смертності під час війни. Легка вибухова черепно-мозкова травма є причиною більшості пошкоджень головного мозку у військовослужбовців Сполучених Штатів та іншого військового персоналу в усьому світі [5].
За різними оцінками, від 10 до 20 % ветеранів, які брали участь у військових операціях, отримали черепно-мозкові травми. Існує теорія, що травми, пов’язані з вибухом, можуть спричинити несприятливі довгострокові наслідки для здоров’я і вплинути на стійкість і ефективність військ на театрі бойових дій [6].
Численні дослідження черепно-мозкової травми вказують на розвиток великої кількості нейрокогнітивних змін: розладів розпізнавальної функції, погіршення оперативної пам’яті, наростання симптомів депресії та тривожності [7, 8]. У нашому спостереженні ми вивчали вплив вибухової черепно-мозкової травми на когнітивні функції, рівень тривожності, оцінювали електроенцефалографічні показники.
Інструментом для визначення когнітивних порушень у пацієнтів з вибуховою черепно-мозковою травмою було обрано шкалу МоСА. Вона дає змогу оцінити такі когнітивні функції, як увага, концентрація, виконавчі функції, пам’ять, мовлення, зорово-конструктивні навички, абстрактне мислення, рахунок та орієнтація [9]. Максимально можлива кількість балів за результатами тесту — 30 балів. Результат ≥ 26 балів вважають нормою, тоді як кількість балів < 26 свідчить про наявність когнітивних порушень.
Шкала тривоги Спілбергера (State-Trait Anxiety Inventory, STAI) є інформативним способом самооцінки рівня тривожності в даний момент (реактивна тривожність як стан). Методика була розроблена в 1970 році. Шкала Спілбергера через свою відносну простоту й ефективність широко застосовується у клінічній практиці з різною метою — для визначення вираженості тривожних переживань та оцінки стану пацієнта в динаміці. У нашій країні використовують тест у модифікації Ю.Л. Ханіна (1976) [12].
Електроенцефалографія (ЕЕГ), поряд з методами нейровізуалізації, є вагомим інструментом у дослідженні уражень головного мозку, викликаних вибухами. У літературі описується, що при травмі головного мозку, пов’язаній з вибухом, спостерігалося зниження фазової синхронності електроенцефалограми, що свідчить про погіршення міжпівкульної координації діяльності мозку в результаті вибухової травми [10, 11].
У разі виявлення психологічних і когнітивних розладів після отриманої вибухової ЧМТ пацієнтам показані реабілітаційні й лікувальні заходи, направлені на збереження й відновлення порушених функцій. Таке лікування повинно мати персоналізований характер [13].
Окрім методів психологічної та фізичної реабілітації до відновлювального лікування пацієнтів додають медикаментозні засоби. За даними світових досліджень, використання антихолінестеразних препаратів є перспективним напрямком у реабілітації пацієнтів після черепно-мозкової травми.
Унаслідок черепно-мозкової травми відбувається активація фосфоліпази, що, у свою чергу, викликає руйнування фосфоліпідів головного мозку і зміни рівнів холіну. Через зміни рівнів холіну виникає недостатність холінергічної нейротрансмісії та порушення нейрогенезу, що призводить до коморбідних нейродегенеративних проявів. Згідно з літературними даними, зміни рівня холіну після черепно-мозкової травми і їх внесок у різні клітинні патології очевидні, тому корекція рівня холіну може бути одним з підходів до лікування [14, 15].
Як відомо, прямий стимулюючий вплив на холінергічну нейротрансмісію має іпідакрин, який доволі широко використовують в лікуванні пацієнтів з руховими й когнітивними порушеннями. На відміну від інших інгібіторів холінестерази іпідакрин забезпечує такі ефекти:
— стимулює пресинаптичне нервове волокно, у результаті чого збільшується викид ацетилхоліну в синаптичну щілину;
— інгібує ацетилхолінестеразу та інший фермент, що також руйнує ацетилхолін, — бутирилхолінестеразу;
— зменшує руйнування ацетилхоліну, подовжує його дію;
— підвищує активність постсинаптичних клітин [16].
Оскільки іпідакрин є оборотним інгібітором ацетилхолінестерази, після його застосування знижується швидкість реакції розпаду ацетилхоліну на ацетат і холін, відповідно кількість холіну, який повертається в пресинаптичний холінергічний нейрон, зменшується, що, у свою чергу, збільшує потребу в холіні із зовнішніх ресурсів для підтримки адекватного ресинтезу. Таким зовнішнім джерелом холіну виступає холіну альфосцерат, дія якого полягає саме в забезпеченні клітин мозку додатковим зовнішнім холіном.
З огляду на цей очевидний синергізм терапевтичного ефекту іпідакрину та холіну альфосцерату (рис. 1) нами проведено порівняльну оцінку результатів реабілітації пацієнтів, які перенесли вибухову черепно-мозкову травму, із застосуванням комплексної медикаментозної терапії (Параплексін® і Т-холін®) додатково до заходів психологічної та фізичної реабілітації.
Матеріали та методи
У спостереженні взяли участь 90 чоловіків молодого і середнього віку, які перенесли легку вибухову черепно-мозкову травму (6 місяців і більше після отримання травми). Усім учасникам проводились лікувально-реабілітаційні заходи на базі лікувальних закладів Закарпатської області. Середній вік обстежених становив 34,7 ± 4,2 року. Пацієнти були поділені на 3 групи (в кожній по 30 осіб). У першій групі пацієнти отримували комплексну фізичну та психологічну реабілітацію. У другій групі додатково до психофізичної реабілітації використовувався препарат іпідакрин (Параплексін®) по 15 мг внутрішньом’язово 2 рази на добу 30 днів. У третій групі використовували фізичну, психологічну реабілітацію, Параплексін® і холіну альфосцерат (Т-холін®) по 1000 мг внутрішньом’язово 1 раз на добу 30 днів.
Після збору скарг і анамнестичних даних досліджували неврологічний статус і стан когнітивних функцій, проводили нейропсихологічне тестування за Монреальською шкалою когнітивної оцінки (Montreal Cognitive Assessment (МоСА)), також застосовували шкалу реактивної тривожності Спілбергера — Ханіна та оцінку функціонального стану вестибулярного апарату за допомогою підрахунку кількості кроків без захитування, кожному пацієнту проводили ЕЕГ. Усі вищеописані обстеження повторювали двічі — до початку і після закінчення лікувально-реабілітаційних заходів.
Кількісну електроенцефалографію виконували за допомогою блоку електроенцефалографічних сигналів «Нейрон-Спектр» (ТОВ «Укрмедспектр», Харків, Україна). Стандартні параметри: чутливість — 70 мкВ/см, часова константа — 0,1 с, фільтр — 40 Гц. Електроди розміщували за стандартною схемою (10–20 %), відведення — монополярне. Комп’ютерний аналіз ЕЕГ проводили з використанням спектрального аналізу і картуванням потужності.
Оцінку когнітивних функцій у наших пацієнтів ми проводили за допомогою Монреальської шкали когнітивних функцій.
Результати та обговорення
При первинній діагностиці зниження когнітивних функцій (нижче за 26 балів за шкалою MoCА) спостерігалось у 33,3 % пацієнтів з легкою вибуховою ЧМТ І групи, у 33,3 % — ІІ групи та 36,7 % — ІІІ групи. Після проведеного лікування при повторному тестуванні за допомогою Монреальської шкали оцінки когнітивних функцій зниження спостерігалось у 30 % пацієнтів І групи, 26,7 % — ІІ групи, 26,6 % — ІІІ групи.
При цьому середній показник MoCА після проведення лікувально-реабілітаційних заходів зріс у всіх трьох групах нерівномірно. У групі пацієнтів, у якій проводилась лише фізична та психологічна реабілітація, середній показник за даними тесту MoCА зріс на 4,3 % (середній показник до проведення лікування — 25,3 бала, після — 26,4 бала). У групі, у якій психофізична реабілітація поєднувалася з введенням Параплексіну®, він зріс на 5,5 % (середній показник до проведення лікування — 25,2 бала, після — 26,6 бала), а додавання до фізичної та психологічної реабілітації Параплексіну® і Т-холіну® покращило результати пацієнтів на 8,1 % (середній показник до проведення лікування — 24,8 бала, після — 26,8 бала) (рис. 2).
/52.jpg)
При використанні іпідакрину (Параплексін®) позитивний вплив на когнітивні функції (зростання показників хоча б на 1 бал за даними тесту MoСА) відзначався в 56,7 % обстежених, а при поєднанні іпадакрину з холіну альфосцератом (Т-холін®) позитивний ефект відзначався в 66,7 % пацієнтів, тоді як у групі лише з психологічною та фізичною реабілітацією поліпшення було лише в 46,6 % обстежених.
Отже, лікування за допомогою психофізичної реабілітації з додаванням Параплексіну® і Т-холіну® дало найкращий результат і привело до поліпшення когнітивних функцій у 66,7 % пацієнтів, які отримували цю терапію. При цьому середній бал за Монреальською шкалою дослідження когнітивних функцій зріс на 8,1 %.
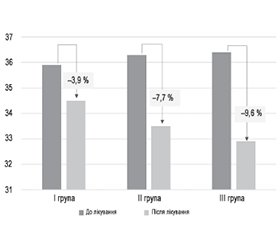
Усім пацієнтам у трьох групах проводилось дослідження реактивної тривожності за допомогою тесту Спілбергера — Ханіна. При інтерпретації показників використовували такі орієнтовні оцінки тривожності: до 30 балів — низька, 31–44 бали — помірна; 45 і більше — висока.
У І групі пацієнтів вихідний рівень реактивної тривожності в середньому становив 35,9 бала. Середній рівень тривожності після проведення фізичної та психологічної реабілітації становив 34,5 бала, що відповідало зниженню показника на 3,9 %. При цьому до проведення лікування у 23,3 % пацієнтів була низька реактивна тривожність, у 70 % — помірна і в 6,6 % — висока. Після проведеного лікування низька тривожність спостерігалась в 26,6 %, у 66,8 % пацієнтів показник тривожності був помірним і в 6,6 % — високим.
У ІІ групі пацієнтів вихідний рівень тривожності в середньому становив 36,3 бала. При цьому у 23,3 % пацієнтів була низька тривожність, у 63,3 % — помірна і в 13,4 % — висока. Рівень реактивної тривожності після проведення фізичної та психологічної реабілітації в поєднанні з введенням Параплексіну® становив 33,5 бала, що відповідало зниженню показника на 7,7 %. При цьому низька тривожність спостерігалась у 23,3 % обстежених, у 66,7 % пацієнтів показник тривожності був помірним і в 10 % — високим.
У ІІІ групі пацієнтів вихідний рівень реактивної тривожності в середньому становив 36,4. При цьому у 20 % пацієнтів була низька тривожність, у 73,3 % — помірна і в 6,7 % — висока. Середній рівень реактивної тривожності після проведення фізичної та психологічної реабілітації в поєднанні з введенням Параплексіну® і Т-холіну® становив 32,9 бала, що відповідало зниженню показника на 9,6 %. При цьому високої тривожності не спостерігалось, у 76,7 % пацієнтів показник реактивної тривожності був помірним, у 23,3 % він залишався низьким.
Отже, найефективнішим методом зниження реактивної тривожності було поєднання фізичної та психологічної реабілітації з медикаментозною терапією препаратами Параплексін® і Т-холін® (рис. 3).
Ще одним проведеним функціональним дослідженням було дослідження кількості кроків без захитування до та після лікування. У І групі середня кількість кроків до лікування становила 6,53 тис., а після — 7,63 тис. У ІІ групі, у якій використовувалась фізична, психологічна реабілітація та Параплексін®, — 6,5 і 8,8 тис. кроків до початку та після лікувально-реабілітаційних заходів відповідно. У ІІІ групі, у якій поєднувались фізична, психологічна реабілітація, Параплексін® і Т-холін®, — 6,2 і 9,1 тис. кроків до початку та після закінчення лікування відповідно.
Приріст кількості кроків становив 16,9 % у І групі, 35,4 % — у ІІ групі та 46,1 % — у ІІІ групі (рис. 4).
Отже, найбільше розширення функціонального потенціалу організму зі збільшенням кількості кроків без захитування спостерігалось у ІІІ групі пацієнтів.
ЕЕГ є одним з найпоширеніших методів оцінки функціонального стану головного мозку. Нами проводилась оцінка багатьох стандартних показників, проте привертає увагу відсоток асиметрії бета-ритму. У І групі до лікування частка асиметрії бета-ритму становила 41,7 %, після — 20,1 %. Регрес асиметрії становить 51,8 %.
У ІІ групі до лікування — 42,4 %, після — 17,9 %, регрес асиметрії — 58,1 %. У ІІІ групі до лікування — 41,1 %, після — 16,3 %. При цьому регрес асиметрії бета-ритму найкраще помітний саме в ІІІ групі, він становить 60,3 % (рис. 5).
Висновки
Отже, проведені нами спостереження свідчать, що в пацієнтів, які перенесли легку вибухову черепно-мозкову травму, відзначається значне підвищення тривожності, зниження когнітивних функцій, дисбаланс бета-ритму за даними ЕЕГ.
Використання комплексу Параплексіну® і Т-холіну® разом із психологічною та фізичною реабілітацією є найбільш ефективним методом лікування пацієнтів з перенесеною легкою вибуховою черепно-мозковою травмою та приводить до поліпшення когнітивних здібностей, наростання кількості пройдених кроків без захитування. У той же час знижується рівень реактивної тривожності та значно регресує асиметрія бета-ритму за даними ЕЕГ. У пацієнтів груп спостереження під час застосування зазначених лікарських засобів не було зареєстровано небажаних явищ.
З огляду на широку присутність холінергічних структур в нервовій системі та цілу низку захворювань, що пов’язані з холінергічним дефіцитом, перспективним є подальше накопичення досвіду одночасного застосування іпідакрину та холіну альфосцерату як двох комплементарних засобів для посилення холінергічної передачі нервового імпульсу та одночасного збереження нейрональних мембран.
Конфлікт інтересів. Не заявлений.
Отримано/Received 10.11.2024
Рецензовано/Revised 11.12.2024
Прийнято до друку/Accepted 20.12.2024
Список литературы
1. Дарій В.І., Товажнянська О.Л. Військово-польова неврологія. Харків, 2023.
2. Phipps H, Mondello S, Wilson A, Dittmer T, Rohde NN, Schroeder PJ et al. Characteristics and Impact of U.S. Military Blast-Rela-ted Mild Traumatic Brain Injury: A Systematic Review. Front Neurol. 2020 Nov 2;11:559318. doi: 10.3389/fneur.2020.559318. PMID: 33224086; PMCID: PMC7667277.
3. Петрук Л.Г., Богданов К.Г., Богданов В.К., Петрук Л.О. Отоларингологічні питання медичної реабілітації військових з мінно-вибуховою травмою. Полтава, 2023.
4. Characteristics and Impact of U.S. Military Blast-Related Mild Traumatic Brain Injury: A Systematic Review. Front Neurol. 02 November 2020. Sec. Neurotrauma. 2020; 11. https://doi.org/10.3389/fneur.2020.559318.
5. Zhang JK, Botterbush KS, Bagdady K, Lei CH, Mercier P, Mattei TA. Blast-Related Traumatic Brain Injuries Secondary to Thermobaric Explosives: Implications for the War in Ukraine. World Neurosurg. 2022 Nov;167:176-183.e4. doi: 10.1016/j.wneu.2022.08.073. Epub 2022 Aug 24. PMID: 36028113.
6. Elder GA, Cristian A. Blast-related mild traumatic brain injury: mechanisms of injury and impact on clinical care. Mt Sinai J Med. 2009 Apr;76(2):111-8. doi: 10.1002/msj.20098. PMID: 19306373.
7. Schneider ALC, Huie JR, Boscardin WJ, Nelson L, Barber JK, Yaffe K et al.; TRACK-TBI Investigators. Cognitive Outcome 1 Year After Mild Traumatic Brain Injury: Results From the TRACK-TBI Study. Neurology. 2022 Mar 22;98(12):e1248-e1261. doi: 10.1212/WNL.0000000000200041. Epub 2022 Feb 16. PMID: 35173018; PMCID: PMC8967334.
8. Howlett JR, Nelson LD, Stein MB. Mental Health Consequen-ces of Traumatic Brain Injury. Biol Psychiatry. 2022 Mar 1;91(5):413-420. doi: 10.1016/j.biopsych.2021.09.024. Epub 2021 Oct 2. PMID: 34893317; PMCID: PMC8849136.
9. Sponheim SR, McGuire KA, Kang SS, Davenport ND, Aviyente S, Bernat EM, Lim KO. Evidence of disrupted functional connectivity in the brain after combat-related blast injury. Neuroimage. 2011 Jan;54 Suppl 1:S21-9. doi: 10.1016/j.neuroimage.2010.09.007. Epub 2010 Sep 17. PMID: 20851190.
10. Amico F, Koberda JL. Quantitative Electroencephalography Objectivity and Reliability in the Diagnosis and Management of Traumatic Brain Injury: A Systematic Review. Clin EEG Neurosci. 2023 Oct 4:15500594231202265. doi: 10.1177/15500594231202265. Epub ahead of print. PMID: 37792559.
11. Thompson JM, Scott KC, Dubinsky L. Battlefield brain: unexplained symptoms and blast-related mild traumatic brain injury. Can Fam Physician. 2008 Nov;54(11):1549-51.
12. https://lnu.edu.ua/life-safety/wp-content/uploads/2019/09/OZDSH_PR-4-2019.pdf.
13. Завалій Ю.В. Неврологічні, нейропсихологічні та нейрофізіологічні характеристики посткомоційного синдрому після легкої вибухової черепно-мозкової травми: дис. ... д-ра філософії. Київ, 2023.
14. Florentino SA, Bawany MH, Ma HM. Acetylcholinesterase inhibitors to enhance recovery from traumatic brain injury: a comprehensive review and case series. Brain Inj. 2022 Mar 21;36(4):441-454. doi: 10.1080/02699052.2022.2034962. Epub 2022 Feb 3. PMID: 35113764.
15. Javaid S, Farooq T, Rehman Z, Afzal A, Ashraf W, Rasool MF, et al. Dynamics of Choline-Containing Phospholipids in Traumatic Brain Injury and Associated Comorbidities. Internatio-nal Journal of Molecular Sciences. 2021;22(21):11313. https://doi.org/10.3390/ijms222111313.
16. Більченко О.В., Гупалов І.Г. Ураження нервової системи при цукровому діабеті. Ліки України. 2020;1(237):48-53. https://doi.org/10.37987/1997-9894.2020.1(237).214178.

/51.jpg)
/52.jpg)
/52_2.jpg)
/53.jpg)