Журнал «Здоровье ребенка» Том 19, №6, 2024
Вернуться к номеру
Маркери внутрішньоклітинного енергетичного забезпечення за умов гіпоксії у передчасно народжених дітей
Авторы: Годованець О.С.
Буковинський державний медичний університет, м. Чернівці, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
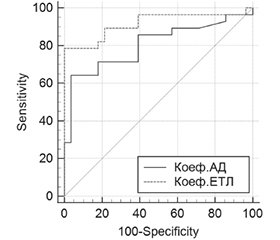
Актуальність. Передчасне народження є основною причиною захворюваності та смертності в неонатальному періоді, має довгострокові наслідки для подальшого психофізичного розвитку та здоров’я дітей. З огляду на об’єктивне погіршення економічної складової та соціальну нестабільність під час воєнних дій в Україні, прогнозованого підвищення показників народжуваності найближчими роками не очікується, тому важливим є збереження життя та здоров’я кожної новонародженої дитини. Благополуччя внутрішньоутробного середовища та пологів, морфофункціональна зрілість при народженні є основою постнатальної адаптації дитини. Умови перинатальної гіпоксії є предиктором розвитку суттєвих метаболічних порушень на субклітинному, клітинному, органному та системному рівнях, наслідком чого є порушення адаптації в неонатальному періоді, високий ризик в подальшому розвитку функціональної та хронічної патології. Мета: вивчити особливості показників внутрішньоклітинного енергетичного обміну при перинатальній патології у передчасно народжених дітей для дослідження патофізіологічних механізмів формування тяжких форм захворювань та обґрунтування впровадження у практичну неонатологію додаткових лабораторних маркерів гіпоксичного запалення. Матеріали та методи. Проведено клініко-лабораторне обстеження 68 передчасно народжених дітей гестаційним віком 32–33/6 тижні з тяжкими формами перинатальної патології. Групу порівняння становили 27 умовно здорових дітей, які мали гестаційний вік при народженні 34–36/6 тижнів. Критеріями включення у дослідження були: гестаційний вік дітей при народженні 32–33/6 тижні, тяжкий перебіг перинатальної патології. Критерії виключення: термін гестації при народженні < 32 та ≥ 37 тижнів, вроджені вади розвитку, неонатальний сепсис. Окрім загальноприйнятих методів клініко-лабораторного обстеження новонароджених було визначено показники внутрішньоклітинного енергетичного обміну: у лімфоцитах крові — рівень гліцерол-3-фосфатдегідрогенази (КФ 1.1.99.5), сукцинатдегідрогенази (КФ 1.3.99.1) та НАДН-дегідрогенази (КФ 1.6.5.3); у сироватці крові — рівень лактату, пірувату та співвідношення лактат/піруват. З використанням показників СДГ, ГФДГ і НАДНД було розраховано коефіцієнт аеробного дихання (АД) та коефіцієнт електронно-транспортного ланцюга (ЕТЛ). Статистичну обробку результатів дослідження проведено за допомогою програмного забезпечення STATISTICA (StatSoft Inc., USA, Version 10). Порівняння кількісних показників із нормальним розподілом здійснювалося з використанням t-критерію Стьюдента (p < 0,05; p < 0,001). Оцінку якісних відмінностей між показниками груп порівняння здійснено з використанням програми MedCalc Software (Statistical Software package for biomedical research, 2023, Version 16.1). Результати. Результати проведеного дослідження виявили за умов гіпоксії при тяжких формах перинатальної патології у передчасно народжених дітей значні зміни показників енергетичного обміну. Зокрема, зменшення рівня пірувату при зростанні співвідношення лактат/піруват, що свідчить про недостатність енергетичного обміну та домінування анаеробного гліколізу; зміни активності ферментів мітохондріального дихання, зокрема зниження ГФДГ, підвищення СДГ, зменшення НАДНД, а також зменшення коефіцієнта АД при зростанні коефіцієнта ЕТЛ. Статистичний ROC-аналіз кривих лабораторних показників енергетичного обміну показав достатній рівень чутливості та специфічності зазначених показників, що свідчить про доцільність їх використання при перинатальній патології у передчасно народжених дітей. Висновки. Використання лабораторних показників енергетичного обміну, поряд із загальноприйнятими методами додаткового параклінічного обстеження, надасть змогу своєчасної корекції лікувальних заходів для підвищення ефективності медичної допомоги передчасно народженим дітям шляхом корекції заходів оксигенотерапії на етапі інтенсивної терапії, а також свідчить про доцільність наукового пошуку фармакотерапевтичних засобів для корекції порушень мітохондріального дихання за умов гіпоксичного ураження організму.
Background. Premature birth is the main cause of morbidity and mortality in the neonatal period, with long-term consequences for the child’s further psycho-physical development and health. Given the objective deterioration of the economic component and social instability during the hostilities in Ukraine, the birth rate is not expected to increase in the coming years. So, it is important to preserve the life and health of every newborn child. The well-being of the intrauterine environment and birth, morphological and functional maturity at birth are the basis for the child’s postnatal adaptation. Perinatal hypoxia is a predictor of significant metabolic disorders at the subcellular, cellular, organ and systemic levels. This results in impaired adaptation in the neonatal period and a high risk of developing functional and chronic pathology in the future. The purpose of the study is to examine the features of intracellular energy exchange in perinatal pathology in preterm infants. This will facilitate the investigation of the underlying pathophysiological mechanisms of severe forms of diseases and provide justification for the introduction of additional laboratory markers of hypoxic inflammation in practical neonatology. Materials and methods. A clinical and laboratory examination was conducted on 68 preterm infants with a gestational age of 32–33/6 weeks who exhibited severe forms of perinatal pathology. The comparison group comprised 27 conditionally healthy children with a gestational age at birth of 34–36/6 weeks. The inclusion criteria were a gestational age at birth of 32–33/6 weeks and severe perinatal pathology. The exclusion criteria were as follows: a gestational age at birth of less than 32 weeks or above 37 weeks, congenital malformations, and neonatal sepsis. In addition to the conventional methods of clinical and laboratory examination of newborns, indicators of intracellular energy exchange were determined: glycerol-3-phosphate dehydrogenase (GPDH) (EC 1.1.99.5), succinate dehydrogenase (SDH) (EC 1.3.99.1) and NADH (nicotinamide adenine dinucleotide, reduced form) dehydrogenase (EC 1.6.5.3) in lymphocytes, lactate, pyruvate and the lactate/pyruvate ratio in blood serum. The values of SDH, GPDH and NADH were employed in order to calculate the aerobic respiration (AR) rate and electron transport chain (ETC) coefficient. The statistical processing of the study results was conducted using the software package Statistica (StatSoft Inc., USA, version 10). A Student’s t-test was employed for the comparison of quantitative indicators with normal distribution, at a significance level of p < 0.05 and p < 0.001. The qualitative differences between the comparison groups were assessed with the MedCalc software package (Statistical Software Package for Biomedical Research, 2023, version 16.1). Results. The findings demonstrated significant alterations in energy exchange in preterm infants subjected to hypoxic conditions in the context of severe perinatal pathology. In particular, a reduction in pyruvate levels accompanied by an increase in the lactate/pyruvate ratio suggests an insufficient energy exchange and the dominance of anaerobic glycolysis. Additionally, alterations in the activity of mitochondrial respiratory chain enzymes, including a decline in GPDH, an increase in SDH, a decrease in NADH, and a reduction in the AR rate accompanied by an increase in the ETC coefficient, were observed. The results of statistical receiver operating characteristic analysis of the laboratory indicators of energy exchange demonstrated a satisfactory level of sensitivity and specificity suggesting the potential utility of these parameters in perinatal pathology in preterm infants. Conclusions. The use of laboratory indicators of energy exchange, along with the conventional methods for additional paraclinical examination, will facilitate the prompt rectification of therapeutic measures, thereby enhancing the efficacy of medical care for preterm infants. This is achieved by the realignment of oxygen therapy measures at the intensive care stage. Furthermore, it provides a scientific foundation for the search for pharmacotherapeutic agents to control mitochondrial respiration disorders in conditions of hypoxic damage to the body.
новонароджені; передчасне народження; недоношені діти; гіпоксія; мітохондріальне дихання; енергетичний обмін
newborns; premature birth; preterm infants; hypoxia; mitochondrial respiration; energy exchang
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Ohuma E, Moller A-B, Bradley E, Chakwera S, Hussain-Alkhateeb L, Lewin A, et al. National, regional, and worldwide estimates of preterm birth in 2020, with trends from 2010: a systematic analysis. Lancet. 2023;402(10409):1261-71. DOI: https://doi.org/10.1016/s0140-6736(23)00878-4.
- Яблонь О.С., Саврун Т.І., Назарчук Н.М., Сергета Д.П., Холод Л.П., та ін. Особливості перебігу неонатального періоду у передчасно народжених дітей з масою тіла < 1500 г залежно від стану плаценти. Неонатологія, хірургія та перинатальна медицина. 2020;2(36):37-44. DOI: https://doi.org/10.24061/2413-4260.X.2.36.2020.4.
- Baburamani AA, Ek CJ, Walker DW, Castillo-Melendez M. Vulnerability of the developing brain to hypoxic-ischemic damage: contribution of the cerebral vasculature to injury and repair? Front Physiol [Internet]. 2012 [cited 2024 Jan 12];3:424. Available from: https://www.frontiersin.org/journals/physiology/articles/10.3389/fphys.2012.00424/full DOI: https://doi.org/10.3389/fphys.2012.00424.
- Millar LJ, Shi L, Hoerder-Suabedissen A, Molnár Z. Neonatal Hypoxia Ischaemia: Mechanisms, Models, and Therapeutic Challenges. Front Cell Neurosci [Internet]. 2017 [cited 2024 Jan 17];11:78. Available from: https://www.frontiersin.org/journals/cellular-neuroscience/articles/10.3389/fncel.2017.00078/full. DOI: https://doi.org/10.3389/fncel.2017.00078.
- Godovanets OS. Some features of cellular energy supply of the body in premature infants with severe forms of perinatal pathology. Neonatology, surgery and perinatal medicine. 2024;14(1):17-23. DOI: https://doi.org/10.24061/2413-4260.XIV.1.51.2024.3.
- Samaiya PK, Krishnamurthy S, Kumar A. Mitochondrial dysfunction in perinatal asphyxia: role in pathogenesis and potential therapeutic interventions. Mol Cell Biochem. 2021;476(12):4421-34. DOI: https://doi.org/10.1007/s11010-021-04253-8.
- He L, Tronstad KJ, Maheshwari A. Mitochondrial Dynamics during Development. Newborn (Clarksville). 2023;2(1):19-44. DOI: https://doi.org/10.5005/jp-journals-11002-0053.
- Greco P, Nencini G, Piva I, Scioscia M, Volta CA, Spadaro S, et al. Pathophysiology of hypoxic-ischemic encephalopathy: a review of the past and a view on the future. Acta Neurol Belg. 2020;120(2):277-88. DOI: https://doi.org/10.1007/s13760-020-01308-3.
- Piešová M, Mach M. Impact of perinatal hypoxia on the developing brain. Physiological research. 2020;69(2):199-213. DOI: https://doi.org/10.33549/physiolres.934198.
- Bale G, Mitra S, de Roever I, Sokolska M, Price D, Bainbridge A, et al. Oxygen dependency of mitochondrial metabolism indicates outcome of newborn brain injury. J Cereb Blood Flow Metab. 2019;39(10):2035-47. DOI: https://doi.org/10.1177/0271678x18777928.
- Perez M, Robbins ME, Revhaug C, Saugstad OD. Oxygen radical disease in the newborn, revisited: Oxidative stress and disease in the newborn period. Free Radic Biol Med. 2019;142:61-72. DOI: https://doi.org/10.1016/j.freeradbiomed.2019.03.035.
- Lembo C, Buonocore G, Perrone S. Oxidative Stress in Preterm Newborns. Antioxidants [Internet]. 2021 [cited 2024 Jan 8];10(11):1672. Available from: https://www.mdpi.com/2076-3921/10/11/1672. DOI: https://doi.org/10.3390/antiox10111672.
- Гонський Я.І., Саюк Н.П., Рубіна Л.М., Гонський Я.І., редактор. Біологічна хімія: лабораторний практикум. Тернопіль: –Укрмедкнига, 2001. 288 с.
- Herrmann JM, Riemer J. Apoptosis inducing factor and mitochondrial NADH dehydrogenases: redox-controlled gear boxes to switch between mitochondrial biogenesis and cell death. Biol Chem. 2020;402(3):289-97. DOI: https://doi.org/10.1515/hsz-2020-0254.
- Rai M, Carter SM, Shefali SA, Mahmoudzadeh NH, Pepin R, Tennessen JM. The Drosophila melanogaster enzyme glycerol-3-phosphate dehydrogenase 1 is required for oogenesis, embryonic development, and amino acid homeostasis. G3 [Internet]. 2022 [cited 2024 Mar 9];12(8):jkac115. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9339270/ DOI: https://doi.org/10.1093/g3journal/jkac115.
- Rousset CI, Baburamani AA, Thornton C, Hagberg H. Mitochondria and perinatal brain injury. J Matern Fetal Neonatal Med. 2012;25(Suppl 1):35-8. DOI: https://doi.org/10.3109/14767058.2012.666398.
- Shah PS, Barrett J, Claveau M, Cieslak Z, Makary H, Monterrosa L, et al. Association of umbilical cord blood gas values with mortality and severe neurologic injury in preterm neonates <29 weeks' gestation: a national cohort study. Am J Obstet Gynecol [Internet]. 2022 [cited 2024 May 4];227(1):85.e1-85.e10. Available from: https://www.ajog.org/article/S0002-9378(22)00003-5/abstract. DOI: https://doi.org/10.1016/j.ajog.2022.01.001.
- Yilmaz A, Cebi MN, Yilmaz G, Karacaoglu G, Aydin SN, Perk Y, et al. Long-term neurodevelopmental effects of exclusively high cord lactate levels in term newborn. J Matern Fetal Neonatal Med. 2023;36(2):2284115. DOI: https://doi.org/10.1080/14767058.2023.2284115.
- Kalpage HA, Wan J, Morse PT, Zurek MP, Turner AA, Khobeir A, et al. Cytochrome c phosphorylation: Control of mitochondrial electron transport chain flux and apoptosis. Int J Biochem Cell Biol [Internet]. 2020 [cited 2024 Mar 4];121:105704. Available from: https://linkinghub.elsevier.com/retrieve/pii/S1357-2725(20)30021-2. DOI: https://doi.org/10.1016/j.biocel.2020.105704.
- Saugstad OD. Oxygenation of the newborn. The impact of one molecule on newborn lives. J Perinat Med. 2022;51(1):20-6. DOI: https://doi.org/10.1515/jpm-2022-0259.
- Cannavò L, Perrone S, Viola V, Marseglia L, Di Rosa G, Gitto E. Oxidative Stress and Respiratory Diseases in Preterm Newborns. Int J Mol Sci [Internet]. 2021 [cited 2024 Jan 19];22(22):12504. Available from: https://www.mdpi.com/1422-0067/22/22/12504. DOI: 10.3390/ijms222212504.
- de Almeida VO, Pereira RA, Amantéa SL, Rhoden CR, Colvero MO. Neonatal diseases and oxidative stress in premature infants: an integrative review. J Pediatr (Rio J). 2022;98(5):455-62. DOI: https://doi.org/10.1016/j.jped.2021.11.008
- Perrone S, Laschi E, Buonocore G. Oxidative stress biomarkers in the perinatal period: Diagnostic and prognostic value. Semin Fetal Neonatal Med [Internet]. 2020 [cited 2024 Jan 9];25(2):101087. Available from: https://www.sfnmjournal.com/article/S1744-165X(20)30012-3/abstract. DOI: https://doi.org/10.1016/j.siny.2020.101087.
- Graziosi A, Perrotta M, Russo D, Gasparroni G, D'Egidio C, Marinelli B, Di et al. Oxidative Stress Markers and the Retinopathy of Prematurity. J Clin Med [Internet]. 2020 [cited 2024 May 3];9(9):2711. Available from: https://www.mdpi.com/2077-0383/9/9/2711. DOI: https://doi.org/10.3390/jcm9092711.
- Gonzaléz-Candia A, Arias PV, Aguilar SA, Figueroa EG, Reyes RV, Ebensperger G, et al. Melatonin Reduces Oxidative Stress in the Right Ventricle of Newborn Sheep Gestated under Chronic Hypoxia. Antioxidants (Basel) [Internet]. 2021 [cited 2024 Mar 27];10(11):1658. Available from: https://www.mdpi.com/2076-3921/10/11/1658. DOI: https://doi.org/10.3390/antiox10111658.
- Dantas GN, Santarosa BP, Santos VH, Hooper HB, Micai RA, Sinzato YK, et al. Oxidative stress biomarkers in newborn calves: Comparison among artificial insemination, in vitro fertilization and cloning. Anim Reprod Sci [Internet]. 2020[cited 2024 Mar 7];219:106538. Available from: https://www.sciencedirect.com/science/article/abs/pii/S0378432020304103?via%3Dihub. DOI: https://doi.org/10.1016/j.anireprosci.2020.106538.
- Moore TA, Ahmad IM, Zimmerman MC. Oxidative Stress and Preterm Birth: An Integrative Review. Biol Res Nurs. 2018;20(5):497-512. DOI: https://doi.org/10.1177/1099800418791028.