Журнал «Здоровье ребенка» Том 19, №5, 2024
Вернуться к номеру
Клініко-прогностичне значення нейросонографії бічних шлуночків для дітей першого року життя, які лікувались в ранньому неонатальному періоді з використанням лікувальної гіпотермії
Авторы: Мавропуло Т.К. (1), Соломенко М.В. (2)
(1) - Дніпровський державний медичний університет, м. Дніпро, Україна
(2) - Європейський медичний університет, м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
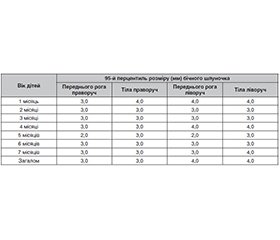
Актуальність. На сьогодні лікувальна гіпотермія (ЛГ) є єдиним схваленим методом лікування гіпоксично-ішемічної енцефалопатії (ГIE), який допомагає поліпшити наслідки, але цей метод має і серйозні недоліки, зокрема необхідність дорогого обладнання та технологій лікування, погано зрозумілі патофізіологічні механізми, а головне — не завжди добре зрозумілі віддалені результати. Численні наукові дослідження повідомляють про потенційну користь використання ЛГ, але реальне співвідношення ризику/користі ще залишається невідомим. Варіабельними є результати тривалого катамнестичного спостереження дітей, які пройшли ЛГ і не мали серйозних нейромоторних або інтелектуальних порушень. Вважають, що кореляція між неонатальною нейровізуалізацією та ступенем порушення стану нервової системи залишається мало визначеною. Більш прогностично значущими видаються діагностовані за межами неонатального періоду хронічні ураження мозку, як-от втрата об’єму паренхіми, відображенням чого може бути помірне збільшення розмірів шлуночкової системи мозку. Метод визначення розміру шлуночкової системи за допомогою ультразвукового дослідження може бути доступним для немовлят першого року життя, які перенесли ГІЕ, але не мають прямих показань для виконання МРТ. Отже, метою роботи було дослідження особливостей стану шлуночкової системи мозку у дітей першого року життя, які мали тяжку асфіксію при народженні, залежно від способу надання післяреанімаційної допомоги (з ЛГ чи без ЛГ). Матеріали та методи. Вивчались результати нейросонографічного обстеження 309 немовлят протягом першого року життя. Критеріями включення були: гестаційний вік при народженні ≥ 36 тижнів і маса тіла ≥ 2000 г, прояви ГІЕ в ранньому неонатальному періоді без несприятливих короткострокових наслідків (на момент виписки з неонатального стаціонару діти не мали ознак деструктивних гіпоксично-ішемічних уражень ЦНС, судом та патологічного м’язового тонусу, мали повноцінне пероральне харчування). Критеріями виключення були діагностовані вроджені вади нервової системи, перенесені нейроінфекції, затримка психомоторного розвитку в перший рік життя більше ніж 3 місяці, прогресуюча вентрикуломегалія обструктивного характеру чи пов’язана з субарахномегалією неатрофічного характеру. Діти були розподілені на три групи: група гіпотермії — 19 немовлят, яким проводилася ЛГ після народження; група нормотермії — 14 дітей, які умовно мали показання для ЛГ, але гіпотермія їм не проводилась; група порівняння — 276 дітей першого року життя, які не потребували проведення ЛГ (мали оцінку за шкалою Апгар на 10-й хвилині життя > 5 балів, прояви легкої чи помірної ГІЕ (згідно зі шкалою Sarnat) протягом перших днів життя). Нейросонографічне обстеження проводилось у віці 2–7 місяців життя (середній вік його проведення 2,12 ± 0,07 міс.). Розміри бічних шлуночків оцінювались порівняно з результатами обстеження немовлят контрольної групи відповідного віку (34 здорові дитини, у яких не зареєстровані фактори обтяженого перебігу перинатального періоду, ознаки неврологічної дисфункції протягом неонатального періоду та семимісячного терміну спостереження). Розширення бічних шлуночків реєструвалось у тому випадку, коли розмір переднього рога чи тіла шлуночка в парасагітальній проєкції перевищував 95-й перцентиль відповідних вимірювань контрольної групи. Результати. Розширення бічних шлуночків під час нейросонографічного обстеження виявлялось у 36,8 % дітей групи гіпотермії, 14,3 % дітей групи нормотермії та 8,0 % дітей групи порівняння. Вірогідні відмінності реєструвались тільки при порівнянні результатів обстеження груп гіпотермії та групи порівняння (р < 0,05, підрахунок критерію Фішера). Виявлялись вірогідні кореляційні зв’язки (р < 0,05) між розмірами бічних шлуночків і такими клінічними ознаками, як порушення сну, зниження м’язового тонусу рук, пожвавлення сухожильних рефлексів, темпова затримка рухового розвитку, підвищення м’язового тонусу за пірамідним типом, дифузна м’язова гіпотонія. Висновки. Таким чином, немовлята, які мали тяжку асфіксію при народженні і яким проводилась ЛГ, вірогідно частіше мали розширення шлуночкової системи мозку (проти групи порівняння). Отже, хоча проведення лікувальної гіпотермії поліпшує наслідки для розвитку нервової системи у дітей, які мали помірну та тяжку гіпоксично-ішемічну енцефалопатію, морфологія мозку (зокрема, стан шлуночкової системи) все одно може бути зміненою у дітей першого року життя. А наявність вірогідних кореляційнійних зв’язків між розмірами бічних шлуночків і клінічними ознаками неврологічної дисфункції аргументує подальше клінічне спостереження дітей після лікувальної гіпотермії протягом перших років життя й за відсутності короткострокових несприятливих наслідків ГІЕ чи вираженої затримки психомоторного розвитку на першому році життя.
Background. Currently, therapeutic hypothermia (TH) is the only approved method for treating hypoxic-ischemic encephalopathy (HIE) that helps improve outcomes. However, it also has significant drawbacks, including the necessity for expensive equipment and treatment technologies, poorly understood pathophysiological mechanisms, and, most importantly, not always well-understood long-term results. Numerous scientific studies report the potential benefits of TH, but the actual risk/benefit ratio is still unknown. The results of long-term follow-up of children who underwent TH and did not have serious neuromotor or intellectual disorders are variable. It is believed that the correlation between neonatal neuroimaging and the degree of nervous system impairment remains poorly defined. Chronic brain injuries diagnosed after the neonatal period, such as parenchymal volume loss, appear to be more prognostically significant, which may be reflected by moderate enlargement of the ventricular system of the brain. The method for determining the size of the ventricular system using ultrasound can be accessible for infants of the first year of life who had HIE but do not have direct indications for magnetic resonance imaging. Therefore, this study aimed to explore the characteristics of the cerebral ventricular system in infants of the first year of life who suffered severe asphyxia at birth, depending on the method of post-resuscitation care (with or without TH). Materials and methods. The study examined the results of neurosonographic examinations of 309 infants during their first year of life. Inclusion criteria were gestational age at birth ≥ 36 weeks and birth weight ≥ 2000 g, manifestations of HIE in the early neonatal period without adverse short-term outcomes (at the time of discharge from the neonatal hospital, the children showed no signs of destructive hypoxic-ischemic lesions of the central nervous system (CNS), seizures, or pathological muscle tone, and had full oral feeding). Exclusion criteria were diagnosed congenital CNS abnormalities, neuroinfections, psychomotor development delay of more than 3 months during the first years of life, progressive obstructive ventriculomegaly or ventriculomegaly associated with non-atrophic subarachnomegaly. The children were divided into three groups: hypothermia group — 19 infants who underwent TH after birth; normothermia group — 14 children who conditionally had indications for TH but did not undergo it; comparison group — 276 children in their first year of life who did not require TH (Apgar score > 5 at 10 minutes of life, manifestations of mild or moderate HIE (according to the Sarnat scale) during the first days of life). Neurosonographic examinations were conducted at the age of 2–7 months (mean of 2.12 ± 0.07 months). The sizes of the lateral ventricles were assessed in comparison with the results from the control group of infants of the same age (34 healthy children with no recorded factors of complicated perinatal period, no signs of neurological dysfunction during the neonatal period, and the seven-month observation). Enlargement of the lateral ventricles was recorded when the size of the anterior horn or body of the ventricle in the parasagittal projection exceeded the 95th percentile of the corresponding measurements from the control group. Results. Enlargement of the lateral ventricles during the neurosonographic examination was detected in 36.8 % of children in the hypothermia group, 14.3 % in the normothermia group, and 8.0 % of children in the comparison group. Significant differences were registered only when comparing the results of the hypothermia group with the comparison group (p < 0.05, Fisher’s exact test). Significant correlations (p < 0.05) were found between the size of the lateral ventricles and clinical signs such as sleep disturbances, decreased muscle tone in the arms, increased tendon reflexes, delayed motor development, increased muscle tone in a pyramidal pattern, and diffuse muscle hypotonia. Conclusions. Thus, infants who had severe asphyxia at birth and underwent TH significantly more often had enlargement of the cerebral ventricular system (versus the comparison group). Therefore, although therapeutic hypothermia improves outcomes for the development of the nervous system in children who have moderate and severe hypoxic-ischemic encephalopathy, brain morphology (particularly the state of the ventricular system) may still be altered in infants during the first year of life. And the presence of significant correlations between the size of the lateral ventricles and clinical signs of neurological dysfunction argues for further clinical monitoring of children after therapeutic hypothermia throughout the first years of life and in the absence of short-term adverse outcomes of HIE or significant delays in psychomotor development during the first year of life.
гіпоксично-ішемічна енцефалопатія; лікувальна гіпотермія; нейросонографія; розширені шлуночки мозку; новонароджені; немовлята
hypoxic-ischemic encephalopathy; therapeutic hypothermia; neurosonography; enlarged brain ventricles; newborns; infants