Журнал «Здоровье ребенка» Том 19, №5, 2024
Вернуться к номеру
Ефективність Bacillus clausii UBBC-07 у профілактиці антибіотик-асоційованої діареї в дітей
Авторы: Бекетова Г.В. (1), Койро О.О. (2), Богданова С.С. (3), Булгакова М.С. (4), Георгіца К.М. (5), Ільків О.Б. (6), Кавка О.Р. (7), Кміть О.З. (8), Кухар О.В. (9), Любецька В.І. (9), Малейко В.В. (10), Матюхіна І.А. (11), Медведська К.О. (12), Павчак Н.Б. (13), Перчеклій К.А. (14), Семенчук В.В. (15), Сотніченко Я.О. (16), Томащук У.М. (17), Цвинда Н.І. (18), Шаліманова М.Є. (19)
(1) - Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
(2) - Національний фармацевтичний університет, м. Харків, Україна
(3) - КНП «Дитяча міська поліклініка № 6» Одеської міської ради, м. Одеса, Україна
(4) - Медичний центр «Здорова нація», м. Дніпро, Україна
(5) - Амбулаторія № 4 Дніпровського центру первинної медико-санітарної допомоги № 10, м. Дніпро, Україна
(6) - Поліклініка Пустомитівської центральної районної лікарні, м. Пустомити, Львівська область, Україна
(7) - КНП «2-а міська поліклініка», м. Львів, Україна
(8) - Поліклініка Мостиської комунальної центральної районної лікарні, м. Мостиська, Львівська область, Україна
(9) - Дитяча міська поліклініка № 5, м. Одеса, Україна
(10) - Амбулаторія № 2 Центру первинної медико-санітарної допомоги № 3, м. Вінниця, Україна
(11) - КНП «Дитяча поліклініка Чорноморської лікарні», м. Чорноморськ, Одеська область, Україна
(12) - Амбулаторія загальної практики — сімейної медицини, с. Стрижавка, Вінницька область, Україна
(13) - Поліклініка Городенківської центральної районної лікарні, м. Городенка, Івано-Франківська обл., Україна
(14) - Дитяча міська поліклініка № 6, м. Одеса, Україна
(15) - Уланівська районна лікарня Хмільницької центральної районної лікарні, с. Уланів, Вінницька обл., Україна
(16) - Чернігівська міська сімейна поліклініка № 2, м. Чернігів, Україна
(17) - Філія Чернівецької міської дитячої поліклініки, м. Чернівці, Україна
(18) - Поліклініка Уманської дитячої міської лікарні, м. Умань, Черкаська обл., Україна
(19) - КНП «Перший Черкаський міський центр первинної медико-санітарної допомоги», м. Черкаси, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
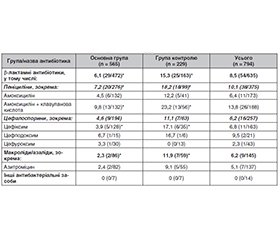
Оцінено ефективність оральної суспензії Пробіз® DUO, що містить спори пробіотичного штаму Bacillus clausii UBBC-07, у профілактиці антибіотик-асоційованої діареї. Проаналізовано результати лікування 939 пацієнтів віком від 28 днів до 18 років з бактеріальними інфекціями різної локалізації, що отримували системну антибактеріальну терапію. Пацієнтів, які приймали Bacillus clausii UBBC-07 разом із антибіотиками (671 пацієнт), було віднесено до основної групи; пацієнтів, які не отримували пробіотик на фоні антибіотикотерапії (268 пацієнтів), — до контрольної групи. Результати лікування було оцінено в 794 пацієнтів (565 пацієнтів основної групи, 229 пацієнтів групи контролю), для яких був відомим призначений антибактеріальний засіб. В основній групі вірогідно рідше порівняно з контрольною відзначався розвиток порушень з боку травного тракту, а саме діареї (5,5 проти 14,0 %) і болю в животі (3,7 проти 7,4 %). Профілактичний прийом пробіотика зменшував частоту формування ААД загалом у 2,5 раза, а серед пацієнтів, які отримували пеніциліни, — у 2,5 раза, цефалоспорини — у 2,4 раза, макроліди — у 5,1 раза. Використання Bacillus clausii UBBC-07 також зменшувало тривалість рідких випорожнень у пацієнтів з діареєю (1,84 дня в основній групі проти 2,66 дня в контрольній групі) і середню кількість днів наявності болю в животі в пацієнтів зі скаргами на абдомінальний дискомфорт (1,25 дня проти 1,71 дня відповідно). Отже, застосування Bacillus clausii UBBC-07 з першого дня антибактеріальної терапії в дітей сприяє ефективній профілактиці антибіотик-асоційованої діареї, що суттєво підвищує якість життя пацієнтів, прискорює їх відновлення і зменшує імовірність виникнення ускладнень.
The effectiveness of the oral suspension Probeez® DUO, containing spores of the probiotic strain Bacillus clausii UBBC-07, was evaluated in the prevention of antibiotic-associated diarrhea. The study analyzed the treatment outcomes of 939 patients aged 28 days to 18 years with bacterial infections of various localizations, receiving systemic antibacterial therapy. Patients who took Bacillus clausii UBBC-07 simultaneously with antibiotics (n = 671) were assigned to the treatment group, while those who did not receive the probiotic on the background of antibiotic therapy (n = 268) were included in the control group. The treatment outcomes were evaluated in 794 patients (565 from the treatment group and 229 controls), for whom the prescribed antibacterial agent was known. In the treatment group, there was a significantly lower incidence of gastrointestinal disturbances compared to the control group, specifically diarrhea (5.5 vs. 14.0 %) and abdominal pain (3.7 vs. 7.4 %). Prophylactic use of the probiotic reduced the frequency of developing antibiotic-associated diarrhea in general by 2.5 times, with a reduction of 2.5 times among patients receiving penicillins, of 2.4 times among those treated with cephalosporins, and of 5.1 times for those who took macrolides. Bacillus clausii UBBC-07 also decreased the duration of loose stools in patients with diarrhea (1.84 days in the treatment group vs. 2.66 days in the control one) and the average number of days with abdominal pain in those who reported discomfort (1.25 vs. 1.71 days, respectively). Thus, the use of Bacillus clausii UBBC-07 from the first day of antibacterial therapy in children contributes to the effective prevention of antibiotic-associated diarrhea, significantly improving patients’ quality of life, accelerating their recovery, and reducing the likelihood of complications.
антибіотик-асоційована діарея; пробіотики-біоентеросептики; Bacillus clausii UBBC-07; Пробіз® DUO
antibiotic-associated diarrhea; probiotics-bioenteroseptics; Bacillus clausii UBBC-07; Probeez® DUO
Вступ
Матеріали та методи
Результати дослідження та їх обговорення
Висновки
- Бекетова Г.В., Брюханова Т.О., Литкін Д.В. Біоентеросептики — наступний виток еволюції засобів для підтримки нормальної мікрофлори кишечника. Здоров’я дитини. 2023. Т. 18. № 6. С. 64-73.
- Acosta-Rodríguez-Bueno CP, Abreu Y Abreu AT et al. Bacillus clausii for Gastrointestinal Disorders: A Narrative Literature Review. Adv Ther. 2022;39(11):4854-4874.
- Ahire JJ, Kashikar MS, Madempudi RS. Survival and Germination of Bacillus clausii UBBC07 Spores in in vitro Human Gastrointestinal Tract Simulation Model and Evaluation of Clausin Production. Front Microbiol. 2020;11:1010.
- Blaabjerg S, Artzi DM, Aabenhus R. Probiotics for the Prevention of Antibiotic-Associated Diarrhea in Outpatients — A Systematic Review and Meta-Analysis. Antibiotics (Basel). 2017;6(4):21.
- Ghelardi E, Abreu Y, Abreu AT et al. Current Progress and Future Perspectives on the Use of Bacillus clausii. Microorganisms. 2022;10(6):1246.
- Goldenberg JZ, Lytvyn L, Steurich J et al. Probiotics for the prevention of pediatric antibiotic-associated diarrhea. Cochrane Database of Systematic Reviews. 2015;12:CD004827.
- Goodman C, Keating G, Georgousopoulou E et al. Probiotics for the prevention of antibiotic-associated diarrhoea: a systematic review and meta-analysis. BMJ Open. 2021;11(8):e043054.
- Gupta A, Ananthakrishnan AN. Economic burden and cost-effectiveness of therapies for Clostridiodes difficile infection: a narrative review. Therap Adv Gastroenterol. 2021;14:17562848211018654.
- Hill C, Guarner F, Reid G et al. Expert consensus document. The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat Rev Gastroenterol Hepatol. 2014;11(8):506-514.
- Huang H, Li L, Wu M et al. Antibiotics and antibiotic-associated diarrhea: a real-world disproportionality study of the FDA adverse event reporting system from 2004 to 2022. BMC Pharmacol. Toxicol. 2023;24(1):73.
- Hutchings MI, Truman AW, Wilkinson B. Antibiotics: past, pre–sent and future. Curr Opin Microbiol. 2019;51:72-80.
- Ianiro G, Rizzatti G, Plomer M et al. Bacillus clausii for the Treatment of Acute Diarrhea in Children: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Nutrients. 2018;10(8):1074.
- Javanshir N, Hosseini GNG, Sadeghi M et al. Evaluation of the Function of Probiotics, Emphasizing the Role of their Binding to the Intestinal Epithelium in the Stability and their Effects on the Immune System. Biol Proced Online. 2021;23(1):23.
- Kelly СP, Lamont JT. Antibiotic-Associated Diarrhea, Pseudomembranous Enterocolitis, and Clostridium difficile-Associated Diarrhea and Colitis. Sleisenger and Fordtran’s Gastrointestinal and Liver Disease: 9th Edition. Eds. M Feldman, LS Friedman, LJ Brandt. Philadelphia: W.B. Saunders, 2010:1889-1903.e5.
- Kesavelu D, Jog P. Current understanding of antibiotic-associated dysbiosis and approaches for its management. Ther Adv Infect Dis. 2023;10:20499361231154443.
- Kopacz K, Phadtare S. Probiotics for the Prevention of Antibiotic-Associated Diarrhea. Healthcare (Basel). 2022;10(8):1450.
- Krutova M, Wilcox M, Kuijper E. Clostridioides difficile infection: are the three currently used antibiotic treatment options equal from pharmacological and microbiological points of view? Int J Infect. Dis. 2022;124:118-123.
- Lakshmi SG, Jayanthi N, Saravanan M et al. Safety assesment of Bacillus clausii UBBC07, a spore forming probiotic. Toxicol Rep. 2017;4:62-71.
- Madempudi RS et al. Bacillus clausii UBBC-07 in the symptom management of upper respiratory tract infections in children: a double blind, placebo-controlled randomised study. Beneficial Microbes. 2022;13(4):331-339.
- Maity C, Gupta AK. Therapeutic efficacy of probiotic Alkalihalobacillus clausii 088AE in antibiotic-associated diarrhea: a randomized controlled trial. Heliyon. 2021;7(9):e07993.
- McFarlin BK, Henning AL, Bowman EM et al. Oral spore-based probiotic supplementation was associated with reduced incidence of post-prandial dietary endotoxin, triglycerides, and disease risk biomarkers. World Journal of Gastrointestinal Pathophysiology. 2017;8(3):117.
- Mekonnen SA, Merenstein D, Fraser CM et al. Molecular mecha–nisms of probiotic prevention of antibiotic-associated diarrhea. Curr Opin Biotechnol. 2020;61:226-234.
- Motamedi H, Fathollahi M, Abiri R et al. A worldwide systematic review and meta-analysis of bacteria related to antibiotic-associated diarrhea in hospitalized patients. PLoS One. 2021;16(12):e0260667.
- Petrariu OA, Barbu IC, Niculescu AG et al. Role of probiotics in managing various human diseases, from oral pathology to cancer and gastrointestinal diseases. Front Microbiol. 2024;14:1296447.
- Rafey A, Jahan S, Farooq U et al. Antibiotics Associated With Clostridium difficile Infection. Cureus. 2023;15(5):e39029.
- Ramirez J, Guarner F, Bustos Fernandez L et al. Antibio–tics as Major Disruptors of Gut Microbiota. Front Cell Infect Microbiol. 2020;10:572912.
- Sudha MR, Jayanthi N, Pandey DC et al. Bacillus clausii –UBBC-07 reduces severity of diarrhoea in children under 5 years of age: a double blind placebo controlled study. Benef Microbes. 2019;10(2):149-154.
- Urdaci MC, Bressollier P, Pinchuk I. Bacillus clausii probiotic strains: antimicrobial and immunomodulatory activities. J Clin Gastroenterol. 2004;38(6 Suppl):S86-90.
- Wiström J, Norrby SR, Myhre EB et al. Frequency of antibiotic-associated diarrhoea in 2462 antibiotic-treated hospitalized patients: a prospective study. J Antimicrob Chemother. 2001;47(1):43-50.
- Wong-Chew RM, de Castro JA, Morelli L et al. Gut immune homeostasis: the immunomodulatory role of Bacillus clausii, from basic to clinical evidence. Expert Rev Clin Immunol. 2022;18(7):717-729.
- Zhang L, Zeng X, Guo D et al. Early use of probiotics might prevent antibiotic-associated diarrhea in elderly (> 65 years): a systematic review and meta-analysis. BMC Geriatr. 2022;22(1):562.

/64.jpg)
/65.jpg)
/66.jpg)
/67.jpg)
/67_2.jpg)