Международный эндокринологический журнал Том 20, №6, 2024
Вернуться к номеру
Використання імуногістохімічного маркера НВМЕ-1 для оптимізації діагностики фолікулярних карцином
Авторы: Нечай О.П., Белемець Н.І., Гузь О.О., Квітка Д.М., Товкай О.А., Глоба Є.В.
Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
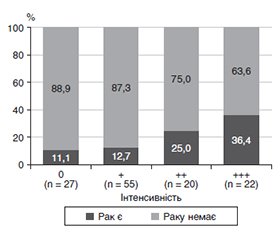
Актуальність. У клінічній практиці нерідко трапляються пацієнти з діагнозами доброякісної фолікулярної аденоми (ФА) і фолікулярної пухлини з невизначеним потенціалом злоякісності, що повинні бути змінені на діагнози злоякісних процесів через рецидив чи метастазування, які спостерігаються із часом. Мета: оптимізувати диференціальну діагностику між ФА і фолікулярною карциномою щитоподібної залози (ЩЗ) шляхом використання імуногістохімічного (ІГХ) маркера НВМЕ-1 на гістологічному матеріалі хворих, які були прооперовані з приводу вузлового зоба з цитологічним висновком за класифікацією Bethesda ІІІ, IV, V. Матеріали та методи. Досліджено 124 хворі, які були прооперовані з приводу фолікулярних вузлових новоутворень з цитологічним висновком за Bethesda Gray zone і мали гістологічний висновок: фолікулярна карцинома щитоподібної залози — 23 (18,55 %); ФА — 101 (81,45 %). Проведений ІГХ аналіз з використанням мишачих моноклональних антитіл проти людського HBME-1 (Bio SB, США). Критерії оцінки відповідали силі забарвлення (від 0 до 3). Результати. За силою інтенсивності ІГХ забарвлення простежується збільшення відсотка діагнозу фолікулярної карциноми ЩЗ (p < 0,05): 0 — 0 %, 1 — 12,7 %, 2 — 25 %, 3 — 36,4 %. Повторно переглянуті патогістологічні висновки щодо ФА, які мали найсильнішу реакцію забарвлення. При цьому в трьох (2,97 %) випадках діагноз був змінений на фолікулярну карциному ЩЗ. Відповідно загальна кількість встановлених випадків фолікулярної карциноми ЩЗ збільшилася до 26 (20,96 %). Ці випадки показали добрий позитивний результат застосування ІГХ дослідження з HMBE-1 на препаратах ФА з метою діагностичного пошуку фолікулярної карциноми ЩЗ. Висновки. HBME-1 може слугувати ІГХ маркером для диференціальної діагностики між ФА і фолікулярною карциномою ЩЗ щодо випадків, які діагностувались як ФА, оскільки після проведеного дослідження у 2,97 % хворих діагноз був змінений на фолікулярну карциному ЩЗ.
Background. In clinical practice, there are often patients with a diagnosis of benign follicular adenoma (FA) and follicular tumor with an uncertain malignant potential, whose diagnoses must be changed to malignant processes due to relapse or metastasis observed over time. The purpose of the study was to optimize the differential diagnosis of FA and follicular thyroid carcinoma (FTC) using the immunohistochemical (IHC) marker HBME-1 on the histological material of patients who were operated for nodular goiter with a cytological conclusion corresponding to the Bethesda categories III–V. Materials and methods. One hundred and twenty-four patients underwent surgery for follicular nodular neoplasms with a cytological conclusion according to Bethesda Gray zone and had a histological diagnosis of FTC in 23 cases (18.55 %) and FA in 101 cases (81.45 %). IHC analysis was performed using mouse monoclonal antibodies against human HBME-1 (Bio SB, USA). Evaluation criteria corresponded to the strength of staining (from 0 to 3). Results. According to the intensity of IHC staining, there was an increase in the diagnosis of FTC (p < 0.05): 0 — 0 %, 1 — 12.7 %, 2 — 25 %, 3 — 36.4 %. Histopathological findings were reexamined for FA that had the strongest staining reaction: in 3 (2.97 %) cases, the diagnosis was changed to FTC. Accordingly, the total number of detected FTC increased to 26 (20.96 %). These cases showed a good positive result regarding IHC study with HMBE-1 on FA preparations for a differential diagnosis between FA and FTC. Conclusions. HBME-1 can serve as an IHC marker for the differential diagnosis of FA and FTC in cases considered as FA, as after the study, the diagnosis was changed to FTC in 2.97 % of patients.
щитоподібна залоза; фолікулярна карцинома; фолікулярна пухлина з невизначеним потенціалом злоякісності; HBME-1
thyroid gland; follicular carcinoma; follicular tumor with an uncertain malignant potential; HBME-1
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Rong Y, Torres-Luna C, Tuszynski G, Siderits R, Chang FN. Differentiating Thyroid Follicular Adenoma from Follicular Carcinoma via G-Protein Coupled Receptor-Associated Sorting Protein 1 (GASP-1). Cancers (Basel). 2023 Jun 29;15(13):3404. doi: 10.3390/cancers15133404. PMID: 37444514; PMCID: PMC10340713.
- Ito Y, Hirokawa M, Hayashi T, Kihara M, Onoda N, Miya A, Miyauchi A. Clinical outcomes of follicular tumor of uncertain malignant potential of the thyroid: real-world data. Endocr J. 2022 Jul 28;69(7):757-761. doi: 10.1507/endocrj.EJ21-0723. Epub 2022 Jan 26. PMID: 35082189.
- Yassin Fel-Z. Diagnostic criteria of well differentiated thyroid tumor of uncertain malignant potential; a histomorphological and immunohistochemical appraisal. J Egypt Natl Canc Inst. 2015 Jun;27(2):59-67. doi: 10.1016/j.jnci.2015.02.003. Epub 2015 Mar 21. PMID: 25800580.
- Patel N, Bavikar R, Lad YP, Singh M, Dharwadkar A, Viswanathan V. A comparison of the WHO 2004 and WHO 2017 thyroid tumor classifications. J Cancer Res Ther. 2024 Jan 1;20(1):311-314. doi: 10.4103/jcrt.jcrt_1797_22. Epub 2023 Apr 6. PMID: 38554339.
- Juhlin CC, Bränström R, Shabo I, Höög A. Clear Cell Variant of a Follicular Thyroid Tumor With Uncertain Malignant Potential: A Case Report. Int J Surg Pathol. 2019 May;27(3):290-293. doi: 10.1177/1066896918809490. Epub 2018 Oct 29. PMID: 30370813.
- de Matos PS, Ferreira AP, de Oliveira Facuri F, Assumpção LV, Metze K, Ward LS. Usefulness of HBME-1, cytokeratin 19 and galectin-3 immunostaining in the diagnosis of thyroid malignancy. Histopathology. 2005 Oct;47(4):391-401. doi: 10.1111/j.1365-2559.2005.02221.x. PMID: 16178894.
- Abd-El Raouf SM, Ibrahim TR. Immunohistochemical expression of HBME-1 and galectin-3 in the differential diagnosis of follicular-derived thyroid nodules. Pathol Res Pract. 2014 Dec;210(12):971-8. doi: 10.1016/j.prp.2014.06.010. Epub 2014 Jun 27. PMID: 25041837.
- Han RL, Wang J, Zhang FJ, Zhao N, Gao BL. Ultrasound Risk Assessment Combined with Molecular Markers of Galectin-3, c-MET, HBME-1 and CK19 for Diagnosis of Malignant and Benign Thyroid Nodules. Pathol Oncol Res. 2019 Jul;25(3):1075-1081. doi: 10.1007/s12253-018-0485-6. Epub 2018 Oct 25. PMID: 30361909.
- Zhu X, Sun T, Lu H, Zhou X, Lu Y, Cai X, Zhu X. Diag–nostic significance of CK19, RET, galectin-3 and HBME-1 expression for papillary thyroid carcinoma. J Clin Pathol. 2010 Sep;63(9):786-9. doi: 10.1136/jcp.2010.076901. Epub 2010 Jul 19. PMID: 20644217.
- Yuan Y, Sun C, Yin T, Shao C, Pan B, Lu D, Hou S, et al. Comparison of endoscopic thyroidectomy by complete areola approach and conventional open surgery in the treatment of differentiated thyroid carcinoma: A retrospective study and meta-analysis. Front Surg. 2022 Dec 20;9:1000011. doi: 10.3389/fsurg.2022.1000011. PMID: 36605164; PMCID: PMC9807756.
- Feldkamp J, Führer D, Luster M, Musholt TJ, Spitzweg C, Schott M. Fine Needle Aspiration in the Investigation of Thyroid Nodules. Dtsch Arztebl Int. 2016 May 20;113(20):353-9. doi: 10.3238/arztebl.2016.0353. PMID: 27294815; PMCID: PMC4906830.
- Aysan E, Guler B, Kiran T, Idiz UO. Core Needle Biopsy in the Diagnosis of Thyroid Nodules. Am Surg. 2023 Dec;89(12):5170-5174. doi: 10.1177/00031348221142570. Epub 2022 Nov 23. PMID: 36416390.
- Giuliano S, Mirabelli M, Chiefari E, Vergine M, Gervasi R, Brunetti F, Innaro N. et al. Malignancy analysis of thyroid nodu–les in patients subjected to surgery with cytologcal and ultrasound based risk stratification. Endocrines. 2020;1(2):102-118; https://doi.org/10.3390/endocrines1020010.
- Baloch ZW, Harrell RM, Brett EM, Randolph G, Garber JR; AACE Endocrine Surgery Scientific Committee and Thyroid Scientific Committee. Managing thyroid tumors diagnosed as non-invasive follicular tumor with papillary like nuclear features (NIFTP). Endocr Pract. 2017. doi: 10.4158/EP171940.DSC. Epub ahead of print. PMID: 28704097.
- Trimboli P, Ferrarazzo G, Piccardo A, Lucchini B, Durante C. Operation rate and cancer prevalence among thyroid nodules with FNAC report of suspicious for malignancy (TIR4) or malignant (TIR5) according to Italian classification system: a systematic review and meta-analysis. Endocrine. 2022 Oct;78(1):24-31. doi: 10.1007/s12020-022-03165-x. Epub 2022 Aug 20. PMID: 35986840; PMCID: PMC9474526.
- Vella C, Baldacchino S, Formosa R, Vassallo J. The Utility of Galectin-3 and HBME-1 Immunohistochemical Expression in Thyroid Cancer in the Maltese Population. Endocrines. 2022;3(2):225-239; https://doi.org/10.3390/endocrines3020021.
- Abu-Seadah SS, Attiah SM, Ali MY, Shams El-Din M, El-Kholy MA. Immunohistochemical Expression of HBME-1 and TROP-2 in Some Follicular-Derived Thyroid Lesions. Asian Pac J Cancer Prev. 2023 Jul 1;24(7):2305-2311. doi: 10.31557/APJCP.2023.24.7.2305. PMID: 37505760; PMCID: PMC10676500.
- Rossi ED, Straccia P, Palumbo M, Stigliano E, Revelli L, Lombardi CP, Santeusanio G. et al. Diagnostic and prognostic role of HBME-1, galectin-3, and β-catenin in poorly differentiated and anaplastic thyroid carcinomas. Appl Immunohistochem Mol Morphol. 2013 May;21(3):237-41. doi: 10.1097/PAI.0b013e3182688d0f. PMID: 23235344.
- Murtezaoglu AR, Gucer H. Diagnostic value of TROP-2 expression in papillary thyroid carcinoma and comparison with HBME-1, galectin-3 and cytokeratin 19. Pol J Pathol. 2017;68(1):1-10. doi: 10.5114/pjp.2017.67610. PMID: 28547974.
- Nechay OP, Belemets NI, Palamarchuk VO, Kvitka DM, Kozachuk ES, Tovkai OA. Possibilities of immunocytochemical determination of HBME-1 expression in the diagnostic search for differentiated thyroid carcinoma. Clinical endocrinology and endocrine surgery. 2023;3(83):5-11. http://doi.org/10.30978/CEES-2023-3-5.