З огляду на те, що тривалість життя населення збільшується, зростає частка дорослого населення та людей похилого віку у популяції, з часом дедалі більше людей страждатимуть від когнітивного зниження, тому прогнозування та раннє запобігання когнітивному зниженню стає надзвичайно важливим, оскільки це значно впливає на якість життя та самостійність людини [1]. Тривалий стрес, до якого наразі схильна велика частка людської популяції, є потенційним фактором ризику зниження когнітивних функцій. Хронічний стрес може негативно впливати на здоров’я мозку та когнітивне функціонування за допомогою двох механізмів: опосередковано через інші пов’язані зі стресом розлади та поведінку [2, 3] і безпосередньо через вплив стресу на мозок. Хронічний психологічний стрес викликає тривалу активацію гіпоталамо-гіпофізарно-надниркової системи із вивільненням глюкокортикоїдів, як-от кортизол, наднирковими залозами. Згідно з гіпотезою глюкокортикоїдного каскаду [4], численні дослідження як на тваринах, так і на людях показали, що тривале підвищення кортизолу пов’язане з атрофією гіпокампа, руйнуванням дендритів і синаптичних закінчень нейронів, зниженням когнітивних функцій та порушеннями пам’яті [5–9]. Серед соматичних причин погіршення когнітивних функцій найчастіше зустрічаються інсульти, нейродегенеративні захворювання, судинні захворювання головного мозку, енцефалопатії різного генезу, зокрема метаболічного, постконтузійні стани. Однак у більшої частини популяції саме хронічний стрес викликає більшість випадків когнітивного зниження. Дослідження показують, що стрес справляє багаторазовий негативний вплив на нервову систему людини, у результаті чого відбуваються структурні зміни в окремих ділянках мозку [9]. В умовах хронічного стресу виявлено атрофію мозку та зменшення його об’єму й маси. За останні кілька десятиліть роль лімбічної системи, зокрема гіпокампа, і префронтальної кори в адаптації до стресу активно досліджується та обговорюється. Отримані дані підтвердили участь зазначених структур головного мозку у розвитку когнітивної дисфункції в умовах стресу [10–12]. У стресових ситуаціях гіпофіз і кора надниркових залоз виділяють гормони, які мають вирішальне значення для здатності протистояти стресовим умовам, а також відіграють важливу роль у поведінці, пам’яті та пізнанні [13]. Гіпокамп є найважливішою ланкою між різними структурами мозку в перетворенні короткочасної пам’яті в довготривалу. Результати дослідження Б.С. Мак’юн показали, що стрес може викликати функціональні та структурні зміни в гіпокампі, які призводять до атрофії та порушення нейрогенезу [14]. Крім того, хронічний стрес спричиняє підвищення концентрації кортизолу в плазмі крові, що може призвести до руйнування дендритів і синаптичних закінчень нейронів [14]. Встановлено, що високі концентрації глюкокортикостероїдів у плазмі протягом тривалого часу можуть викликати атрофію гіпокампа, що призводить до погіршення пам’яті [15]. Дорослі особи, які страждають від виснаження, пов’язаного з хронічним стресом [11] або посттравматичним стресовим розладом [12], демонструють гірші результати в деяких когнітивних тестах порівняно зі здоровими особами контрольних груп. Крім того, існує послідовний зв’язок між хронічним стресом і патологічним старінням мозку, до того ж стрес є добре встановленим провісником деменції [16–18].
З усіх проведених досліджень для виявлення кореляції хронічного стресу з когнітивним зниженням одним із найповніших виявилося дослідження Dinne Skjærlund Christensen, Ellen Garde, Hartwig Roman Siebner, Erik Lykke Mortensen, які оцінювали кореляцію між хронічним стресом та когнітивним зниженням у пацієнтів декількох вікових груп. Вибірка складалася з 292 членів Копенгагенської перинатальної когорти (1959–1961) з продовженням участі у двох подальших дослідженнях. Когнітивні здібності оцінювали в молодому (у середньому 27 років) і середньому віці (у середньому 56 років) за допомогою повної шкали інтелекту дорослих Векслера, а сприйнятий стрес вимірювали в середньому віці за допомогою шкали сприйнятого стресу. Зв’язок сприйнятого стресу середнього віку зі зниженням вербального, продуктивного та повномасштабного IQ оцінювали в множинних регресійних моделях на основі оцінки повної інформації максимальної ймовірності. Результати показали середнє зниження показника IQ до 2,42 (вербальний IQ) та 8,87 (продуктивний IQ). Підсумовуючи результати, дослідники виявили негативний зв’язок стресу з когнітивними здібностями в обох вікових групах.
З метою дослідження фармакологічних можливостей поліпшення когнітивних здібностей пацієнтів із соматичною та психіатричною патологією ми дослідили препарат Тіоцетам® Форте, таблетки, виробництва ПАТ «Київмедпрепарат», Україна (корпорація «Артеріум»), провели огляд літератури щодо його фармакологічних властивостей, ознайомились з клінічними дослідженнями з використанням препарату та провели власне рандомізоване клінічне дослідження на базі відділення психоневрології Київської клінічної лікарні на залізничному транспорті № 1.
У відділенні психоневрології проводилось рандомізоване контрольоване дослідження, у якому препарат Тіоцетам® Форте приймали 40 пацієнтів віком від 18 до 65 років протягом 30 днів. У дослідженні вивчали вплив препарату Тіоцетам® Форте на пацієнтів з хронічним стресом та зниженням когнітивних функцій. Метою дослідження було визначити ефективність препарату в лікуванні пацієнтів з хронічним стресом та зниженням когнітивних функцій. Пацієнтів було розділено на 2 групи: експериментальну, пацієнти якої приймали Тіоцетам® Форте (40 осіб), та контрольну групу, пацієнти якої приймали стандартне лікування без препарату Тіоцетам® Форте (40 осіб). Препарат приймали пацієнти з хронічним стресом, когнітивним зниженням. Критеріями включення були: скарги на хронічний стрес, об’єктивні порушення когнітивної сфери, когнітивні порушення за результатами тесту MoCA (Montreal Cognitive Assessment), тесту Шульте, тесту прокладання шляху (Trail Making Test), PHQ-9 (Patient Health Questionnaire-9), HADS (Hospital Anxiety and Depression Scale), шкали Хомса і Раге, тесту 10 слів. Критеріями виключення були: тяжкі супутні захворювання, наявність хронічних або гострих захворювань, що можуть вплинути на результати (наприклад, онкологічні, серцево-судинні захворювання, гостре порушення мозкового кровообігу за геморагічним типом, гостра ниркова недостатність, термінальна стадія ниркової недостатності, хорея Хантінгтона тощо), вживання інших когнітивних препаратів, інші лікарські засоби, що можуть впливати на когнітивні функції, психотичні розлади, наявність психотичних розладів, які можуть ускладнювати інтерпретацію результатів дослідження, зловживання психоактивними речовинами, залежність від наркотиків або алкоголю, підвищена чутливість до пірацетаму або похідних піролідону та/або до тіазотної кислоти, а також до будь-якого іншого компонента препарату. Інструментами контролю були PHQ-9 (оцінка симптомів депресії), HADS (вимірювання рівня тривоги та депресії), шкала Хомса і Раге (оцінка рівня стресу), МоCA (визначення когнітивних функцій), тест 10 слів (оцінка пам’яті), Шульте (оцінка уваги та концентрації), тест прокладання шляху (дослідження когнітивних функцій). Пацієнти приймали по 2–3 таблетки препарату на добу залежно від когнітивних порушень. У двох пацієнтів було виявлено алергічну реакцію на Тіоцетам® Форте.
Після закінчення курсу лікування препаратом Тіоцетам® Форте показники ефективності роботи за тестом Шульте у пацієнтів експериментальної групи зросли на 17 %, ступінь впрацьованості поліпшився на 15 %, показники психічної стійкості — на 6 %. У пацієнтів контрольної групи показники не змінилися (рис. 1).
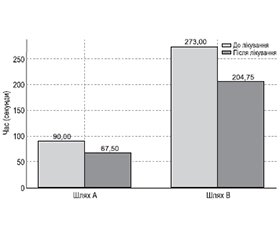
Тест прокладання шляху: до початку прийому препарату пацієнти проходили шлях А та шлях В. По шляху А у 30 % пацієнтів показник був більше ніж 90 секунд, у 80 % пацієнтів — більше ніж 78 секунд. По шляху В показник був у 75 % більше ніж 273 секунди, у 10 % — більше ніж 3 хвилини та у 15 % — більше ніж 75 секунд. Через 30 днів прийому препарату показники поліпшились у пацієнтів експериментальної групи на 25 %. У пацієнтів контрольної групи показники не змінилися (рис. 2).
При порівнянні значень MoCA у середньому бал пацієнта експериментальної групи зріс на 1,1 % від попереднього. У пацієнтів контрольної групи показник за MoCA був без змін.
/43.jpg)
Фармакологічний ефект препарату Тіоцетам® Форте обумовлений взаємопотенціюючою дією тіазотної кислоти та пірацетаму. Препарат належить до групи цереброактивних засобів, має протиішемічні, антиоксидантні, мембраностабілізуючі та ноотропні властивості. Препарат поліпшує інтегративну та когнітивну діяльність мозку, підвищує ефективність процесу навчання, усуває симптоми амнезії, поліпшує показники короткочасної та довготривалої пам’яті. Препарат здатний прискорити окиснення глюкози в реакціях аеробного і анаеробного окиснення, нормалізувати біоенергетичні процеси, підвищити рівень АТФ, стабілізувати метаболізм у тканинах мозку. Тіоцетам® Форте гальмує шляхи утворення активних форм кисню, реактивує антиоксидантну систему ферментів, особливо супероксиддисмутазу, гальмує вільнорадикальні процеси в мозку при ішемії, поліпшує реологічні властивості крові шляхом активації фібринолітичної системи, стабілізує і зменшує відповідно зони некрозу та ішемії.
Висновки
Таким чином, зважаючи на склад та фармакологічні властивості, препарат Тіоцетам® Форте належить до групи цереброактивних засобів, має протиішемічні, антиоксидантні, мембраностабілізуючі та ноотропні властивості. Тіоцетам® Форте поліпшує інтегративну та когнітивну діяльність мозку, підвищує ефективність процесу навчання, сприяє усуненню симптомів амнезії, поліпшує показники короткотривалої та довготривалої пам’яті.
За результатами дослідження, проведеного у відділенні психоневрології Київської клінічної лікарні на залізничному транспорті № 1, нами було виявлено позитивну кореляцію між прийомом препарату Тіоцетам® Форте та поліпшенням когнітивних функцій у пацієнтів з когнітивним зниженням на тлі хронічного стресу. Було виявлено, що Тіоцетам® Форте поліпшує показники ефективності, психічної стійкості, швидкості обробки інформації, когнітивної гнучкості, візуально-моторної координації уваги, концентрації та пам’яті.
Конфлікт інтересів. Не заявлений.
Отримано/Received 05.09.2024
Рецензовано/Revised 03.10.2024
Прийнято до друку/Accepted 10.10.2024
Список литературы
1. Gouhie FA, Barbosa KO, Cruz ABR, Wellichan MM, Zampolli TM. Cognitive effects of piracetam in adults with memory impairment: A systematic review and meta-analysis. Clin Neurol Neurosurg. 2024 Aug;243:108358. doi: 10.1016/j.clineuro.2024.108358. Epub 2024 May 31. PMID: 38878641.
2. Feigin VL, Vos T, Nichols E, Owolabi MO, Carroll WM, Dichgans M, et al. The global burden of neurological disorders: translating evidence into policy. The Lancet Neurology. 2020;19, Iss. 3:255-265. https://doi.org/10.1016/S1474-4422(19)30411-9.
3. Rafnsson SB, Deary IJ, Smith FB, Whiteman MC, Fowkes FGR. Cardiovascular diseases and decline in cognitive function in an elderly community population: the Edinburgh artery study. Psychosom Med. 2007;69(5):425-34.
4. Sapolsky RM, Krey LC, McEwen BS. The neuroendocrinology of stress and aging: the glucocorticoid cascade hypothesis. Endocr Rev. 1986;7(3):284-301.
5. Gianaros PJ, Jennings JR, Sheu LK, Greer PJ, Kuller LH, Matthews KA. Prospective reports of chronic life stress predict decreased grey matter volume in the hippocampus. NeuroImage. 2007;35(2):795-803.
6. Lupien SJ, Fiocco A, Wan N, Maheu F, Lord C, Schramek T, et al. Stress hormones and human memory function across the lifespan. Psychoneuroendocrinology. 2005;30(3):225-42.
7. Lupien SJ, Fiocco A, Wan N, Maheu F, Lord C, Schramek T, et al. Stress hormones and human memory function across the lifespan. Psychoneuroendocrinology. 2005;30(3):225-42.
8. Franz CE, O’Brien RC, Hauger RL, Mendoza SP, Panizzon MS, Prom-Wormley E, et al. Cross-sectional and 35-year longitudinal assessment of salivary cortisol and cognitive functioning: The Vietnam Era Twin Study of Aging. Psychoneuroendocrinology. 2011;36(7):1040-52.
9. MacLullich AMJ, Deary IJ, Starr JM, Ferguson KJ, Wardlaw JM, Seckl JR. Plasma cortisol levels, brain volumes and cognition in healthy elderly men. Psychoneuroendocrinology. 2005;30(5):505-15.
10. Oumohand SE, Ward DD, Boenniger MM, Merten N, Kirschbaum C, Breteler MMB. Perceived stress but not hair cortisol concentration is related to adult cognitive performance. Psychoneuroendocrinology. 2020;121:104810.
11. VonDras DD, Powless MR, Olson AK, Wheeler D, Snudden AL. Differential effects of everyday stress on the episodic memory test performances of young, mid-life, and older adults. Aging Ment Health. 2005;9(1):60-70.
12. Chen Y, Liang Y, Zhang W, Crawford JC, Sakel KL, Dong X. Perceived stress and cognitive decline in Chinese-American older adults. J Am Geriatr Soc. 2019;67(S3):S519-24.
13. de Kloet ER. Stress in the brain. Eur J Pharmacol. 2000 Sep 29;405(1-3):187-98. DOI: 10.1016/s0014-2999(00)00552-5.
14. McEwen BS. Stress and hippocampal plasticity. Annu Rev Neurosci. 1999;22:105-22. DOI: 10.1146/annurev.neuro.22.1.105.
15. Issa AM, Rowe W, Gauthier S, Meaney MJ. Hypothalamic pituitary-adrenal activity in aged, cognitively impaired and cognitively unimpaired rats. J Neurosci.1990 Oct;10(10):3247-54. DOI: 10.1523/JNEUROSCI.10-10-03247.1990. PID: 2170594; PMCID: PMC6570181.
16. Gradus JL, Horváth-Puhó E, Lash TL, Ehrenstein V, Tamang S, Adler NE, et al. Stress Disorders and Dementia in the Danish Population. Am J Epidemiol. 2019;188(3):493-9.
17. Islamoska S, Hansen ÅM, Ishtiak-Ahmed K, Garde AH, Andersen PK, Garde E, et al. Stress diagnoses in midlife and risk of dementia: a register-based follow-up study. Aging Ment Health. 2021;25(6):1151-60.
18. Johansson L, Guo X, Waern M, Östling S, Gustafson D, Bengtsson C, et al. Midlife psychological stress and risk of dementia: a 35-year longitudinal population study. Brain. 2010;133(8):2217-24.
/43.jpg)