Журнал «Медицина неотложных состояний» Том 20, №6, 2024
Вернуться к номеру
Неотон у періопераційній підготовці до некардіохірургічних операцій пацієнтів похилого віку високого і дуже високого кардіоваскулярного ризику
Авторы: Черська М.С., Кухарчук Х.М., Болгов М.Ю., Омельчук О.В., Таращенко Ю.М., Тронько М.Д.
Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України, м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
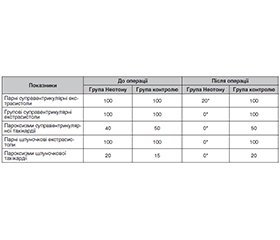
Актуальність. Серцево-судинні ускладнення в періопераційний період, а саме інфаркт міокарда та ішемічний інсульт, є головним фактором смертності після несерцевих операцій. Понад 80 % пацієнтів з періопераційним ушкодженням міокарда не повідомляють про симптоми. Крім того, його мовчазна презентація призводить до обмеженої обізнаності як серед клініцистів, так і серед громадськості. Незважаючи на те, що періопераційне ураження міокарда перебігає переважно безсимптомно, воно збільшує 30-денну смертність майже в 10 разів. Метою нашого дослідження була оцінка ефективності, безпеки й переносимості препарату фосфокреатину (Неотон) для запобігання інтраопераційним ускладненням у пацієнтів похилого і старечого віку з високим і дуже високим кардіоваскулярним ризиком, що потребують оперативного лікування раку щитоподібної залози. Матеріали та методи. Дане клінічне дослідження проводилося як наглядове (неінтервенційне) відкрите контрольоване рандомізоване проспективне дослідження, у якому препарат Неотон призначався відповідно до зареєстрованих показань. У дослідженні взяли участь 40 пацієнтів (середній вік 63 ± 6 років, 12 чоловіків, 28 жінок), які проходили передопераційну підготовку і яким проводилося оперативне втручання з приводу раку щитоподібної залози в Державній установі «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України». У дослідженні брали участь пацієнти, які відповідали таким критеріям включення: чоловіки і жінки у віці від 55 років і старше; високого і дуже високого серцево-судинного ризику; у рамках передопераційної підготовки до оперативного втручання з приводу раку щитоподібної залози; готовність і здатність пацієнта виконувати вимоги протоколу дослідження; підписана інформована згода пацієнта на участь в дослідженні. Пацієнти, які взяли участь у дослідженні, розподілялися методом рандомізації на 2 групи по 20 осіб, препарат призначали за наступною схемою: I група (контрольна) — за 2 дні до операції та 2 дні після отримувала Неотон 1 г в/в краплинно на фоні базової терапії ; II група — отримувала лише базову терапію. Базовою терапією вважалася антигіпертензивна, ліпідознижуюча й антитромбоцитарна терапія в цільових дозах. Для всіх пацієнтів проводилися за 5 днів до операції та через 3 дні після неї: реєстрація інформації про історію хвороби і супутні захворювання; об’єктивний огляд пацієнта, що включає аускультацію серця й легень, огляд шкіри і слизових, пальпацію живота, вимірювання частоти серцевих скорочень, артеріального тиску; заповнення опитувальника якості життя SF-36; електрокардіографія; холтерівське моніторування ЕКГ; трансторакальна ехокардіографія. Результати. Неотон у курсовій дозі 4 г у схемі періопераційної підготовки пацієнтів з високим серцево-судинним ризиком дозволив знизити кількість суправентрикулярних і шлуночкових аритмій. Введення Неотону в схему періопераційної підготовки таких пацієнтів дозволило покращити якість життя хворих (за результатами SF-36). Висновки. Неотон є корисним, ефективним і доцільним кардіопротекторним засобом для періопераційної підготовки хворих високого ризику до некардіологічних операцій (зокрема, з раком щитоподібної залози).
Background. Cardiovascular complications in the peri-operative period, namely myocardial infarction and ischemic stroke, are the main factor of mortality after non-cardiac surgeries. Over 80 % of patients with perioperative myocardial injury report no symptoms. In addition, its silent presentation leads to limited awareness among both clinicians and the public. Despite the fact that perioperative myocardial injury is mostly asymptomatic, it increases a 30-day mortality by almost 10 times. The purpose of our study was to evaluate the efficacy, safety and tolerability of phosphocreatine (Neoton) for the prevention of intraoperative complications in elderly and senile patients at high and very high cardiovascular risk requiring operative treatment for thyroid cancer. Materials and methods. This clinical research was conducted as an observational (non-interventional), open-label, controlled, randomized, prospective study, in which Neoton was prescribed according to the registered indications. The research involved 40 patients (average age of 63 ± 6 years, 12 men, 28 women) who underwent preoperative training and thyroid cancer surgery at the State Institution “V.P. Komisarenko Institute of Endocrinology and Metabolism of the NAMS of Ukraine”. Patients who met the following inclusion criteria participated in the study: men and women aged 55 years and older; high and very high cardiovascular risk; as part of preoperative preparation for thyroid cancer surgery; the willingness and ability of a patient to comply with the requirements of the research protocol; signed informed consent to participate in the study. Patients who took part in the study were randomly divided into 2 groups of 20 people each. The drug was prescribed according to the following scheme: group I (controls) received Neoton 1 g by intravenous drip for 2 days before the operation and 2 days after it on the background of the basic therapy; group II received only basic therapy. Antihypertensive, lipid-lowering and antiplatelet drugs in target doses were considered the basic therapy. All patients underwent the following procedures 5 days before surgery and 3 days after: registration of information about medical history and concomitant diseases; objective examination, including auscultation of the heart and lungs, examination of the skin and mucous membranes, palpation of the abdomen, measurement of heart rate, blood pressure; quality of life questionnaire SF-36; electrocardiogram; Holter ECG monitoring; transthoracic echocardiography. Results. Neoton in a course dose of 4 g in the scheme of perioperative preparation of patients at high cardiovascular risk allowed to reduce the number of supraventricular and ventricular arrhythmias, to improve their quality of life (according to the SF-36 scores). Conclusions. Neoton is a useful, effective and expedient cardioprotective agent for perioperative preparation of high-risk patients for non-cardiac surgeries (in particular, with thyroid cancer).
операція; серцево-судинні ускладнення; кардіопротектор; періопераційна підготовка
surgery; cardiovascular complications; cardioprotector; perioperative preparation
Вступ
Матеріали та методи
Результати та обговорення
Висновки
- Bainbridge D, Martin J, Arrango M, Cheng D. Perioperative and anaesthetic-related mortality in developed and developing countries: a systematic review and meta-analysis. Lancet. 2012;380:1075-81.
- Wong SSC, Irwin MG. Peri-operative cardiac protection for non-cardiac surgery. Anaesthesia. 2016;71:29-39. https://doi.org/10.1111/anae.13305.
- Smilowitz NR, Berger JS. Perioperative Cardiovascular Risk Assessment and Management for Noncardiac Surgery: A Review. JAMA. 2020;324(3):279-290. doi:10.1001/jama.2020.7840.
- Puelacher С, Lurati-Buse G, Singeisen Н, Dang М, Cuculi F, Mueller С. Perioperative myocardial infarction/injury after noncardiac surgery. https://smw.ch/index.php/smw/article/view/2105/3088.
- Ruetzler K, Khanna AK, Sessler DI. Myocardial Injury After Noncardiac Surgery: Preoperative, Intraoperative, and Postoperative Aspects, Implications, and Directions. Anesthesia & Analgesia. 2020 Jul;131(1):173-186. doi: 10.1213/ANE.0000000000004567.
- Landoni G, Zangrillo А, Lomivorotov VV, Likhvantsev V, Ma J, De Simone F, Fominskiy E. Cardiac protection with phosphocreatine: a meta-analysis. Interactive CardioVascular and Thoracic Surgery. 2016;23(4):637-646. https://doi.org/10.1093/icvts/ivw171.
- Cao F, Zervou S, Lygate CA. The creatine kinase system as a therapeutic target for myocardial ischaemia-reperfusion injury. Biochem Soc Trans. 2018;46(5):1119-1127. doi: https://doi.org/10.1042/BST20170504.
- Lomivorotov V, Merekin D, Fominskiy E et al. Myocardial protection with phosphocreatine in high-risk cardiac surgery patients: a randomized trial. BMC Anesthesiol. 2023;23:389. https://doi.org/10.1186/s12871-023-02341-4.

/39.jpg)
/40.jpg)
/41.jpg)