Международный эндокринологический журнал Том 20, №5, 2024
Вернуться к номеру
Гепатоцентричний підхід до досягнення компенсації цукрового діабету 2-го типу в осіб з неалкогольним стеатогепатитом
Авторы: Протас Н.М. (1, 2), Костіцька І.О. (2), Бєлінський М.В. (2)
(1) - КНП «Обласна клінічна лікарня Івано-Франківської обласної ради», м. Івано-Франківськ, Україна
(2) - Івано-Франківський національний медичний університет, м. Івано-Франківськ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
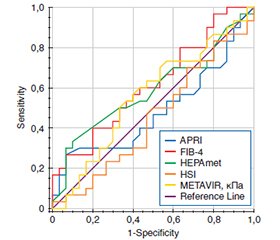
Актуальність. Неалкогольний стеатогепатит (НАСГ) в осіб із цукровим діабетом 2-го типу (ЦД2) вважають коморбідною патологією із несприятливим прогнозом і важким економічним тягарем для світової системи охорони здоров’я. Незважаючи на пацієнт-орієнтовані цілі лікування, синхронну роботу мультидисциплінарної команди лікарів, значна частка пацієнтів не досягає компенсації вуглеводного обміну, що свідчить про складний багатофакторний патогенез ЦД2. Досягнення цільових глікемічних рівнів із урахуванням гепатоцентричного підходу слід вважати одним із альтернативних шляхів удосконалення алгоритму лікування пацієнтів із ЦД2 та НАСГ. Мета дослідження: оцінити гепатопротекторний вплив дапагліфлозину на досягнення компенсації вуглеводного обміну в осіб із ЦД2 та НАСГ. Матеріали та методи. Обстежено 60 пацієнтів із ЦД2 та НАСГ, які відповідали критеріям дослідження та залежно від цукрознижувальної терапії були розподілені на дві групи: І група (n = 30) отримувала базову медикаментозну терапію (БМТ) — метформін 2000 мг/добу, альфа-ліпоєва кислота 600 мг/добу, розувастатин 10 мг/добу у поєднанні з інсулінотерапією; ІІ група (n = 30) застосовувала БМТ у комбінації із дапагліфлозином у добовій дозі 10 мг. Усім пацієнтам проведено комплекс лабораторних обстежень із розрахунком неінвазивних біомаркерів скринінгу (система оцінки фіброзу HEPAmet) та вираженості фіброзу печінки (індекс фіброзу печінки-4, FIB-4) й клініко-інструментальну діагностику за допомогою зсувнохвильової еластографії (ЗХЕГ) печінки (METAVIR, кПА). Період дослідження тривав 12 тижнів. Результати. Через 3 місяці після початку лікування в осіб І групи спостерігалася тенденція до нормалізації показників вуглеводного обміну, тоді як рівень глікованого гемоглобіну (HbA1с) вірогідно знизився (∆ –22,92 %, p < 0,001) у пацієнтів ІІ групи дослідження. Упродовж усього періоду дослідження не зареєстровано жодного епізоду гіпоглікемії та небажаного явища. Ефективність додаткового призначення дапагліфлозину підтверджує гепатоцентричний підхід щодо досягнення компенсації вуглеводного обміну із нормалізацією маркерів фіброзу (HEPAmet: AUC 0,828 (95% CI: 0,712–0,943, p < 0,001); FIB-4: AUC 0,765 (95% CI: 0,643–0,887, p < 0,001)) та вірогідним зниженням показників шкали METAVIR (AUC 0,996 (95% CI: 0,986–1,005, p < 0,001)) згідно із висновками ЗХЕГ печінки. Висновки. Призначення дапагліфлозину до БМТ ефективно впливає на показники вуглеводного обміну та активує додаткові механізми гепатопротекції у пацієнтів із ЦД2 та НАСГ. Гепатоцентричний погляд на безпечну та ефективну компенсацію ЦД2 в осіб із НАСГ обґрунтовується вчасним використанням оновленого алгоритму лікування з акцентом на інгібітори натрійзалежного котранспортера глюкози 2-го типу.
Background. Non-alcoholic steatohepatitis (NASH) in individuals with type 2 diabetes mellitus (T2DM) is considered a comorbid condition with an unfavorable prognosis and a significant economic burden on the global healthcare system. Despite patient-centered treatment goals and the coordinated efforts of a multidisciplinary team of physicians, a significant proportion of patients fail to achieve glycemic control, indicating the complex and multifactorial pathogenesis of T2DM. Achieving glycemic targets with a hepatocentric approach should be considered an alternative way to improve the treatment algorithm for patients with T2DM and NASH. The purpose of the study was to evaluate the hepatoprotective effect of dapagliflozin on achieving glycemic control in individuals with T2DM and NASH. Materials and methods. Sixty patients with T2DM and NASH were examined and divided into two groups based on antidiabetic therapy: group I (n = 30) received basic medical therapy (BMT) which included metformin (2000 mg/day), alpha-lipoic acid (600 mg/day), and rosuvastatin (10 mg/day) in combination with insulin therapy; group II (n = 30) received BMT in combination with dapagliflozin at a daily dose of 10 mg. All patients underwent comprehensive laboratory tests, including calculations of non-invasive screening biomarkers (HEPAmet fibrosis score) and liver fibrosis severity (Fibrosis-4 index, FIB-4), as well as clinical and instrumental diagnostics using liver shear wave elastography (METAVIR, kPa). The study period lasted 12 weeks. Results. After 3 months of treatment, group I showed a tendency toward normalization of glycemic control parameters, while the level of glycated hemoglobin significantly decreased (∆ –22.92 %, p < 0.001) in group II. Throughout the study period, no episodes of hypoglycemia or adverse events were reported. The effectiveness of the additional administration of dapagliflozin supports the hepatocentric approach to achieving glycemic control with normalization of fibrosis markers (HEPAmet: AUC 0.828 (95% CI: 0.712–0.943, p < 0.001); FIB-4: AUC 0.765 (95% CI: 0.643–0.887, p < 0.001)) and a significant reduction of METAVIR scores (AUC 0.996 (95% CI: 0.986–1.005, p < 0.001)) according to liver shear wave elastography. Conclusions. The study results indicate that administration of dapagliflozin at a dose of 10 mg/day with BMT effectively impacts glycemic control and activates additional hepatoprotective mechanisms in patients with T2DM and NASH. A hepatocentric approach to the safe and effective management of T2DM in individuals with NASH is justified by the timely use of an updated treatment algorithm with an emphasis on sodium-glucose cotransporter 2 inhibitors.
цукровий діабет 2-го типу; неалкогольний стеатогепатит; інгібітори натрійзалежного котранспортера глюкози 2-го типу; дапагліфлозин
type 2 diabetes mellitus; non-alcoholic steatohepatitis; sodium-glucose cotransporter 2 inhibitors; dapagliflozin
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Ferguson D, Finck BN. Emerging therapeutic approaches for the treatment of NAFLD and type 2 diabetes mellitus. Nat Rev Endocrinol. 2021 Aug;17(8):484-495. doi: 10.1038/s41574-021-00507-z. Epub 2021 Jun 15. PMID: 34131333; PMCID: PMC8570106.
- Kostitska I, Protas N, Petrovska L. Prospects of using sodium-glucose co-transporter-2 (SGLT-2) inhibitors in patients with meta–bolic-associated fatty liver disease (MAFLD). Diabetes Obesity Metabolic Syndrome. 2023;5:8-37. DOI: 10.57105/2415-7252-2023-5-01.
- Kim KS, Lee BW. Beneficial effect of anti-diabetic drugs for nonalcoholic fatty liver disease. Clin Mol Hepatol. 2020 Oct;26(4):430-443. doi: 10.3350/cmh.2020.0137. Epub 2020 Aug 14. PMID: 32791578; PMCID: PMC7641556.
- Menekşe B, Batman A. Effect of Exenatide on Nonalcoholic Steatohepatitis and Inflammation-Related Indices in Diabetic Patients with Non-Alcoholic Fatty Liver Disease. Metab Syndr Relat Disord. 2023 May;21(4):205-213. doi: 10.1089/met.2022.0088. Epub 2023 Mar 21. PMID: 36944132.
- Tkach SM, Pankiv VI, Dorofeev AE, Yuzvenko VS. The importance of glycemic control in non-alcoholic fatty liver disease. Clinical Endocrinology and Endocrine Surgery. 2022 Jun 16;2:20-26. DOI: 10.30978/CEES-2022-2-20.
- Ng CH, Lin SY, Chin YH, Lee MH, Syn N, Goh XL, et al. Antidiabetic Medications for Type 2 Diabetics with Nonalcoholic Fatty Liver Disease: Evidence From a Network Meta-Analysis of Randomi–zed Controlled Trials. Endocr Pract. 2022 Feb;28(2):223-230. doi: 10.1016/j.eprac.2021.09.013. Epub 2021 Oct 1. PMID: 34606980.
- Hazem RM, Ibrahim AZ, Ali DA, Moustafa YM. Dapagliflozin improves steatohepatitis in diabetic rats via inhibition of oxidative stress and inflammation. Int Immunopharmacol. 2022 Mar;104:108503. doi: 10.1016/j.intimp.2021.108503. Epub 2022 Jan 5. PMID: 34998036.
- Zhao DM, Li CQ, Sun YM, Fan JY, Wu N, Sun YN, Sun XY. Sodium glucose cotransporter-2-inhibitor dapagliflozin improves nonalcoholic fatty liver disease by ameliorating dipeptidyl-peptidase-4 protein expression in diabetic mice. Endokrynol Pol. 2023;74(2):190-196. doi: 10.5603/EP.a2023.0018. Epub 2023 Apr 11. PMID: 37039492.
- He K, Li J, Xi W, Ge J, Sun J, Jing Z. Dapagliflozin for nonalcoholic fatty liver disease: A systematic review and meta-analysis. Diabetes Res Clin Pract. 2022 Mar;185:109791. doi: 10.1016/j.diabres.2022.109791. Epub 2022 Feb 21. PMID: 35202771.
- Rinella ME, Neuschwander-Tetri BA, Siddiqui MS, Abdelmalek MF, Caldwell S, Barb D, et al. AASLD Practice Guidance on the clinical assessment and management of nonalcoholic fatty liver disease. Hepatology. 2023 May 1;77(5):1797-1835. doi: 10.1097/HEP.0000000000000323. Epub 2023 Mar 17. PMID: 36727674; PMCID: PMC10735173.
- Shrestha A, Pradhananga S. Holistic Approach in the Ma–nagement of Nonalcoholic Fatty Liver Disease. Euroasian J Hepatogastroenterol. 2022 Jul;12(Suppl 1):S51-S58. doi: 10.5005/jp-journals-10018-1359. PMID: 36466101; PMCID: PMC9681569.
- Castera L, Friedrich-Rust M, Loomba R. Noninvasive Assessment of Liver Disease in Patients With Nonalcoholic Fatty Li–ver Disease. Gastroenterology. 2019 Apr;156(5):1264-1281.e4. doi: 10.1053/j.gastro.2018.12.036. Epub 2019 Jan 18. PMID: 30660725; PMCID: PMC7505052.
- Ampuero J, Pais R, Aller R, Gallego-Durán R, Crespo J, García-Monzón C, et al.; HEPAmet Registry. Development and Vali–dation of Hepamet Fibrosis Scoring System-A Simple, Noninvasive Test to Identify Patients With Nonalcoholic Fatty Liver Disease With Advanced Fibrosis. Clin Gastroenterol Hepatol. 2020 Jan;18(1):216-225.e5. doi: 10.1016/j.cgh.2019.05.051. Epub 2019 Jun 11. PMID: 31195161.
- Ferraioli G, Filice C, Castera L, Choi BI, Sporea I, Wilson SR, et al. WFUMB guidelines and recommendations for clinical use of ultrasound elastography: Part 3: Liver. Ultrasound Med Biol. 2015 May;41(5):1161-79. doi: 10.1016/j.ultrasmedbio.2015.03.007. Epub 2015 Mar 20. PMID: 25800942.
- McMurray JJV, Solomon SD, Inzucchi SE, Køber L, Kosiborod MN, Martinez FA, et al.; DAPA-HF Trial Committees and Investigators. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med. 2019 Nov 21;381(21):1995-2008. doi: 10.1056/NEJMoa1911303. Epub 2019 Sep 19. PMID: 31535829.
- European Association for the Study of the Liver (EASL). Electronic address: easloffice@easloffice.eu; European Association for the Study of Diabetes (EASD); European Association for the Study of Obesity (EASO); European Association for the Study of the Liver (EASL). EASL-EASD-EASO Clinical Practice Guidelines on the management of metabolic dysfunction-associated steatotic liver disease (MASLD). J Hepatol. 2024 Jun 5:S0168-8278(24)00329-5. doi: 10.1016/j.jhep.2024.04.031. Epub ahead of print. PMID: 38851997.
- Cuatrecasas G, De Cabo F, Coves MJ, et al. Dapagliflozin added to metformin reduces perirenal fat layer in type 2 diabetic patients with obesity. Sci Rep. 2024;14:10832. https://doi.org/10.1038/s41598-024-61590-6.
- Hu C, Qu T, Li L, Huang Y, Liu H, Rao C. Therapeutic outcome of dapagliflozin in patients with type 2 diabetes and non-alcoholic fatty liver disease: a meta-analysis of randomized controlled trials. Afr Health Sci. 2023 Jun;23(2):416-421. doi: 10.4314/ahs.v23i2.48. PMID: 38223613; PMCID: PMC10782340.
- Tobita H, Sato S, Miyake T, Ishihara S, Kinoshita Y. Effects of Dapagliflozin on Body Composition and Liver Tests in Patients with Nonalcoholic Steatohepatitis Associated with Type 2 Diabetes Mellitus: A Prospective, Open-label, Uncontrolled Study. Curr Ther Res Clin Exp. 2017 Jul 8;87:13-19. doi: 10.1016/j.curtheres.2017.07.002. PMID: 28912902; PMCID: PMC5587885.
- Kosmalski M, Śliwińska A, Drzewoski J. Non-Alcoholic Fatty Liver Disease or Type 2 Diabetes Mellitus-The Chicken or the Egg Dilemma. Biomedicines. 2023 Apr 4;11(4):1097. doi: 10.3390/biomedicines11041097. PMID: 37189715; PMCID: PMC10135804.
- Kotsiubiichuk ZYa, Antoniv AA, Kanovska LV, Mandryk OYe. Correction of endothelial dysfunction in patients with type 2 diabetes mellitus, diabetic kidney disease and non-alcoholic steatohepatitis. International Journal of Endocrinology (Ukraine). 2024 Mar 3;20(1):1-6. doi.org/10.22141/2224-0721.20.1.2024.1350.