Журнал "Гастроэнтерология" Том 58, №3, 2024
Вернуться к номеру
Транзієнтна еластографія, ультразвукова візуалізація та печінкові ферменти в діагностиці хвороби печінки при муковісцидозі в дітей
Авторы: Yu.G. Tsyunchyk1, I.M. Shevchenko2, A.V. Tsyunchyk3, G.F. Stepanov1
(1) - Odessa National Medical University, Odesa, Ukraine
(2) - Scientific-Research Institute of Translational Medicine, Odessa National Medical University, Odesa, Ukraine
(3) - Brookdale University Hospital Center, Brooklyn, New York, USA
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
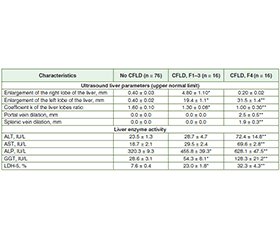
Актуальність. Хвороба печінки є причиною значної захворюваності та смертності дітей із муковісцидозом. Метою дослідження була оцінка прогностичної цінності транзієнтної еластографії, ультразвукової візуалізації і печінкових ферментів щодо діагностики хвороби печінки при муковісцидозі. Матеріали та методи. Обстежено 108 дітей віком 0–17 років, хворих на муковісцидоз. Стадію фіброзу визначали за допомогою транзієнтної еластографії. Досліджували активність ферментів (аланінамінотрансфераза, аспартатмінотрансфераза, лужна фосфатаза, гамма-глутамілтрансфераза, лактатдегідрогеназа-5), ультразвукові параметри печінки на різних стадіях фіброзу. Результати. У 29,6 % хворих на муковісцидоз встановлено фіброз печінки різного ступеня вираженості (F1-F4), у 14,8 % діагностовано цироз печінки. Виявлений зв’язок між підвищенням активності лужної фосфатази, гамма-глутамілтрансферази, лактатдегідрогенази-5, збільшенням лівої частки печінки та ступенем фіброзу F1-F4. Крім того, значне збільшення розмірів лівої частки відповідало вищому ступеню фіброзу. Виявлено зворотну кореляцію між коефіцієнтом k (співвідношення розмірів правої та лівої часток печінки) і ступенем фіброзу, причому вищому ступеню фіброзу відповідало менше значення цього параметра. У хворих на цироз печінки спостерігалося максимальне збільшення лівої частки печінки, найменше значення коефіцієнта k, розширення діаметрів ворітної та селезінкової вен. Висновки. Транзієнтна еластографія, зміни ультразвукових параметрів печінки разом із підвищеною активністю лужної фосфатази, гамма-глутамілтрансферази, лактатдегідрогенази-5 можуть бути використані для ранньої діагностики хвороби печінки при муковісцидозі.
Background. Liver disease is responsible for relevant morbidity and mortality in children with cystic fibrosis. We aimed to assess the predictive value of a combination of transient elastography, ultrasound imaging and serum liver enzymes for diagnosis of cystic fibrosis-related liver disease. Materials and methods. A total of 108 children aged 0–17 years with cystic fibrosis were examined. The fibrosis stage was determined using transient elastography. The activity of enzymes (alanine transaminase, aspartate transaminase, alkaline phosphatase, gamma-glutamyl transferase, lactate dehydrogenase-5), ultrasound parameters of the liver at different stages of liver fibrosis have been investigated. Results. Liver fibrosis of varying severity (F1-F4) was detected in 29.6 % of patients with cystic fibrosis. Liver cirrhosis was observed in 14.8 % of children with cystic fibrosis. The association between an elevated activity of alkaline phosphatase, gamma-glutamyl transferase, lactate dehydrogenase-5, an enlargement of the left lobe of the liver and the degree of fibrosis F1-F4 was found. Moreover, a significant increase in the size of the left lobe corresponded to a higher degree of fibrosis. A reverse correlation was detected between the k coefficient (the ratio of the sizes of the right and left lobes of the liver) and the degree of fibrosis, with a greater degree of fibrosis corresponding to a lower value of this parameter. The maximum enlargement of the left lobe of the liver, the lowest value of the k coefficient, and the dilation of the portal and splenic veins were observed in patients with liver cirrhosis. Conclusions. The transient elastography, changing of ultrasound liver parameters with elevated activity of the alkaline phosphatase, gamma-glutamyl transferase, lactate dehydrogenase-5 could be used for early diagnosis of cystic fibrosis-related liver disease.
муковісцидоз; хвороба печінки; транзієнтна еластографія; ультразвукова візуалізація
cystic fibrosis-related liver disease; transient elastography; ultrasound imaging
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Toledano MB, Mukherjee SK, Howell J, et al. The emerging burden of liver disease in cystic fibrosis patients: A UK nationwide study. PLoS One. 2019 Apr 4;14(4):e0212779. doi: 10.1371/journal.pone.0212779.
- Colombo C, Zazzeron L. Liver disease in cystic fibrosis. In: Diseases of the liver and biliary tree. 2021. 93-113. doi: 10.1007/978-3-030-65908-0_6.
- Taylor-Robinson D, Archangelidi O, Carr SB, et al. Data resource profile: The UK cystic fibrosis registry. Int J Epidemiol. 2018;47:9-10e. doi: 10.1093/ije/dyx196.
- Staufer K, Halilbasic E, Trauner M, Kazemi-Shirazi L. Cystic fibrosis related liver disease — another black box in hepatology. Int J Mol Sci. 2014;15(8):13529-13549. doi: 10.3390/ijms150813529.
- Ye W, Narkewicz MR, Leung DH, et al.; CFLDnet research group. Variceal hemorrhage and adverse liver outcomes in patients with cystic fibrosis cirrhosis. J Pediatr Gastroenterol Nutr. 2018 Jan;66(1):122-127. doi: 10.1097/MPG.0000000000001728.
- Stonebraker JR, Ooi CY, Pace RG, et al. Features of severe liver disease with portal hypertension in patients with cystic fibrosis. Clin Gastroenterol Hepatol. 2016;14:1207-1215. doi: 10.1016/j.cgh.2016.03.041.
- Hillaire S, Cazals-Hatem D, Bruno O, et al. Liver transplantation in adult cystic fibrosis: clinical, imaging and pathological evidence of obliterative portal venopathy. Liver Transpl. 2017 Oct;23(10):1342-1347. doi: 10.1002/lt.24842.
- Debray D, Kelly D, Houwen R, et al. Best practice guidance for the diagnosis and management of cystic fibrosis-associated liver disease. J Cyst Fibros. 2011;10 (Suppl 2):829-36. doi: 10.1016/s1569-1993(11)60006-4.
- Colombo C, Alicandro G. Liver disease in cystic fibrosis: illuminating the black box. Hepatology. 2019 Apr;69(4):1379-1381. doi: 10.1002/hep.30255.
- Boëlle PY, Debray D, Guillot L, et al. French CF modifier gene study investigators. Cystic fibrosis liver disease: outcomes and risk factors in a large cohort of French patients. Hepatology. 2019 Apr;69(4):1648-1656. doi: 10.1002/hep.30148.
- Wunsch E, Krawczyk M, Milkiewicz M, et al. Serum autotaxin is a marker of the severity of liver injury and overall survival in patients with cholestatic liver diseases. Sci Rep. 2016;6:30847. doi: 10.1038/srep30847.
- Leung DH, Khan M, Minard CG, et al. Aspartate aminotransferase to platelet ratio and fibrosis-4 as biomarkers in biopsy-validated pediatric cystic fibrosis liver disease. Hepatology. 2015;62:1576-1583. doi: 10.1002/hep.28016.
- Cook NL, Pereira TN, Lewindon PJ, et al. Circulating MicroRNAs as noninvasive diagnostic biomarkers of liver disease in children with cystic fibrosis. J Pediatr Gastroenterol Nutr. 2015;60:247-254. doi: 10.1097/mpg.0000000000000600.
- Stonebraker JR, Pace RG, Gallins PJ, et al. Genetic variation in severe cystic fibrosis liver disease is associated with novel mechanisms for disease pathogenesis. Hepatology. 2024 Mar 27. doi: 10.1097/HEP.0000000000000863.
- Bedossa P, Poynard T. An algorithm for the grading of activity in chronic hepatitis C. The METAVIR cooperative study group. Hepatology. 1996;24(2):289-293. doi: 10.1002/hep.510240201.
- Daniel H. Leung. Hepatic fibrosis scores and serum biomar–kers in pediatric hepatology. Clin Liver Dis. 2017 May;9(5):125-130. doi: 10.1002/cld.634.
- Koh C, Sakiani S, Surana P, et al. Adult-onset cystic fibrosis liver disease: diagnosis and characterization of an underappreciated entity. Hepatology. 2017;66:591-601. doi: 10.1002/hep.29217.
- Hillaire S, Cazals-Hatem D, Erlinger S, Paradis V. Cystic fibrosis liver disease in adults: Limits of noninvasive tests of fibrosis. Hepatology. 2018 Feb;67(2):798-799. doi: 10.1002/hep.29637.
- Leung DH, Ye W, Molleston JP, et al. Cystic fibrosis liver di–sease network (CFLD NET). Baseline ultrasound and clinical correlates in children with cystic fibrosis. J Pediatr. 2015 Oct;167(4):862-868.e2. doi: 10.1016/j.jpeds.2015.06.062.
- Debray D, Narkewicz MR, Bodewes FAJA, et al. Cystic fibrosis-related liver disease. J Pediatr Gastroenterol Nutr. 2017;65:443-448. doi: 10.1097/MPG.0000000000001676.
- Sellers ZM, Assis DN, Paranjape SM, et al. Cystic fibrosis screening, evaluation, and management of hepatobiliary disease consensus recommendations. Hepatology. 2024;79(5):1220-1238. doi: 10.1097/HEP.0000000000000646.