Журнал "Гастроэнтерология" Том 58, №3, 2024
Вернуться к номеру
Гістологічні зміни слизової оболонки стравоходу та шлунка при грижах стравохідного отвору діафрагми
Авторы: O.M. Babii, B.F. Shevchenko, Yu.A. Gaidar, N.V. Prolom, D.F. Milostyva, O.P. Petishko
State Institution “Institute of Gastroenterology of the National Academy of Medical Sciences of Ukraine”, Dnipro, Ukraine
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
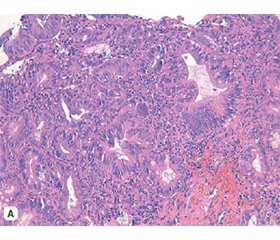
Актуальність. Морфологічні зміни слизової оболонки (СО) стравоходу залежать від тривалості перебігу рефлюкс-езофагіту. При грижі стравохідного отвору діафрагми (ГСОД) І типу морфологічні зміни виражені, простежується перехід патологічного процесу від запалення до метаплазії/дисплазії, тоді як при ГСОД ІІ типу зміни СО стравоходу мало виражені. Також супутньою патологією є наявність запалення СО шлунка, що впливає на етапність і строки лікування. Мета: дослідити гістологічні та морфометричні відмінності СО стравоходу та шлунка залежно від типу ГСОД. Матеріали та методи. Дослідження проводили на біопсійному матеріалі СО стравоходу та шлунка у хворих на ГСОД (n = 34), яких було розподілено залежно від її типу: І тип — аксіальна ГСОД (n = 24) та ІІ тип — параезофагеальна ГСОД (n = 10). Для вивчення гістологічної структури за допомогою ротаційного мікротома РM60-EКA отримували біоптати товщиною 5–7 мкм і проводили забарвлення гематоксилін-еозином. Щоб оцінити морфометричні дані, зрізи фотографували з використанням люмінесцентного мікроскопа XSZ-21 (Україна) та вимірювали за допомогою програмного забезпечення Image J.45S (США). Результати. Морфологічне дослідження показало, що розвиток патологічних змін у слизовій оболонці стравоходу на фоні ГСОД І типу супроводжувався збільшенням висоти базального шару в 62,5 % випадків, висоти сосочків — у 66,7 %, розширенням міжклітинного простору — у 83,3 %, наявністю еозинофілів в інфільтраті — у 20,8 %, лімфоплазмоцитарною запальною інфільтрацією — у 75,0 % (при ГСОД ІІ типу — у 70,0 %), балонною дегенерацією — у 33,3 % (при ГСОД ІІ типу — у 50,0 % випадків). Стравохід Барретта спостерігався в 23,5 % пацієнтів із ГСОД І типу: 14,7 % із них мали кишкову метаплазію за тонко- та товстокишковим типом, 8,8 % — дисплазію високого ступеня. При ГСОД І типу хронічний неатрофічний гастрит (ХНГ) діагностовано в 66,7 % випадків, хронічний атрофічний гастрит (ХАГ) — у 33,3 %, а при ГСОД II типу в усіх випадках спостерігався ХНГ. За даними морфометричних досліджень СО шлунка, при ХАГ та ХНГ на тлі ГСОД І типу встановлено вірогідну різницю за глибиною ямок (p < 0,05), довжиною фундальних залоз (p < 0,05), висотою поверхневого (p < 0,05) і ямкового епітелію (p < 0,05). Вірогідні зміни між ГСОД І та ІІ типу виявлено щодо товщини СО шлунка (p < 0,05). Найбільшу кількість клітин запального інфільтрату СО шлунка спостерігали при ХАГ на тлі ГСОД І типу (р < 0,05). Висновки. ГСОД супроводжується розвитком езофагіту, при гістологічному дослідженні якого виявлено збільшення висоти сосочків, базального шару, розширення міжклітинного простору, балонну дегенерацію, лімфоцитарно-нейтрофільну й еозинофільну інфільтрацію СО стравоходу. Морфометрично висота базального шару при ГСОД І типу перевищує норму на 86,9 % (р < 0,01), при ГСОД ІІ типу — на 68,8 % (р < 0,01), а висота сосочків — відповідно на 56,7 і 46,6 % (p < 0,01). Стравохід Барретта гістологічно діагностовано в 23,5 % хворих із ГСОД І типу. При ГСОД І типу ХНГ виявлено в 66,7 % випадків, ХАГ — у 33,3 %, а при ГСОД ІІ типу всі пацієнти мали ХНГ.
Background. Morphological changes in the esophageal mucosa depend on the duration of reflux esophagitis. In type I hiatal hernia (HH), morphological changes are pronounced, the transition of the pathological process from inflammation to metaplasia/dysplasia is observed, while in HH type II, changes in the esophageal mucosa are less significant. Another associated pathology is inflammation of the gastric mucosa, which affects the stages and duration of treatment. Purpose: to investigate histological and morphometric differences of the esophageal and gastric mucosa depending on the type of HH. Materials and methods. The study was conducted on biopsy material of the esophageal and gastric mucosa in patients with HH (n = 34) who were divided by its types: type I — axial HH (n = 24) and type II — paraesophageal HH (n = 10). To study the histological structure, biopsy sections 5–7 µm thick were cut using a rotary microtome РM60-EКA, and staining was carried out using the standard method with hematoxylin-eosin. To obtain morphometric data, the sections were photographed with a light microscope XSZ-21 (Ukraine) and measured using Image J.45S software (USA). Results. Morphological study has shown that the development of pathological changes in the esophageal mucosa on the background of HH type I was accompanied by an increase in the height of the basal layer in 62.5 % of cases, an increase in the height of the papillae in 66.7 %, an expansion of the intercellular space in 83.3 %, the presence of eosinophils in the infiltrate in 20.8 %, lympho-plasmacytic inflammatory infiltration in 75.0 % (with HH type II, in 70.0 %), ballooning degeneration — in 33.3 % of cases (with HH type II, in 50.0 % of cases). Barrett’s esophagus was observed in 23.5 % of patients with HH type I: 14.7 % had intestinal metaplasia of the small- and large-intestine type, and 8.8 % had high-grade dysplasia. In HH type I, chronic non-atrophic gastritis (CNG) was diagnosed in 66.7 % of cases and chronic atrophic gastritis (CAG) — in 33.3 %, whereas in HH type II, CNG was diagnosed in all cases. According to morphometric studies of the gastric mucosa in case of CAG and CNG against the background of HH type I, a significant difference was found in the depth of the pits (p < 0.05), the length of fundic glands (p < 0.05), the height of the surface epithelium (p < 0.05) and the foveolar epithelium (p < 0.05). Significant changes between HH type I and type II were found regarding the thickness of the gastric mucosa (p < 0.05). The highest number of cells of the inflammatory infiltrate of the gastric CO was observed in CAG against the background of type I HH (p < 0.05). Conclusions. HH is accompanied by the development of esophagitis, the histological examination of which revealed an increase in the height of the papillae, basal layer, expansion of the intercellular space, ballooning degeneration, lymphocytic-neutrophilic and eosinophilic infiltration of the esophageal mucosa. The height of the basal layer in HH type I exceeds the norm morphometrically by 86.9 % (p < 0.01), in HH type II — by 68.8 % (p < 0.01), and the height of the papillae — by 56.7 and 46.6 %, respectively (p < 0.01). In HH type I, 23.5 % of patients were histologically diagnosed with Barrett’s esophagus. In HH type I, CNG was diagnosed in 66.7 % of cases, CAG — in 33.3 % of cases, and in HH type II, all patients had CNG.
грижа стравохідного отвору діафрагми; слизова оболонка стравоходу; слизова оболонка шлунка; гістологічний та морфометричний аналіз
hiatal hernia; esophageal mucosa; gastric mucosa; histological and morphometric analysis
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Lisovsky M. Inflammatory conditions of the esophagus: an update. Annals of the New York Academy of Sciences. 2020. Vol. 1481, No 1. P. 5-10. doi: 10.1111/nyas.14450.
- Does hiatal hernia impact gastro-oesophageal reflux-related chronic cough? / O. Truba et al. ERJ Open Research. 2023. Vol. 9, No 2. P. 00669-2022. doi: 10.1183/23120541.00669-2022.
- The pathological conditions and surgical outcomes depending on the degree of hernia in the intra-thoracic stomach / K. Tsuboi et al. Esophagus. 2023. Vol. 20, No 3. P. 573-580. doi: 10.1007/s10388-022-00979-6.
- Current status of surveillance for Barrett’s esophagus in Japan and the West / T. Koike et al. DEN open. 2022. Vol. 2, No 1. P. e94. doi: 10.1002/deo2.94.
- Fassari A., De Blasi V., Basile M., Perretta S. Atrial Flutter After Radiofrequency Ablation for Barrett’s Esophagus: A Case Report. Am J Case Rep. 2023. No 24. P. e941264. doi: 10.12659/AJCR.941264.
- Gastritis: update on etiological features and histological practical approach / G. Pennelli et al. Pathologica. 2020. Vol. 112, No 3. P. 153-165. doi: 10.32074/1591-951X-163.
- Kahrilas P.J., Kim H.C., PandolfiNo J.E. Approaches to the diagnosis and grading of hiatal hernia. Best Pract Res Clin Gastroente–rol. 2008. Vol. 22, No 4. P. 601-616. doi: 10.1016/j.bpg.2007.12.007.
- Gastritis staging in clinical practice: the OLGA staging system / M. Rugge et al. Gut. 2007. Vol. 56, No 5. P. 631-636. doi: 10.1136/gut.2006.106666.
- Lowrie D.J. Histology. Thieme; Illustrated edition, 2020. 428 p.
- Gyawali C.P., Sonu I., Becker L., Sarosiek J. The esophageal mucosal barrier in health and disease: mucosal pathophysiology and protective mechanisms. Annals of the New York Academy of Sciences. 2020. Vol. 1482, No 1. P. 49-60. doi: 10.1111/nyas.14521.
- Gastro-esophageal reflux disease and Barrett’s esophagus: an overview with an histologic diagnostic approach / L. Mastracci et al. Pathologica. 2020. Vol. 112, No 3. P. 117-127. doi: 10.32074/1591-951X-162.
- Fassan M. The Thin Red Line between Pathological and Physiological Inflammatory Background in the Gastric Mucosa. Dig Dis. 2022. Vol. 40, No 6. P. 691-692. doi: 10.1159/000521610.
- Iwamuro M., Urata H., Tanaka T., Okada H. Application of electron microscopy in gastroenterology. World J Gastrointest Pathophysiology. 2022. Vol. 13, No 2. P. 41-49. doi: 10.4291/wjgp.v13.i2.41.
- Inflammatory and Proliferative Pathway Activation in Human Esophageal Myofibroblasts Treated with Acidic Bile Salts / M. Patankar et al. International Journal of Molecular Sciences. 2022. Vol. 23, No 18. P. 10371. doi: 10.3390/ijms231810371.
- Tight junctions: from molecules to gastrointestinal disea–ses / A. Moonwiriyakit et al. Tissue Barriers. 2023. Vol. 11, No 2. P. 2077620. doi: 10.1080/21688370.2022.2077620.
- Mucosal pathogenesis in gastro-esophageal reflux disease / A. Ustaoglu et al. Neurogastroenterol Motil. 2020. Vol. 32, No 12. P. e14022. doi: 10.1111/nmo.14022.
- Kaurrany M.R., Akil M.A., Punagi A.Q., Parewangi A.M.L. Clinical profile and characteristics of eosinophilic esophagitis patients presenting with refractory gastroesophageal reflux disease in Makassar, Indonesia. The Pan African Medical Journal. 2022. No 41. P. 93. doi: 10.11604/pamj.2022.41.93.31341.
- Muir А., Falk G.W. Eosinophilic Esophagitis: A Review. JAMA. 2021. Vol. 326, No 13. P. 1310-1318. doi: 10.1001/jama.2021.14920.
- Esophageal Epithelium and Lamina Propria Are Unevenly Involved in Eosinophilic Esophagitis / G. Hiremath et al. Clinical Gastroenterology Hepatology. 2023. Vol. 21, No 11. P. 2807-2816.e3. doi: 10.1016/j.cgh.2023.03.014.
- Eosinophilic Esophagitis Histologic Scoring System: Correlation with Histologic, Endoscopic, and Symptomatic Disease and Clini–cal Use / R.G. Аlexander et al. Digestive Diseases and Sciences. 2023. Vol. 68, No 9. P. 3573-3583. doi: 10.1007/s10620-023-08029-6.
- Zachariah R.A., Goo T., Lee R.H. Mechanism and Pathophysiology of Gastroesophageal Reflux Disease. Gastrointestinal endo–scopy clinics of North America. 2020. Vol. 30, No 2. P. 209-226. doi: 10.1016/j.giec.2019.12.001.
- Wong S., Ruszkiewicz A., Holloway R.H., Nguyen N.Q. Gastro-oesophageal reflux disease and eosinophilic oesophagitis: What is the relationship? World Journal of Gastrointestinal Pathophysiology. 2018. Vol. 9, No 3. P. 63-72. doi: 10.4291/wjgp.v9.i3.63.
- CD8 T-Cell-Predominant Lymphocytic Esophagitis is One of the Major Patterns of Lymphocytic Inflammation in Gastroesophageal Reflux Disease / R. Moiseff et al. Archives of Pathology & Laboratory Medicine. 2021. Vol. 145, No 9. P. 1138-1143. doi: 10.5858/arpa.2020-0430-OA.
- Lymphocytic Esophagitis: Assessing Risk Factors and Clinical Outcomes / H.B. Zaver et al. Digestive Diseases and Sciences. 2021. Vol. 66, No 11. P. 3976-3984. doi: 10.1007/s10620-020-06706-4.
- Alkhowaiter S. Eosinophilic esophagitis. Saudi Medi–cal Journal. 2023. Vol. 44, No 7. P. 640-646. doi: 10.15537/smj.2023.44.7.20220812.
- Eusebi L.H., Cirota G.G., Zagari R.M., Ford A.C. Global prevalence of Barrett’s oesophagus and oesophageal cancer in individuals with gastro-oesophageal reflux: a systematic review and meta-analysis. Gut. 2021. Vol. 70, No 3. P. 456-463. doi: 10.1136/gutjnl-2020-321365.
- Esophageal Hypocontractile Disorders and Hiatal Hernia Size Are Predictors for Long Segment Barrett’s Esophagus / F. Shibli et al. J Neurogastroenterol Motil. 2023. Vol. 29, No 1. P. 31-37. doi: 10.5056/jnm21255.
- Andrici J., Tio M., Cox M.R., Eslick G.D. Hiatal hernia and the risk of Barrett’s esophagus. J Gastroenterol Hepatol. 2013. Vol. 28, No 3. P. 415-431. doi: 10.1111/j.1440-1746.2012.07199.x.
- Hiatal Hernia Associated with Higher Odds of Dysplasia in Patients with Barrett’s Esophagus / J.Y. Kwon et al. Dig Dis Sci. 2021. Vol. 66, No 8. P. 2717-2723. doi: 10.1007/s10620-020-06559-x.
- Morphometric features of gastric mucosa in atrophic gastritis: A different pattern between corpus and antrum / X.M. Lin et al. Medi–cine (Baltimore). 2023. Vol. 102, No 14. P. e33480. doi: 10.1097/MD.0000000000033480.