Журнал "Гастроэнтерология" Том 58, №3, 2024
Вернуться к номеру
Суміш мурамілпептидів пригнічує запалення та покращує структуру кишкового бар’єра в моделі культури клітин
Авторы: D.M. Masiuk, V.S. Nedzvetsky
Dnipro State Agrarian and Economic University, Dnipro, Ukraine
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
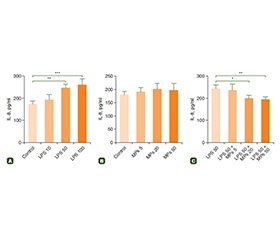
Актуальність. Кишковий бар’єр є вирішальною структурою в підтримці балансу між проникністю перетравленої їжі та обмеженням мікробної інвазії з внутрішнього середовища. Порушення цих функцій тісно пов’язане з виникненням реактивності кишкового епітелію та запалення. Запалення є найчастішою причиною порушень функції кишечника. Мурамілпептиди (МП) — це невеликі сигнальні молекули, які стимулюють внутрішньоклітинні рецептори патогенів і є потужними регуляторами відповіді клітин. Проте молекулярні механізми впливу МП на клітини залишаються невідомими. Мета: дослідження застосування МП для підтримки життєздатності клітин Caco-2 було спрямоване на вивчення цитопротекторного впливу пробіотиків на основі мурамілдипептиду на запалення кишечника та цілісність кишкового бар’єра. Матеріали та методи. Клітини Caco-2 обробляли 10–100 мкг/мл ліпополісахариду (ЛПС), 5–50 мкг/мл МП і комбінацією ЛПС і МП. Життєздатність клітин оцінювали за допомогою МТТ-тесту. Вміст оклюдину вивчали за допомогою вестерн-блотингу. Для оцінки продукції інтерлейкіну-8 (ІЛ-8) застосовували імуноферментний аналіз. Результати. Отримані результати показали, що ЛПС у дозі 10–100 мкг/мл викликає зниження життєздатноісті клітин і вмісту оклюдину. Навпаки, вміст ІЛ-8 був підвищений при обробці ЛПС, що свідчить про дозозалежні прозапальні зміни в клітинах Caco-2. Жодних істотних змін не виявлено в клітинах, які обробляли МП в дозах 5–50 мкг/мл. Однак застосування дози МП 50 мкг/мл зменшувало збільшення продукції ІЛ-8 у клітинах, оброблених ЛПС. Крім того, МП показали дозозалежний цитопротекторний ефект щодо життєздатності клітин у дозах 20 і 50 мкг/мл. Також доза МП 50 мкг/мл сприяла відновленню рівня оклюдину в клітинах, які були оброблені ЛПС. Висновки. Зважаючи, що оклюдин є одним із основних компонентів щільних контактів, МП можуть відновити цілісність епітеліального бар’єра в ураженому кишечнику. Отримані результати показали, що МП є перспективним засобом при спричинених запаленням ушкодженнях кишечника, а також для підтримки бар’єрної функції.
Background. The intestinal barrier is a crucial structure for maintaining the balance in permeability of digested food and restriction of microbial invasion from internal environment. Imbalance in these functions closely related to the initiation of intestinal epithelium reactivity and inflammation. Inflammation is the most common cause of intestinal dysfunction. Muramyl peptides (MPs) are small signaling molecules which stimulate intracellular receptors of pathogens and are potent regulators of cell response. However, molecular mechanisms of MP effect on intestinal cells remain unknown. The study of MP application to maintain viability of Caco-2 cells was aimed to explore the cytoprotective effect of MP-based probiotic on gut inflammation and intestinal barrier integrity. Materials and methods. Caco-2 cells were treated with 10–100 µg/ml lipopolysaccharide (LPS), 5–50 µg/ml MPs and combination of LPS + MPs. Cell viability was measured with MTT assay. Occludin content was detected with Western blotting. Enzyme-linked immunosorbent assay was applied to assess interleukin-8 (IL-8) production. Results. Obtained results have shown that LPS treatment with doses of 10–100 µg/ml induced in a decrease in cell viability and occludin content. On the contrary, IL-8 content was increased in LPS treatment that evidence the dose-dependent proinflammatory changes in Caco-2 cells. No significant changes were detected in the cells exposed to 5–50 µg/ml doses of MPs. However, application of 50 µg/ml of MPs inhibited IL-8 upregulation in LPS-exposed cells. Besides, MPs exhibited a dose-dependent cytoprotective effect in respect to cell viability at a dose of 20 and 50 µg/ml. Furthermore, MP dose of 50 µg/ml helped restore occludin content in LPS-exposed cells. Conclusions. Taking into the account that occludin is one of major components of tight junctions, MPs can restore epithelial barrier integrity in compromised gut. Observed results demonstrated that MPs is a promising agent in inflammation-induced intestinal injury and maintaining gut barrier function.
щільні контакти; оклюдин; інтерлейкін-8; запалення кишечника
tight junctions; occludin; interleukin-8; gut inflammation
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Gieryńska M, Szulc-Dąbrowska L, Struzik J, Mielcarska MB, Gregorczyk-Zboroch KP. Integrity of the Intestinal Barrier: The Involvement of Epithelial Cells and Microbiota — A Mutual Relationship. Animals (Basel). 2022;12(2):145. doi: 10.3390/ani12020145.
- Masiuk DM, Kokariev AV, Buzoianu SG, Firth AM, Nedzvetsky VS. An isotonic protein solution favorably modulated the porcine intestinal immune response and cellular adhesion markers and reduced PEDV shedding in vivo. Vet Immunol Immunopathol. 2024;271:110753. doi: 10.1016/j.vetimm.2024.110753.
- Suzuki T. Regulation of the intestinal barrier by nutrients: The role of tight junctions. Anim Sci J. 2020;91(1):e13357. doi: 10.1111/asj.13357.
- Groschwitz KR, Hogan SP. Intestinal barrier function: molecular regulation and disease pathogenesis. J Allergy Clin Immunol. 2009;124(1):3-22. doi: 10.1016/j.jaci.2009.05.038.
- Al-Sadi R, Khatib K, Guo S, Ye D, Youssef M, Ma T. Occludin regulates macromolecule flux across the intestinal epithelial tight junction barrier. Am J Physiol Gastrointest Liver Physiol. 2011;300(6):G1054-G1064. doi: 10.1152/ajpgi.00055.2011.
- Zhao J, Wan S, Sun N, et al. Damage to intestinal barrier integrity in piglets caused by porcine reproductive and respiratory syndrome virus infection. Vet Res. 2021;52(1):93. doi: 10.1186/s13567-021-00965-3.
- Sun Q, Liu X, Li X. Peptidoglycan-based immunomodulation. Appl Microbiol Biotechnol. 2022;106(3):981-993. doi: 10.1007/s00253-022-11795-4.
- Martínez-Sánchez LDC, Ngo PA, Pradhan R, et al. Epithelial RAC1-dependent cytoskeleton dynamics controls cell mechanics, cell shedding and barrier integrity in intestinal inflammation. Gut. 2023;72(2):275-294. doi: 10.1136/gutjnl-2021-325520.
- Wullaert A, Bonnet MC, Pasparakis M. NF-κB in the re–gulation of epithelial homeostasis and inflammation. Cell Res. 2011;21(1):146-158. doi: 10.1038/cr.2010.175.
- Stephens M, von der Weid PY. Lipopolysaccharides mo–dulate intestinal epithelial permeability and inflammation in a species-specific manner. Gut Microbes. 2020;11(3):421-432. doi: 10.1080/19490976.2019.1629235.
- Han SH, Lee HD, Lee S, Lee AY. Taraxacum coreanum Nakai extract attenuates lipopolysaccharide-induced inflammatory responses and intestinal barrier dysfunction in Caco-2 cells. J Ethnopharmacol. 2024;319 (Pt 1):117105. doi: 10.1016/j.jep.2023.117105.
- Miner-Williams WM, Moughan PJ. Intestinal barrier dysfunction: implications for chronic inflammatory conditions of the bowel. Nutr Res Rev. 2016;29(1):40-59. doi: 10.1017/S0954422416000019.
- Nowarski R, Jackson R, Flavell RA. The Stromal Intervention: Regulation of Immunity and Inflammation at the Epithelial-–Mesenchymal Barrier. Cell. 2017;168(3):362-375. doi: 10.1016/j.cell.2016.11.040.
- Alzoghaibi MA. Concepts of oxidative stress and antioxidant defense in Crohn’s disease. World J Gastroenterol. 2013;19(39):6540-6547. doi: 10.3748/wjg.v19.i39.6540.
- You Y, Xiao Y, Lu Y, et al. Postbiotic muramyl dipeptide alleviates colitis via activating autophagy in intestinal epithelial cells. Front Pharmacol. 2022;13:1052644. doi: 10.3389/fphar.2022.1052644.
- Irazoki O, Hernandez SB, Cava F. Peptidoglycan Muropeptides: Release, Perception, and Functions as Signaling Molecules. Front Microbiol. 2019;10:500. doi: 10.3389/fmicb.2019.00500.
- Liu T, Zhang L, Joo D, Sun SC. NF-κB signaling in inflammation. Signal Transduct Target Ther. 2017;2:17023. doi: 10.1038/sigtrans.2017.23.
- Sittipo P, Anggradita LD, Kim H, et al. Cell Surface Modification-Mediated Primary Intestinal Epithelial Cell Culture Platforms for Assessing Host-Microbiota Interactions. Biomater Res. 2024;28:0004. doi: 10.34133/bmr.0004.
- Nedzvetsky VS, Agca CA, Baydas G. The peptidoglycan fraction enriched with muramyl pentapeptide from Lactobacillus bulgaricus inhibits glioblastoma U373MG cell migration capability and upregulates parp1 and NF-kB levels. Biotechnol Acta. 2020; 13(2):65-79. doi: 10.15407/biotech13.02.065.
- Váradi J, Harazin A, Fenyvesi F, et al. Alpha-Melanocyte Stimulating Hormone Protects against Cytokine-Induced Bar–rier Damage in Caco-2 Intestinal Epithelial Monolayers. PLoS One. 2017;12(1):e0170537. doi: 10.1371/journal.pone.0170537.
- Yefimov V, Kostiushkevych, K, Rakytianskyi V. Effect of fee–ding treated peat as a supplement on the parameters of cellular immunity, antioxidant status and performance of piglets in early post-weaning period. Hum Vet Med. 2016;8(3):133-136.
- Mukhopadhya A, Noronha N, Bahar B, et al. Anti-inflammatory effects of a casein hydrolysate and its peptide-enriched fractions on TNFα-challenged Caco-2 cells and LPS-challenged porcine colonic explants. Food Sci Nutr. 2014;2(6):712-723. doi: 10.1002/fsn3.153.
- Wu XX, Huang XL, Chen RR, et al. Paeoniflorin Prevents Intestinal Barrier Disruption and Inhibits Lipopolysaccharide (LPS)-–Induced Inflammation in Caco-2 Cell Monolayers. Inflammation. 2019;42(6):2215-2225. doi: 10.1007/s10753-019-01085-z.
- Wang JW, Pan YB, Cao YQ, et al. Loganin alleviates LPS-activated intestinal epithelial inflammation by regulating TLR4/NF-κB and JAK/STAT3 signaling pathways. Kaohsiung J Med Sci. 2020;36(4):257-264. doi: 10.1002/kjm2.12160.
- Rathinam VAK, Zhao Y, Shao F. Innate immunity to intracellular LPS. Nat Immunol. 2019;20(5):527-533. doi: 10.1038/s41590-019-0368-3.
- Zhang YJ, Wu Q. Sulforaphane protects intestinal epithe–lial cells against lipopolysaccharide-induced injury by activating the AMPK/SIRT1/PGC-1α pathway. Bioengineered. 2021;12(1):4349-4360. doi: 10.1080/21655979.2021.1952368.
- Di Vincenzo F, Del Gaudio A, Petito V, Lopetuso LR, Scaldaferri F. Gut microbiota, intestinal permeability, and systemic inflammation: a narrative review. Intern Emerg Med. 2024;19(2):275-293. doi: 10.1007/s11739-023-03374-w.
- Zhang LM, Xin Y, Song RX, et al. CORM-3 alleviates the intestinal injury in a rodent model of hemorrhage shock and resuscitation: roles of GFAP-positive glia. J Mol Histol. 2023;54(4):271-282. doi: 10.1007/s10735-023-10133-w.
- Melo HM, Santos LE, Ferreira ST. Diet-Derived Fatty Acids, Brain Inflammation, and Mental Health. Front Neurosci. 2019;13:265. doi: 10.3389/fnins.2019.00265.
- Li X, Mao M, Zhang Y, Yu K, Zhu W. Succinate Modulates Intestinal Barrier Function and Inflammation Response in Pigs. Biomolecules. 2019;9(9):486. doi: 10.3390/biom9090486.
- Mayorgas A, Dotti I, Salas A. Microbial Metabolites, Postbiotics, and Intestinal Epithelial Function. Mol Nutr Food Res. 2021;65(5):e2000188. doi: 10.1002/mnfr.202000188.
- Merchand-Reyes G, Bull MF, Santhanam R, et al. NOD2 activation enhances macrophage Fcγ receptor function and may increase the efficacy of antibody therapy. Front Immunol. 2024;15:1409333. doi: 10.3389/fimmu.2024.1409333.
- Reddy PRS, Sambyal S, Mhamane TB, et al. Synthesis and biological evaluation of novel 2-azido muramyl dipeptide as NOD2 ago–nistic adjuvants. Bioorg Med Chem. 2022;66:116781. doi: 10.1016/j.bmc.2022.116781.
- Chen G, Ran X, Li B, et al. Sodium Butyrate Inhibits Inflammation and Maintains Epithelium Barrier Integrity in a TNBS-induced Inflammatory Bowel Disease Mice Model. EBioMedicine. 2018;30:317-325. doi: 10.1016/j.ebiom.2018.03.030.
- Di Tommaso N, Gasbarrini A, Ponziani FR. Intestinal Barrier in Human Health and Disease. Int J Environ Res Public Health. 2021;18(23):12836. doi: 10.3390/ijerph182312836.
- Xu J, Liang R, Zhang W, et al. Faecalibacterium prausnitzii-derived microbial anti-inflammatory molecule regulates intestinal integrity in diabetes mellitus mice via modulating tight junction protein expression. J Diabetes. 2020;12(3):224-236. doi: 10.1111/1753-0407.12986.
- Sánchez de Medina F, Romero-Calvo I, Mascaraque C, Martínez-Augustin O. Intestinal inflammation and mucosal barrier function. Inflamm Bowel Dis. 2014;20(12):2394-2404. doi: 10.1097/MIB.0000000000000204.
- Fichera GA, Fichera M, Milone G. Antitumoural activity of a cytotoxic peptide of Lactobacillus casei peptidoglycan and its interaction with mitochondrial-bound hexokinase. Anticancer Drugs. 2016;27(7):609-619. doi: 10.1097/CAD.0000000000000367.
- Heim VJ, Stafford CA, Nachbur U. NOD Signaling and Cell Death. Front Cell Dev Biol. 2019;7:208. doi: 10.3389/fcell.2019.00208.