Вступ
Минуло кілька років відтоді, як Р. Coumel et al. [1, 2] подали концепцію трикутника Кумеля, засновану на спостереженні, що для розвитку тахіаритмії потрібні три основні компоненти: провокуючі фактори, аритмогенний субстрат і модулюючі фактори; серед останніх найважливішим є вегетативна нервова система (ВНС). Дійсно, кілька досліджень, що ґрунтуються на використанні 24-годинного холтерівського моніторування ЕКГ та електрофізіологічних досліджень, довели беззаперечну роль ВНС у складному патофізіологічному механізмі розвитку фібриляції передсердь (ФП) [2].
Цікаво, що ми вже давно звикли класифікувати й диференціювати вагусну й адренергічну ФП на підставі більшої чи меншої залученості того самого симпатичного або вагусного тонусу в момент клінічного прояву. Однак така жорстка класифікація суперечить клінічній реальності, яка нерідко характеризується наявністю вагусної та адренергічної форм ФП, що можуть співіснувати в тих самих пацієнтів [2, 3].
Ця передумова підкреслює: 1) те, що в реальній клінічній практиці зустрічаються ситуації, які не завжди так легко класифікувати, і 2) необхідність дедалі більш індивідуалізованого фармакологічного й електрофізіологічного лікування, спрямованого на корекцію різних патофізіологічних, біомолекулярних і генетичних механізмів, що є першопричиною дисбалансу тонусу ВНС.
Клінічні сценарії фібриляції передсердь, вторинної щодо дисбалансу вегетативної нервової системи
Стандартний клінічний сценарій
У багатьох пацієнтів з анамнезом пароксизмальної форми ФП, вторинної щодо ураження ВНС, ми зазвичай визначаємо два різних клінічних сценарії: адренергічну ФП і вагусну ФП [2]. Адренергічна форма ФП найчастіше виникає протягом дня, з денними епізодами, і провокується психофізичним стресом і фізичною активністю. Інколи такі самі ознаки можна спостерігати в пацієнтів з гіпертиреозом і феохромоцитомою. Вагусна ФП найчастіше вражає чоловіків і молодих (вік 30–50 років) пацієнтів без структурних захворювань серця. Вона частіше трапляється в пацієнтів з брадикардією, з нападами під час нічного відпочинку або відпочинку після вживання їжі; вважається, що провокуючими факторами є великі порції їжі, особливо ввечері, а також зловживання алкоголем. Крім того, у пацієнтів з адренергічною ФП значно частіше виявляють структурні ураження серця, ніж при вагусно-опосередкованих формах ФП. Однак ця клінічна диференціація, хоч і занадто жорстка і схематична, знаходить раціональне пояснення в анатомічних, патофізіологічних (рис. 1), а також біомолекулярних механізмах, що лежать в основі ролі ВНС у виникненні й збереженні ФП [4]. Фактично фокальний механізм ФП зумовлений:
/31.jpg)
1) симпатичним внеском у виникнення ФП через автоматизм (завдяки зменшенню вхідного калієвого струму і збільшенню струму, що активується гіперполяризацією під час діастолічної деполяризації) ранніх передсердних генеруючих деполяризацій (які впливають на 2-гу фазу потенціалу дії передсердь) і пізніх передсердних індукуючих деполяризацій унаслідок перевантаження кальцієм та аномального вивільнення кальцію саркоплазматичним ретикулумом;
2) адренергічним і вагусним внесками (червоні лінії та стрілки) за допомогою активації G-білків, регульованих калієвими каналами вхідного випрямлення (GIRK); і нарешті,
3) парасимпатичним внеском у механізми re-entry.
Крім того, кілька досліджень виявили причину, через яку адренергічна ФП зазвичай припиняється спонтанно, тоді як вагусна ФП має тенденцію зберігатися. В одному з них Т. Ashihara et al. [5], використовуючи модель іонного каналу, спостерігали, чи спіральна хвиля re-entry, індукована вагусною та адренергічною стимуляцією, має тенденцію до підтримання або переривання. Дійсно, після симпатичної стимуляції хвилі мали тенденцію до організації та негайного припинення, тоді як після парасимпатичної стимуляції за наявності просторової дисперсії рефрактерності спіральні хвилі re-entry мали тенденцію до збереження. Як згадувалося раніше, часто відбувається так, що ФП формується вторинно щодо вагусної форми й обидва симпатичні дисбаланси можуть співіснувати в тих самих пацієнтів. Фактично de Vos et al. [3], аналізуючи пацієнтів, включених до Euro Heart Survey, зазначили, що пацієнти з пароксизмальною ФП, пов’язаною з вегетативними провокуючими факторами, були розподілені таким чином: вагусна форма — 6 %, адренергічна форма — 15 % і змішана форма (вагусно-адренергічна) — 12 %.
Не слід недооцінювати те, що в більшості клінічних проявів ФП, пов’язаних з симпатовагусним дисбалансом, можна розпізнати кілька динамічних провокуючих факторів [4]. Фактично дуже часто корекція та лікування таких динамічних факторів значно знижують частоту рецидивів ФП. Серед них особливо важливими в клінічному сценарії вважаються ожиріння й синдром обструктивного апное сну (СОАС). Відомо, що вісцеральний жир (черевний, епікардіальний тощо) є справжньою запальною тканиною, здатною виробляти прозапальні молекули (цитокіни, фактори росту), які можуть сприяти виникненню і збереженню ФП [6]. Крім того, у пацієнтів із СОАС нічні гіпоксичні події можуть сприяти виникненню ФП переважно внаслідок вагусного біомолекулярного механізму, а також у результаті активації лівого зірчастого ганглія, що може перешкоджати скороченню ефективного рефрактерного періоду. У той же час у пацієнтів із СОАС і ожирінням спостерігаються підвищене гіпоксичне ушкодження, запалення, оксидативний стрес і схильність до міопатії лівого передсердя [4]. Дійсно, у спортсменів з переважаючою вагусною активністю в стані спокою і під час фізичної активності низької інтенсивності спостерігаються епізоди вагусної ФП. З іншого боку, інший сценарій, що характеризується адренергічно-опосередкованою ФП, виникає в спортсменів, які піддаються високій симпатичній активності під час гострих напружених фізичних навантажень на витривалість [7]. Тому не слід забувати про вагусно-опосередковану механічну роль при ковтанні (гастроезофагеальний рефлюкс) і швидкому вживанні холодної їжі та напоїв. Крім того, кілька досліджень продемонстрували зв’язок між вживанням їжі та ФП через механізм, пов’язаний із симпатовагусним дисбалансом. Дійсно, схоже, що дієта з переважним споживанням низьковуглеводної їжі може бути пов’язана з підвищеним ризиком рецидиву ФП через підвищений оксидативний стрес, який також може сприяти порушенню балансу центральної нервової системи [4]. Також відомо, що помірний або високий ступінь споживання алкоголю теж пов’язаний з розвитком ФП. Найважливіший механізм, що є причиною виникнення ФП, пов’язаний зі змінним спектром клінічних ситуацій, зокрема з переважанням вагусної або гіперадренергічної активності, а також зі змішаними формами, що інколи трапляється в пацієнтів зі структурними захворюваннями серця.
Синкопе, вегетативна нервова система і фібриляція передсердь: що ми знаємо й що нам слід знати
Синкопе — це минуща втрата свідомості внаслідок церебральної гіпоперфузії, що характеризується швидким початком, короткочасністю й спонтанним повним відновленням [8]. Згідно з патофізіологічною класифікацією синкопе виділяють три основні групи: рефлекторне синкопе, серцево-судинне синкопе і синкопе, спричинене ортостатичною гіпотензією.
Синкопе і ФП — це клінічні сценарії, які нерідко можуть співіснувати в тих самих пацієнтів. Патофізіологічний механізм дуже мінливий, а інколи навіть невизначений, залежно від початкової клінічної картини і характеристик пацієнта. Фактично в реальній клінічній практиці трапляється, що в пацієнтів (часто похилого віку) з постійною ФП можуть виникати синкопе внаслідок фізичної травми. У цьому конкретному випадку можлива дисфункція атріовентрикулярного (АВ) вузла, що вимагає імплантації кардіостимулятора. Іноді синкопальний епізод у пацієнтів з ФП пов’язаний з відновленням синусового ритму, якому передує значна електрична пауза, що вказує на дисфункцію синоатріального (СА) вузла; у такій ситуації потрібні терапевтичні заходи, починаючи від оптимізації медикаментозного лікування і закінчуючи радикальною електростимуляцією серця [9].
При цьому, якщо одразу після синкопального епізоду діагностується ФП з такими характеристиками: 1) синкопе, якому передують різні продромальні явища, такі як відчуття припливів крові, потовиділення, нудота, біль або дискомфорт у животі, запаморочення і блідість, і 2) синкопе виникає в певних ситуаціях, наприклад після нічного сечовипускання або після вживання великої порції їжі, то, безумовно, ми маємо справу з вагусною формою ФП, пов’язаною з нейроопосередкованим синкопе [8].
Однак у цьому складному сценарії ФП/синкопе присутні структурні захворювання серця (стеноз аорти, ішемічна хвороба серця, гіпертрофічна кардіоміопатія, пухлини серця, захворювання перикарда/тампонада серця, вроджені аномалії коронарних артерій, дисфункція протезного клапана) та інші клінічні стани (такі як тромбоемболія легеневої артерії, гостре розшарування аорти та легенева гіпертензія), які можуть сприяти виникненню синкопальних станів унаслідок гемодинамічних змін, характерних для первинної патології та незалежних від наявності ФП [8].
Насамкінець варто зазначити, що раніше була описана роль дисбалансу ВНС при епілептичних нападах, включно із синусовою тахікардією, яка виникає у 80–100 % пацієнтів, і синусовою брадикардією, яка виникає приблизно в 5 % пацієнтів. Крім того, кілька досліджень продемонстрували рідкісну, але можливу наявність ФП і тріпотіння передсердь. Дійсно, загалом вважається, що механізмом, відповідальним за виникнення ФП, є підвищення вагусного тонусу під час нападу, що веде до синусової брадикардії. Крім того, деякі аритмії, що спостерігаються в пацієнтів з іктальними епілептичними нападами, мають різний прогноз залежно від того, з’являються вони під час іктальної чи постіктальної фази. Van der Lende et al. [10], оцінюючи наявність аритмічного навантаження під час і після нападу, помітили, що іктальна асистолія, іктальна брадикардія та іктальна атріовентрикулярна АВ-блокада виникали переважно під час фокальних епілептичних нападів і самоусувалися. Навпаки, постіктальні аритмії, зокрема асистолія, АВ-блокада і рідше — ФП і фібриляція шлуночків, зазвичай виникали після нападу і часто були пов’язані з раптовою смертю при епілепсії (SUDEP). Наостанок на рис. 2 схематично показано механізм, на якому ґрунтується зв’язок між аритміями та іктальними/постіктальними нападами.
/32.jpg)
Наріжні камені медикаментозної терапії: сьогодення та майбутнє
Нині серед антиаритмічних препаратів (АП) флекаїнід (клас IC) найширше використовують при ФП у структурно здорових серцях і в пацієнтів з вагусною формою ФП [11]. Кілька років тому на експериментальних тваринних моделях ефективність флекаїніду при вагусних формах ФП пояснили його найважливішими фармакологічними механізмами: уповільненням передсердної провідності та збільшенням ефективного передсердного рефрактерного періоду з тахікардіозалежним механізмом [12].
Серед АП класу IC оптимальні (100% ефективність) результати було отримано після застосування пілсикаїніду в собак, що демонструвало значне збільшення часу внутрішньопередсердної провідності та зниження індексу довжини хвилі [12]. Пропафенон, інший АП класу IC, не розглядається для використання в пацієнтів з вагусною ФП, оскільки він має власну бета-блокуючу активність, яка може потенціювати ефекти вагусного тонусу. У будь-якому разі такі характеристики всіх бета-блокаторів (АП класу IC) і препаратів з власною бета-блокуючою активністю можуть відігравати дуже важливу роль у терапевтичних стратегіях для пацієнтів з адренергічною ФП. Зрештою, сприятливі результати було одержано при застосуванні дизопіраміду (АП класу IА) через його значні властивості блокування натрієвих каналів і ваголітичні (пригнічує функцію блукаючого нерва) ефекти [12].
Що на нас чекає в майбутньому? Звичайно, ми не можемо недооцінювати наукові експерименти щодо нових АП [4]. У конкретному випадку впливу на вегетативну функцію мішенню цієї інноваційної медикаментозної терапії є малопровідні кальцій-залежні калієві канали (SK-канал), молекулярні мішені, що беруть участь у внутрішньоклітинній кінетиці кальцію, такі як Са2+/кальмодулін-залежна протеїнкіназа й ацетилхолін-керовані калієві струми (Ik, ACh).
Абляція серцевих гангліонарних сплетень і непряма серцева нейромодуляція
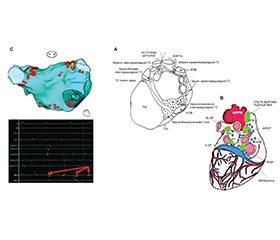
Відмінні анатомічні знання (рис. 3А) є обов’язковою умовою для кращого розуміння патофізіологічних механізмів і причин вибору на додаток до класичної ізоляції легеневих вен (ЛВ), абляційної стратегії, спрямованої на виконання абляції гангліонарних сплетень (ГС) на рівні анатомічних ділянок, де розташовані найважливіші ГС. Armour et al. [13] показали, що внутрішні передсердно-серцеві ганглії людини та пов’язані з ними нерви, розташовані в епікардіальній жировій тканині, утворюють п’ять ГС: 1) верхнє правопередсердне ГС (розташоване на задній верхній поверхні правого передсердя (ПП) поруч із місцем з’єднання верхньої порожнистої вени (ВПВ) і ПП), 2) верхнє лівопередсердне ГС (ганглії, що розташовані на задній поверхні лівого передсердя (ЛП) між легеневими венами (ЛВ)), 3) заднє правопередсердне ГС (на задній поверхні ЛП, що прилягає до міжпередсердної борозни), 4) задньосерединне лівопередсердне ГС (на задньосерединній поверхні ЛП) і 5) задньобокове лівопередсердне ГС (на задньобоковій поверхні основи лівого передсердя з передсердного боку від АВ-борозни). Окремі нейрони і невеликі ганглії також були розкиданими по тканинах передсердь і шлуночків (рис. 3А). Згодом Aksu and Pauza et al. [14] описали п’ять передсердних епікардіальних гангліонарних підсплетень (ГпС), що перебувають під нейронним контролем одного внутрішнього епікардіального ГС: 1) вентральне (переднє) правопередсердне ГпС, яке займає вентральну верхню частину правого передсердя, вентральний бік кореня верхньої порожнистої вени (ВПВ) і вентральну нижню частину правого передсердя; 2) вентральне (переднє) лівопередсердне ГпС, яке займає вентральну верхню частину лівого передсердя; 3) ліве дорсальне (заднє) ГпС, яке займає ділянку дорсальної лівої вінцевої борозни і середню частину лівого передсердя; 4) середнє дорсальне (заднє) ГпС, яке займає дорсальну верхню частину лівого передсердя та навколо серцевого м’яза; і 5) дорсальне (заднє) правопередсердне ГпС, яке займає дорсальну верхню частину правого передсердя, дорсальний бік кореня ВПВ і ділянку над міжпередсердною перегородкою. Цікаво також відзначити, що постгангліонарні нерви з вентрального правопередсердного ГпС можуть іннервувати синоатріальний вузол, тоді як нерви, що відходять від лівої, серединної та правої дор-сальних частин правого передсердя та (міжпередсердної) частини вентрального правопередсердного ГпС, можуть поширюватися до АВ-вузла. У зв’язку з цим Hou et al. [15] оцінили вплив вагусної стимуляції на функцію СА- та АВ-вузлів до і після послідовної абляції верхнього лівого гангліонарного сплетення (SLGP, поблизу з’єднання лівої верхньої ЛВ та лівої ЛВ), переднього правого гангліонарнго сплетення (ARGP, поблизу СА-вузла) і нижнього правого гангліонарного сплетення (IRGP, у місці з’єднання нижньої порожнистої вени і передсердь). Це дослідження підтвердило, що основні епікардіальні ГС можна розглядати як «об’єднавчі центри», що об’єднують автономну іннервацію між зовнішньою та внутрішньою ВНС серця. Насправді IRGP, імовірно, є інтеграційним центром для зовнішньої ВНС для іннервації АВ-вузла. Фактично в цьому дослідженні абляція IRGP, особливо якщо їй передувала послідовність абляції нижнього лівого гангліонарного сплетення (ILGP) — ARGP, показала значний вплив на функцію АВ-вузла, сповільнюючи реакцію, спричинену вагосимпатичною стимуляцією. Крім того, ARGP, імовірно, є центром інтеграції як для правого, так і для лівого вагосимпатичних стовбурів, модулюючи функцію СА-вузла (рис. 3A, 3B).
/34.jpg)
Найбільш ранні приклади вегетативної денерваційної абляції лівого передсердя були отримані при процедурах епікардіальної абляції на моделях тварин. У людини один з перших прикладів абляції ГС (хоч і не призначений безпосередньо для цього) було одержано в дослідженні Pappone et al. [16], які спостерігали покращений результат ізоляції ЛВ, коли це пов’язано зі значною вагусною реакцією, що викликається під час застосувань радіочастоти (РЧ). Протягом років було запропоновано кілька стратегій, що ґрунтуються на різних підходах: селективному чи анатомічному. За минулі роки підхід селективної абляції ГС (заснований на застосуванні РЧ у передсердній ділянці, де під час високочастотної стимуляції була викликана вагусна реакція) виявився менш ефективним, ніж анатомічний підхід, заснований натомість на доставці РЧ до анатомічних передсердних ділянок, місць розташування найважливіших серцевих ГС [17].
На додаток до лівопередсердного або двопередсердного абляційного підходу деякі міркування переконали нашу групу обмежити абляцію ГС у ПП як перший підхід, крім того, досягши доброго постпроцедурного успіху з погляду зменшення рецидивів вагусної ФП [18]. Дійсно, анатомічні дослідження, як згадувалося раніше, показують численне поширення гангліїв у ПП. «Третя жирова подушечка», розташована лише на рівні з’єднання між ПП і ВПВ і між ВПВ і аортою, вважається точкою входу вагусного імпульсу ГC перед іннервацією як ПП, так і ЛП. Ще одним доказом ефективності абляції правого передсердя є те, що правопередсердні ГС можуть дистанційно модулювати функцію лівопередсердних ГC через анатомічні взаємозв’язки [4]. Крім того, Caló et al. [18] зазначили, що ефективність анатомічного підходу може бути пов’язана зі ступенем ураження при абляції, оскільки точні анатомічні межі кластерів ГС достовірно не відомі.
Крім того, однією з найважливіших анатомічних і патофізіологічних цілей абляції правопередсердних ГС є ділянка IRGP. Це ГС, яке вважається об’єднавчим центром зовнішньої ВНС і воротами для функції АВ-вузла, імовірно, має вирішальне значення для досягнення значної вегетативної денервації. Крім того, особливо ефективними виявилися ідентифікація (за допомогою певних систем електроанатомічного картування) та абляція окремих високоамплітудних електрограм (HAFE, рис. 3C), вираження присутності волокон ВНС у контексті компактного міокарда. Не слід забувати, що Pachon et al. [19] протягом кількох років уперше подали концепцію кардіонейроабляції для лікування нейрокардіогенного синкопе, функціональної АВ-блокади та дисфункції СА-вузла. Справжньою метою цієї процедури була абляція ендокарда, спрямована на усунення постгангліонарних парасимпатичних нейронів тіла (рис. 1) над стінкою передсердя і всередині неї, нездатних до регенерації.
Зрештою, варто згадати про методи непрямої серцевої нейромодуляції. Ниркова симпатична денервація, зазвичай запропонована пацієнтам з неконтрольованою артеріальною гіпертензією, може відігравати важливу роль у лікуванні ФП, пов’язаної із симпатичним дисбалансом, особливо коли ця процедура пов’язана з ізоляцією легеневих вен [4]. Інші два приклади непрямої серцевої нейромодуляції представлені абляцією зірчастого ганглія та стимуляцією блукаючого нерва (наприклад, стимуляція вушної раковини), які показали сприятливі результати в плані пригнічення ФП на тваринних моделях.
Висновки
Дисбаланс ВНС — це одна з найчастіших причин ФП. Пов’язаний із цим складний патофізіологічний механізм пояснює велику різноманітність клінічних сценаріїв, які інколи можуть виходити за межі класичного і спрощеного визначення вагусної та адренергічної форм ФП. Протягом багатьох років з’явилися фармакологічні методи лікування (наприклад, терапія флекаїнідом і бета-блокаторами), спрямовані на різні вагусно- або адренергічно-опосередковані форми ФП, але не завжди з повним успіхом. Кардіонейроабляція з неоднорідно ефективними стратегіями (тільки ліве передсердя, два передсердя або праве передсердя) та інші методи непрямої серцевої нейромодуляції також було включено в цей сценарій.
Нарешті, зростання персоналізації медицини підкреслило необхідність одночасної корекції раніше згаданих динамічних факторів (дієта, СОАС, ожиріння, гастроезофагеальний рефлюкс, зловживання алкоголем тощо) і водночас зосередження уваги на нових методах лікування, як фармакологічних, так і заснованих на генній терапії [4–20, 21].
Фінансування. Не заявлено.
Конфлікт інтересів. Не заявлено.
Доступність даних. Жодних нових даних на підтримку цього дослідження отримано чи проаналізовано не було.
Список литературы
1. Farré J, Hein J. Philippe Coumel: a founding father of mo-dern arrhythmology. Europace. 2004;6:464-465.
2. Coumel P. Paroxysmal atrial fbrillation: a disorder of autonomic tone? Eur Heart J. 1994;15:9-16.
3. De Vos CB, Nieuwlaat R, Crijns HJGM, Camm AJ, LeHeuzey JY, Kirchhof CJ et al. Autonomic trigger patterns and anti-arrhythmic treatment of paroxysmal atrial fbrillation: data from the Euro Heart Survey. Eur Heart J. 2008;29:632-639.
4. Rebecchi M, Panattoni G, Edoardo B, De Ruvo E, Sciarra L, Politano A et al. Atrial fbrillation and autonomic nervous system: a translational approach to guide therapeutic goals. J Arrhythm. 2021;37:320-330.
5. Ashihara T, Yao T, Namba T, Kawase A, Ikeda T, Nakazawa K et al. Differences in sympathetic and vagal effects on paroxysmal atrial fbrillation: a simulation study. Biomed Pharmacother. 2002;56:359s-363s.
6. Mazurek T, Zhang L, Zalewski A, Mannion JD, Diehl JT, Arafat H et al. Human epicardial adipose tissue is a source of inflammatory mediators. Circulation. 2003;108:2460-2466.
7. Sanchis-Gomar F, Perez-Quilis C, Lippi G, Cervellin G, Leischik R, Löllgen H et al. Atrial fbrillation in highly trained endurance athletes — description of a syndrome. Int J Cardiol. 2017;226:11-20.
8. Brignole M, Moya A, de Lange FJ, Deharo JC, Elliott PM, Fanciulli A et al. 2018 ESC guidelines for the diagnosis and ma-nagement of syncope. Eur Heart J. 2018;39:1883-1948.
9. Hussain S, Jerry C. Syncope and atrial fbrillation: which is the chicken and which is the egg? J Atr Fibrillation. 2015;8:1175.
10. Van der Lende M, Surges R, Sander JW, Thijs RD. Cardiac arrhythmias during or after epileptic seizures. J Neurol Neurosurg Psychiatry. 2016;87:69-74.
11. Lavalle C, Magnocavallo M, Straito M, Santini L, Forleo GB, Grimaldi M et al. Flecainide how and when: a practical guide in supraventricular arrhythmias. J Clin Med. 2021;10:1456.
12. Rattanawong P, Kewcharoen J, Srivathsan KS, Shen WK. Drug therapy for vagally-mediated atrial fbrillation and sympatho-vagal balance in the genesis of atrial fbrillation: a review of the current literature. J Atr Fibrillation. 2020;13:2410.
13. Armour JA, Murph DA, Yuan BX, Macdonald S, Hopkins DA. Gross and microscopic anatomy of the human intrinsic cardiac nervous system. Anat Rec. 1997;247:289-298.
14. Aksu T, Gupta D, Pauza DH. Anatomy and physiology of intrinsic cardiac autonomic nervous system: Da Vinci Anatomy Card #2. J Am Coll Cardiol Case Rep. 2021;3:625-629.
15. Hou Y, Scherlag BJ, Lin J, Zhang Y, Lu Z, Truong K et al. Ganglionated plexi modulate extrinsic cardiac autonomic nerve input: effects on si nus rate, atrioventricular conduction, refractoriness, and inducibility of atrial fbrillation. J Am Coll Cardiol. 2007;50:61-68.
16. Pappone C, Santinelli V, Manguso F, Vicedomini G, Gugliotta F, Augello G et al. Pulmonary vein denervation enhances long-term beneft after circumferential ablation for paroxysmal atrial fbrillation. Circulation. 2004;109:327-334.
17. Pokushalov E, Romanov A, Shugayev P, Artyomenko S, Shirokova N, Turov Alex et al. Selective ganglionated plexi ablation for paroxysmal atrial fbrillation. Heart Rhythm. 2009;6:1257-1264.
18. Calò L, Rebecchi M, Sciarra L, De Luca L, Fagagnini A, Zuccaro LM et al. Catheter ablation of right atrial ganglionated plexi in patients with vagal paroxysmal atrial fbrillation. Circ Arrhythm Electrophysiol. 2012;5:22-31.
19. Pachon JC, Pachon EI, Pachon JC, Lobo TJ, Pachon MZ, Vargas RN et al. “Cardioneuroablation” — new treatment for neurocardiogenic syncope, functional AV block and sinus dysfunction using catheter RF-ablation. Europace. 2005;7:1-13.
20. Fatkin D, Santiago CF, Huttner IG, Lubitz SA, Ellinor PT. Genetics of atrial fibrillation: state of the art in 2017. Heart Lung Circ. 2017;26:894-901.
21. Aistrup GL, Cokic I, Ng J, Gordon D, Koduri H, Browne S et al. Targeted non-viral gene-based inhibition of gαi/o-mediated vagal signaling in the posterior left atrium decreases vagal induced atrial fibrillation. Heart Rhythm. 2011;8:1722-1729.
Оригінал статті надрукований у
European Heart Journal Supplements.
2023;25 (Suppl. C):C1-C6

/31.jpg)
/32.jpg)
/34.jpg)