Международный неврологический журнал Том 20, №2, 2024
Вернуться к номеру
Характеристики продуктів розпаду фібрину/фібриногену при розсіяному склерозі після інфікування SARS-CoV-2
Авторы: T.I. Halenova (1), N.G. Raksha (1), T.B. Vovk (1), V.L. Karbovskyy (2), S.M. Sholomon (3), V.S. Melnyk (3), O.M. Savchuk (1)
(1) - Educational and Scientific Center “Institute of Biology and Medicine”, Taras Shevchenko National University of Kyiv, Kyiv, Ukraine
(2) - LLC “Biopharma Plasma”, Kyiv, Ukraine
(3) - Bogomolets National Medical University, Kyiv, Ukraine
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
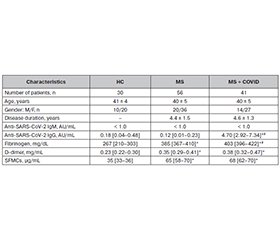
Актуальність. Метою цього дослідження була оцінка рівня фібриногену та продуктів його розпаду в плазмі крові пацієнтів із розсіяним склерозом (РС), які мали чи не мали COVID-19 в анамнезі. Матеріали та методи. Обстежено 97 хворих на РС. Залежно від наявності COVID-19 їх розділили на дві групи. До групи РС увійшли 56 осіб, які раніше не хворіли на COVID-19. У групу «РС + COVID» включили 41 пацієнта із лабораторно підтвердженим діагнозом COVID-19. Контрольну групу становили 30 здорових добровольців. Спектрофотометричні методи використовували для вимірювання концентрації фібриногену, D-димеру та розчинних фібрин-мономерних комплексів (РФМК). Для аналізу складу фракцій РФМК застосовували ексклюзійну хроматографію. Результати. Виявлено, що рівні фібриногену, D-димеру та РФМК були значно підвищені в плазмі всіх пацієнтів із РС порівняно зі здоровими особами. Уміст D-димеру та РФМК не відрізнявся між двома групами РС, тоді як концентрація фібриногену в плазмі була значно підвищеною в групі «РС + COVID» порівняно з групою РС. Крім того, розвиток РС супроводжувався змінами як кількості, так і якості складу РФМК порівняно зі здоровими особами. Наші результати продемонстрували накопичення високомолекулярних РФМК у плазмі пацієнтів із РС. Висновки. Результати показали, що у хворих на РС змінилися характеристики гемостазу, однак необхідні додаткові дослідження, щоб визначити зв’язок між конкретними гемостатичними факторами, а саме фібриногеном, D-димером і РФМК, і патофізіологією РС.
Background. The purpose of this study was to investigate plasma levels of fibrinogen and products of its degradation in patients with multiple sclerosis (MS) with and without a history of coronavirus disease 2019 (COVID-19). Materials and methods. We examined 97 patients with MS. Based on the presence of COVID-19, all cases were divided into two groups. MS group included 56 patients who did not suffer from COVID-19 previously. MS + COVID group consisted of 41 cases who had a laboratory-verified diagnosis of COVID-19. The group of healthy controls included 30 healthy volunteers. Spectrophotometric techniques were used to measure the concentrations of fibrinogen, D-dimer, and soluble fibrin monomer complexes (SFMCs). Size-exclusion chromatography was applied to analyze the composition of SFMC fractions. Results. We found that concentrations of fibrinogen, D-dimer, and SFMCs were remarkably increased in plasma of all MS patients compared with healthy controls. The levels of D-dimer, and SFMCs did not differ between two MS groups, while plasma fibrinogen concentration was significantly increased in MS + COVID patients compared to MS group. Moreover, the development of MS was accompanied by the changes in both quantity and quality of SFMC composition compared to that of healthy controls. Our results demonstrated accumulation of high-molecular-weight SFMCs in plasma of MS patients. Conclusions. The findings indicated that MS patients had changed hemostasis characteristics; however, more research is required to determine the connection between particular hemostatic factors, namely fibrinogen, D-dimer, and SFMCs, and the pathophysiology of MS.
розсіяний склероз; інфекція SARS-CoV-2; фібриноген; D-димер; розчинні фібрин-мономерні комплекси
multiple sclerosis; SARS-CoV-2 infection; fibrinogen; D-dimer; soluble fibrin monomer complexes