Архив офтальмологии Украины Том 12, №1, 2024
Вернуться к номеру
Зміни рівня ретинолу та токоферолу у ротовій рідині дітей з міопією
Авторы: Цибульська Т.Є., Тіткова О.Ю.
Запорізький державний медико-фармацевтичний університет, м. Запоріжжя, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
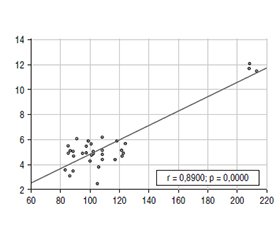
Мета роботи — оцінити рівень ретинолу та токоферолу у ротовій рідині у дітей з прогресуючою міопією. Матеріали та методи. Обстежено 34 дитини (68 очей) з міопією слабкого ступеня, які становили І групу (основну), у якій було виділено підгрупу Іa — 16 дітей (32 ока) — з прогресуючим перебігом міопії та підгрупу Іb — 18 дітей (36 очей) — зі стабільним перебігом міопії. Контрольну групу становили 18 умовно здорових дітей (36 очей). Стандартне офтальмологічне обстеження включало: візометрію, авторефрактокератометрію до та після циклоплегії, біомікроскопію, офтальмоскопію. Імуноферментним методом визначено рівні ретинолу та токоферолу у ротовій рідині. Результати. У дітей з прогресуючим перебігом міопії показник ретинолу в середньому в 1,2 раза нижче, ніж у дітей зі стабільним перебігом міопії (р < 0,05); а також в середньому у 2,3 раза нижче, ніж у дітей контрольної групи (р < 0,05). При цьому у дітей з прогресуючим перебігом рівень токоферолу був у 1,3 раза нижче у пацієнтів зі стабільним перебігом міопії (р < 0,05). У підгрупі з прогресуючим перебігом цей показник був у 3 рази нижче, ніж у групі дітей без офтальмологічної патології (р < 0,05). Кореляційний аналіз показав помірний вірогідний зворотний зв’язок між рівнем ретинолу та прогресуванням міопічного процесу (r = –0,43, р < 0,05). Помірний вірогідний зворотний зв’язок виявлено між рівнем токоферолу та прогресуванням міопії (r = –0,47, р < 0,05). Кореляційним аналізом визначено вірогідний прямий зв’язок між рівнем ретинолу та токоферолу (r = 0,89, р < 0,05). Оптимальне значення порога відсікання, що забезпечує максимальні значення чутливості і специфічності, для показника ретинолу у ротовій рідині у дітей з прогресуючою міопією становить ≤ 99,602 нг/мл (р < 0,05). Висновки. У дітей з прогресуючим перебігом міопії рівень ретинолу у ротовій рідині в середньому у 2,3 раза, а рівень токоферолу — у 3 рази нижче відносно дітей без офтальмопатології (р < 0,05). Встановлено зворотний кореляційний зв’язок між рівнями ретинолу та токоферолу і прогресуючим перебігом міопії. Встановлено, що визначення рівня ретинолу та токоферолу у ротовій рідині дозволяє діагностувати прогресуючий перебіг міопії при рівнях ретинолу ≤ 99,602 нг/мл, токоферолу ≤ 5,129 нг/мл (р < 0,001).
Background. The aim: to assess the level of retinol, and tocopherol in the oral fluid of children with progressive myopia. Materials and methods. We examined 34 children (68 eyes) with mild myopia included in group I. It was divided into two subgroups: Ia — 16 children (32 eyes) with a progressive course of myopia, and Ib — 18 children (36 eyes) with a stable course of myopia. The control group consisted of 18 conditionally healthy children (36 eyes). A standard eye examination was carried out: visometry, autorefractokeratometry before and after cycloplegia, biomicroscopy, ophthalmoscopy. The level of retinol, and tocopherol in the oral fluid was determined by the enzyme immunoassay. Results. In children with a progressive course of myopia, the retinol indicator is on average 1.2 times lower than in those with a stable course of myopia (p < 0.05), and also on average 2.3 times lower than in controls (р < 0.05). At the same time, in children with a progressive course, the level of tocopherol was 1.3 times lower than in patients with a stable myopia (p < 0.05). In the subgroup with a progressive course, this indicator was 3 times lower than in children without ophthalmic pathology (p < 0.05). Correlation analysis showed a moderate reliable inverse relationship between the level of retinol and the progression of myopia (r= –0.43; p < 0.05). A moderate reliable inverse relationship was found between the level of tocopherol and the progression of myopia (r = –0.47; p < 0.05). Correlation analysis demonstrated a reliable direct relationship between the level of retinol and tocopherol (r = 0.89; p < 0.05). The optimal value of the cut-off threshold, which provides the maximum sensitivity and specificity, is ≤ 99.602 ng/ml (р < 0.05) for the indicator of retinol in the oral fluid of children with progressive myopia. Conclusions. In pediatric patients with a progressive course of myopia, the level of retinol in the oral fluid is on average 2.3 times lower and the level of tocopherol is 3 times lower than that of children without ophthalmic pathology (p < 0.05). An inverse correlation was found between the levels of retinol and tocopherol and the progressive course of myopia. It was revealed that determining the level of retinol and tocopherol in the oral fluid allows diagnosing the progressive course of myopia, with retinol levels ≤ 99.602 ng/ml, tocopherol ≤ 5.129 ng/ml (p < 0.001).
міопія; ретинол; токоферол; діти; ротова рідина
myopia; retinol; tocopherol; children; children; oral fluid
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Bezdіtko PA, Parhomec' RO. Analysis of the influence of corneal indicators on the dynamics of myopia progression when using orthokeratological lenses in children. Ukrainian journal “Ophthalmology”. 2021;2(13):39-46. (In Ukrainian).
- Naduvilath T, He X, Xu X, Sankaridurg P. Normative data for axial elongation in Asian children. Ophthalmic and Physiological Optics. 2023;43(5):1160-1168. https://doi.org/10.1111/opo.13159.
- Chua SY, Sabanayagam C, Cheung YB, et al. Age of onset of myopia predicts risk of high myopia in later childhood in myopic Singapore children. Ophthalmic & Physiological Optics. 2020;40(1):57-68.
- Zhang R, Dong L, Yang Q et al. Screening for novel risk factors related to high myopia using machine learning. BMC Ophthalmol. 2022;405. doi: https://doi.org/10.1186/s12886-022-02627-0.
- Harb EN, Wildsoet CF. Nutritional Factors and Myopia: An Ana–lysis of National Health and Nutrition Examination Survey Data. Optom Vis Sci. 2021;98(5):458-468. doi: 10.1097/OPX.0000000000001694
- Landis EG, Park HN, Chrenek M, at al. Ambient light regulates retinal dopamine signaling and myopia susceptibility. Invest Ophthalmol. Vis. Sci. 2021;62(1):28. doi: 10.1167/iovs.62.1.28.
- Kaur K, Gurnani B, Kannusamy V. Myopia: Current concepts and review of literature. TNOA Journal of Ophthalmic Science and Research. 2020;58(4):280-287. doi: 10.4103/tjosr.tjosr_85_20.
- Tianli Zheng, Yaohui Qu, Weiwei Fu et al. Association between Vitamin E and myopia in a cross-sectional study of the United States population. 18 August 2023, Preprint (Version 1) available at Research Square [https://doi.org/10.21203/rs.3.rs-3259867/v1]).
- Murphy M, Srivastava R, Deans K, et al. Clinical Biochemistry: An Illustrated Colour Text. 7th Edition. Kyiv: Medicine; 2023. 208 p.
- Vozna I, Samoilenko A, Pavlov S, et al. Study of biochemical markers’ content of bone tissue metabolism in the oral liquid of patients with generalized periodontitis. Ukrainian Dental Almanac. 2020;4:10-15. doi: 10.31718/2409-0255.4.2020.02).
- Ng FJ, Mackey DA, O’sullivan TA, et al. Is dietary vitamin A associated with myopia from adolescence to young adulthood. Transl Vis Sci Technol. 2020;9(6):29. doi: 10.1167/TVST.9.6.29.
- Juchnowicz D, Dzikowski M, Rog J, et al. Oxidative Stress Biomar–kers as a Predictor of Stage Illness and Clinical Course of Schizophrenia. Front Psychiatry. 2021;12:728986. doi: https://doi.org/10.3389/fpsyt.2021.728986.
- Maciejczyk M, Zalewska A, Ładny JR. Salivary Antioxidant Barrier, Redox Status, and Oxidative Damage to Proteins and Lipids in Healthy Children, Adults, and the Elderly. Oxid Med Cell Longev. 2019;4393460. doi: https://doi.org/10.1155/2019/4393460.
- Ng FJ, Mackey DA, O’Sullivan TA, Oddy WH, Yazar S. Is Dietary Vitamin A Associated with Myopia from Adolescence to Young Adulthood? Translational Vision Science & Technology. 2020;9(6):29. doi: 10.1167/tvst.9.6.29.
- Dragomirova M, Antonova A, Stoykova S, Mihova G, Grigo–rova D. Myopia in Bulgarian school children: prevalence, risk factors, and health care coverage. BMC Ophthalmol. 2022;22(1):1-9. doi: https://doi.org/10.1186/s12886-022-02471-2.
- Wen L, Cao Y, Cheng Q, et al. Objectively measured near work, outdoor exposure and myopia in children. British Journal of Ophthalmology. 2020;0:1-6. doi: bjophthalmol-2019.10.1136/bjophthalmol-2019-315258.
- Yin C, Gan Q, Xu P, et al. Dietary patterns and associations with myopia in Chinese children. Nutrients. 2023;15(8):1946. doi: https://doi.org/10.3390/nu15081946.
- Ren Z, Xu P, Zhang Q, Xu J, Yang Z, Si X, et al. Relationship between sugary food intake and myopia in 11–14 years old Chinese children in 2019–2021. J Hyg Res. 2022;51(5):713-9. doi: https://doi.org/10.19813/j.cnki.weishengyanjiu.2022.05.007.
- Li M, Tan CS, Foo LL, et al. Dietary intake and associations with myopia in Singapore children. Ophthalmic Physiol Opt. 2022;42(2):319-26. doi: https://doi.org/10.1111/opo.12929.
- Kim JM, Choi YJ. Nutritional intake, environmental factors, and their impact on myopia prevalence in Korean children aged 5–12 years. Journal of Health, Population and Nutrition. 2024;43(1):14. doi: https://doi.org/10.1186/s41043-024-00506-6.