Актуальність
За офіційними даними центру Джона Гопкінса, станом на 1 жовтня 2023 року в Україні зареєстровано понад 5 млн 700 тис. випадків COVID-19 [1], дітей до 18 років приблизно 3,1–5,9 % від загальної кількості інфікованих. У середньому 2,5 % дітей, в яких було виявлено SARS-CoV-2, потребували госпіталізації, а 0,8 % — лікування в умовах відділення інтенсивної терапії [2]. Частота госпіталізацій у стаціонари була найвищою серед дітей віком 0–4 роки і сягала 4,6 %. Основними ускладненнями SARS-CoV-2, які спричиняють несприятливий перебіг недуги у дітей, є гострий респіраторний дистрес-синдром, поліорганна недостатність і мультисистемний запальний синдром. Проблема, якій присвячена ця стаття, залишається актуальною, оскільки випадки COVID-19 продовжують реєструвати в Україні, захворюваність протягом зими 2023/24 рр. зростає; за даними Центру громадського здоров’я МОЗ України, з 2 жовтня по 28 січня зареєстровано 133 724 випадки захворювання на COVID-19 [3].
Мета: поліпшення менеджменту новонароджених дітей на підставі досліджень різної за тяжкістю інфекції, спричиненої SARS-CoV-2.
Матеріали та методи
Під спостереженням перебували 11 новонароджених дітей (7 хлопчиків і 4 дівчинки), які лікувалися у педіатричному відділенні Львівської обласної дитячої клінічної лікарні «ОХМАТДИТ» з діагнозом SARS-CоV-2. Встановлено, що усі діти заразилися від матерів, хворих на SARS-CоV-2, які не були вакциновані проти COVID-19. Інфікування немовлят відбулося у ранньому постнатальному періоді, діагноз було підтверджено виявленням РНК вірусу SARS-CoV-2 у матеріалі мазків із носоглотки методом полімеразної ланцюгової реакції (ПЛР), що проводилося у Львівському обласному центрі контролю та профілактики хвороб МОЗ України. За його даними, у період, протягом якого проводилося дослідження, циркулював альфа-варіант SARS-CоV-2 (B.1.1.7).
Результати
Усі діти народилися доношеними, гестаційний вік у середньому становив 39,83 ± 2,12 тижня, з масою тіла при народженні 3223,56 ± 244,3 г. Усі новонароджені були вакциновані БЦЖ.
Діти інфікувалися від матерів, хворих на SARS-CоV-2. У 40 % випадків захворювання у матері було діагностовано до і під час пологів, а у 60 % — у післяпологовому періоді. Це зумовило відсутність специфічних IgG у крові новонароджених дітей. Середній вік пацієнтів на момент госпіталізації становив 19,33 ± 7,56 дня (8–28 днів). Основними симптомами хвороби були гіпертермія (підвищення температури тіла більш ніж 38,0 °С), яка з урахуванням догоспітального етапу лікування і перебування у стаціонарі тривала від 2 до 10 днів (у середньому 3,70 ± 1,48 дня), а також знижений апетит, млявість, утруднене дихання носом, покашлювання та діарея (табл. 1). Водночас загальний стан дітей під час огляду лікарем приймального відділення у більшості випадків був оцінений як середньої тяжкості. Позитивна динаміка в процесі лікування наставала досить швидко, і тривалість перебування у стаціонарі у середньому становила 4,01 ± 1,22 дня (від 3 до 8).
/24.jpg)
Незважаючи на те, що розподіл симптомів за частотою у новонароджених з COVID-19 подібний до такого у пацієнтів старшого віку, у них частіше виявляють шлунково-кишкові розлади, переважно не пов’язані з респіраторними симптомами. Усі новонароджені не мали ознак дихальних розладів, не потребували штучної вентиляції легень (ШВЛ) й оксигенотерапії, а показник сатурації під час дихання кімнатним повітрям не був нижчим від 96 %. Водночас у 5 дітей (50 %) під час інструментального обстеження (рентгенографія й ультразвукове обстеження легень) виявлено інтерстиційно-набрякові зміни й альвеолярну консолідацію у різних зонах легень. Привертала увагу диспропорція між незначною експресією респіраторних симптомів у дітей, які перебували під спостереженням, та змінами, встановленими під час ультразвукового обстеження легень.
У 40 % хворих новонароджених у загальному аналізі крові за зниженим рівнем гемоглобіну й еритроцитів виявлено анемію. Хоча загальна кількість лейкоцитів протягом першої доби від часу госпіталізації у середньому становила 7,50 ± 1,09 × 109/л, лейкопенію виявлено у трьох хворих (30 %), а найнижча загальна кількість лейкоцитів була 2,74 × 109/л. Загальна кількість тромбоцитів становила 301,52 ± 31,17 × 1012/л, у двох хворих кількість тромбоцитів була зниженою, в однієї дитини були лабораторні ознаки панцитопенії. Відносний вміст нейтрофілів і лімфоцитів у більшості дітей відповідав віковим нормам. Так, кількість нейтрофілів у середньому становила 32,45 ± 3,58 %, лімфоцитів — 57,23 ± 4,49 %. Рівні АЛТ, АСТ майже в усіх дітей не перевищували вікові норми, вміст АЛТ у середньому становив 27,46 ± 4,69 Од/л, ACT — 33,95 ± 6,06 Од/л (табл. 2).
Концентрація D-димеру у 50 % дітей на момент госпіталізації перевищувала нормальні показники для новонароджених (< 1,7 мг/л) [6]. У середньому цей показник становив 2,19 ± 0,09 мг/л, однак високі рівні D-димеру не поєднувалися з клінічними симптомами коагулопатії.
Лише в однієї новонародженої дитини (дівчинки N.) перебіг захворювання був тяжким і нетиповим для дітей раннього віку. Це наведено у клінічному випадку.
Дівчинка N. народилася від першої доношеної вагітності, перших фізіологічних пологів з масою тіла при народженні 3750 г, її стан оцінений за шкалою Апгар у 8/8 балів.
Прикладена до грудей через 10 хв після народження, контакт «шкіра до шкіри» в пологовому залі тривав приблизно 2 години. Невідомо, чи під час контакту з дитиною мама одягала маску. З анамнезу з’ясовано, у матері під час вагітності було діагностовано хронічний пієлонефрит у стадії неповної ремісії, гідронефроз правої нирки 1-го ст., а за 7 днів до пологів розвинулися клінічні симптоми COVID-19, який було підтверджено позитивними результатами ПЛР до SARS-CoV-2.
/25.jpg)
На другу добу життя стан дитини погіршився, температура тіла підвищилась до 37,5 °С, з’явилась тахікардія, задишка на фоні неспокою, періоральний ціаноз, знизилась сатурація (SpO2 під час дихання кімнатним повітрям коливалась у межах 94–96 %). Результат дослідження назофарингеальних мазків дитини на перший день життя на SARS-CoV-2 методом ПЛР виявився позитивним (виявлено РНК SARS-CoV-2 у матеріалі з дихальних шляхів також на 3, 11 та 14-й день життя; тест був негативний лише на 25-й день від народження). Дитину у триденному віці для подальшого лікування переведено у відділення анестезіології та інтенсивної терапії новонароджених ЛОДКЛ –«ОХМАТДИТ». Її стан було оцінено як тяжкий, вона отримувала кисень через маску, у подальшому, через наростання ознак респіраторного дистресу і серцево-судинної недостатності, потребувала ШВЛ й інотропної підтримки гемодинаміки добутаміном.
У загальних аналізах крові (табл. 3) із шостого дня життя дитини спостерігався лейкоцитоз, зсув лейкоцитарної формули вліво, протягом перших двох тижнів — тромбоцитопенія та зниження гематокриту. У динаміці спостерігалося підвищення кількості тромбоцитів, зниження загальної кількості лейкоцитів, однак у лейкоцитарній формулі утримувалась вища від вікової норми відносна кількість гранулоцитів.
За результатами біохімічних досліджень крові (табл. 4) виявляли значно підвищений рівень медіаторів запалення — С-реактивного протеїну та прокальцитоніну, а також гіпонатріємію та підвищений вміст сечовини за наявності нормальних рівнів активності ферментів печінки та незміненого вмісту білірубіну у сироватці крові. Системний рівень прозапального цитокіну IL-6 визначали лише один раз. Відповідний показник становив 14,6 пг/мл, що більш ніж у 3 рази перевищувало референтні показники для новонароджених. Привертала також увагу відсутність підвищених рівнів специфічних IgM й IgG у крові до SARS-CoV-2 на 6-й день хвороби.
При бактеріологічних дослідженнях, на 8-й день лікування в стаціонарі та декілька разів у динаміці, з крові, інтубаційної трубки, слизової зіву виділяли Kl. рneumoniae, водночас при госпіталізації у посіві крові на стерильність мікроорганізми виявлені не були. Підозра на генералізовану бактерійну інфекцію була показанням для проведення люмбальної пункції на 10-й день стаціонарного лікування. Ліквор прозорий, витікав нечастими краплями, цитоз 8,0 × 106/л (лімфоцити), рівні білка, глюкози були в нормі, глобулінові реакції негативні, при посіві росту бактерій не було.
Дослідження показників згортання крові у хворої N. виявило зміну лише деяких показників, які на сьогодні вважають маркерами розвитку COVID-19-асоційованої коагулопатії. Це високий рівень D-димеру (1,99–3,12 мг/л) і тромбоцитопенія (16–120 × 109/л), що утримувалися протягом перших двох тижнів життя дитини, а також підвищений рівень фібриногену на 8-му добу життя (3,6 г/л). Протромбіновий час й активований тромбопластиновий час відповідали віковій нормі. Протягом перших 8 днів життя також виявляли підвищений протромбіновий індекс (табл. 5).
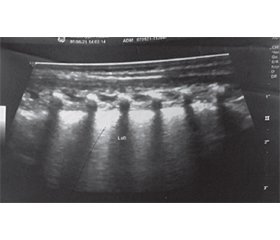
Під час ультразвукового обстеження у лівій легені було видно потовщення А-лінії плеври та значна кількість В-ліній, що є ознаками інтерстиційного набряку; справа, у зоні R-5 — ділянки (до 1,2 см) субплевральної консолідації (рис. 1, 2).
На рентгенограмах грудної клітки була явною знижена пневматизація верхніх і нижніх відділів обох легень. За даними ЕхоКГ діагностовано відкриту артеріальну протоку і відкрите овальне вікно.
Погіршення стану дитини, зростання тяжкості дихальних розладів, явні ознаки ураження паренхіми легень за даними УЗД і рентгенографії органів грудної клітки трактували як дуже тяжкий перебіг хвороби. Відповідно на 5-ту добу життя дитині було призначено ремдесивір у дозі 5 мг/кг, починаючи з наступного дня, протягом 5 днів лікування продовжили у дозі 2,5 мг/кг.
За час лікування у стаціонарі дитина отримувала декілька курсів антибіотиків. Протягом перших дев’яти днів — флоразид (100 мг/кг/добу) з аміцилом (15 мг/кг/добу), надалі меронем (60 мг/кг/добу) з ванкоміцином (20 мг/кг/добу), останнім 7-денним курсом було призначено цефепім (50 мг/кг/добу). Призначався гепарин (під контролем показника міжнародного нормалізованого відношення), етамзилат, дексаметазон (протягом 5 днів у дозі 1 мг/кг/добу), тричі переливали еритромасу.
Дівчинка перебувала на стаціонарному лікуванні протягом 34 днів, на ШВЛ і високочастотній осциляторній ШВЛ — 14 днів.
Клінічний діагноз: пневмонія, зумовлена SARS-CoV-2, гострий респіраторний дистрес-синдром, ДН ІІІ ст., ССН ІІ ст., пізній неонатальний сепсис, постінфекційна енцефалопатія.
З 23-го дня лікування у стаціонарі стан дитини поступово поліпшувався, зменшувалися дихальні розлади, відмічалася позитивна динаміка за результатами лабораторних й інструментальних досліджень, артеріальна протока до моменту виписки перестала функціонувати. У віці 35 днів у задовільному стані виписана зі стаціонару.
Обговорення
Реальні показники захворюваності на COVID-19 у дітей раннього віку можуть бути занижені через значну частоту у них легкого та безсимптомного перебігу хвороби; дані про безсимптомний перебіг інфекції у дітей і немовлят вперше були наведені ще на ранніх стадіях пандемії, це переважно з’ясовували при обстеженні сімейних осередків захворювання [7]. За даними багатоцентрового дослідження SARSTerPED, проведеного у Польщі, у якому було понад 300 немовлят, безсимптомний перебіг COVID-19 встановлено в 11 % інфікованих дітей [8].
Захист новонародженого від коронавірусної інфекції залежить від природженого імунітету та наявності материнських антитіл, отриманих дитиною трансплацентарно. У проспективному дослідженні, проведеному в університеті США, виявлено сильний позитивний кореляційний зв’язок між титрами антитіл у крові матерів, які перенесли SARS-CоV-2 під час вагітності, і рівнями антитіл у пуповинній крові новонароджених. Водночас у всіх дітей у динаміці спостерігалося зниження титру антитіл, тоді як кількість антитіл у їхніх матерів залишалася стабільною або навіть зростала [9].
Поствакцинальна імунна відповідь вагітних мало вивчена. За даними групи ізраїльських авторів, вакцинація у третьому триместрі вагітності спричиняє швидке наростання IgG до S-білка. Антитіла проникають через плацентарний бар’єр, і їх кількість у плода досягає материнських титрів протягом 15 днів після вакцинації першою дозою вакцини. Водночас співвідношення між кількістю материнських антитіл до SARS-CоV-2 та кількістю антитіл в новонароджених відповідає показнику після перенесеної інфекції [10].
Іншими можливими чинниками, що зумовлюють легший і здебільшого малосимптомний перебіг SARS-CоV-2 у дітей першого місяця життя, є:
— вікові особливості рецепторів до ангіотензинперетворювального ферменту (АСЕ2-рецепторів), які вірус використовує для проникнення у клітини. У дітей раннього віку кількість АСЕ2-рецепторів є меншою, і вони мають меншу зв’язувальну активність. Рецептори АСЕ2 експресуються клітинами тканин легень, кишечника, нирок, слизової оболонки носа і ротової порожнини; встановлено, що експресія АСЕ2-рецепторів у новонароджених в клітинах епітелію тонкої кишки переважає експресію в альвеолоцитах легень [11]. Ангіо–тензинперетворювальні ферменти підтримують тонус кровоносних судин, а у разі розвитку COVID-19 беруть участь у локальній запальній реакції;
— вигодовування дитини грудним молоком матерями, які перенесли COVID-19, оскільки їх молоко містить антитіла IgA до антиспайкового білка SARS-CoV-2 і специфічний IgG;
— позитивний вплив вакцинації живими вакцинами, а саме вакцинації проти туберкульозу (БЦЖ-вакциною). Перехресний захисний ефект вакцини БЦЖ (щодо захворювань, не пов’язаних з туберкульозом) можна пояснити теорією «навченого імунітету» — нещодавно виявленою програмою імунної пам’яті, яка характеризується непостійною епігенетичною трансформацією макрофагів, що призводить до збільшення продукції запальних цитокінів і, відповідно, до підсилених імунних реакцій [12].
У більшості дітей першого місяця життя, які перебували під нашим спостереженням, перебіг коронавірусної хвороби, спричиненої SARS-CoV-2, визначено як нетяжкий. Основними симптомами були гіпертермія, млявість й утруднене дихання носом. Під час ультразвукового дослідження виявлено зміни легеневої тканини, які не супроводжувались симптомами ураження нижніх дихальних шляхів. Також було виявлено анемію та підвищений вміст D-димеру (за відсутності інших ознак коагулопатії). Середня тривалість захворювання до моменту госпіталізації у 10 новонароджених становила 3,70 ± 1,48 дня, а тривалість лікування у стаціонарі — 4,01 ± 1,22 дня.
Водночас можливим є дуже тяжкий, нетиповий для новонароджених дітей перебіг інфекції, спричиненої SARS-CoV-2, з розвитком вірусно-бактерійного ураження паренхіми легень, коагулопатії, що ілюструє наведений нами клінічний випадок.
Вважаємо, що передумовами тяжкого перебігу хвороби у дитини N. було інфікування вірусом у перинатальному періоді, екстрагенітальна інфекційна патологія у жінки під час вагітності, а також відкрита артеріальна протока (яка функціонувала протягом перших 30 днів життя дитини).
Організм жінки, інфікованої SARS-CoV-2 у пізні терміни вагітності, не продукував достатнього рівня антитіл, які могли б захистити плід і дитину від зараження або сприяти малосимптомному перебігу хвороби. Оскільки РНК SARS-CoV-2 методом ПЛР виявляли у матеріалі з дихальних шляхів на перший день життя дитини, ми не можемо виключити вертикальний шлях передачі вірусу.
У лікуванні немовлят використовували нестероїдні протизапальні препарати, інфузійну терапію для підтримання належного балансу рідини, антибіотики призначали у 50 % випадків. Таке лікування відповідало як вітчизняним настановам, так і сучасним європейським рекомендаціям, зокрема Польського педіатричного товариства [14], у яких передбачено лікування дітей із легким та середньотяжким перебігом COVID-19 лише призначенням адекватної гідратації та антипіретиків.
Тяжкий перебіг COVID-19 у дитини N., окрім заходів із стабілізації стану і лікування респраторного дистресу, був показанням до призначення ремдесивіру. Ремдесивір (GS-5734) — противірусний засіб класу нуклеотидних аналогів, широкого спектра дії, аналог аденозину, його використовує РНК-полімераза вірусу замість АТФ, це призводить до блокування її активності та порушення синтезу ланцюга РНК і, як наслідок, до гальмування вірусної реплікації. У дослідженнях in vitro та in vivo доказано противірусну дію GS-5734 на коронавіруси, достатню ефективність і низькі токсичні побічні ефекти [15]. У 2021 р. FDA США видало ліцензію на ремдесивір для лікування SARS-CoV-2. Ремдесивір дозволено використовувати в Україні (Протокол надання медичної допомоги для лікування коронавірусної хвороби (COVID-19)) для лікування дітей (зокрема, і новонароджених з масою тіла > 3,5 кг) з підозрюваним або лабораторно підтвердженим COVID-19, госпіталізованих із тяжким перебігом захворювання.
У дітей із SARS-CоV-2 може виникати COVID-19-асоційована коагулопатія (дискоагулопатія) — системна гіперкоагуляція з розвитком мікроангіопатії через зростання протромботичного потенціалу гемостатичної системи [13]. Уважається, що в основі її розвитку є сильна запальна реакція (цитокіновий шторм), ураження ендотелію, а можливо, і пригнічення системи фібринолізу. Важливою відмінністю від ДВЗ-синдрому і особливістю коагулопатії, асоційованої з SARS‑CoV‑2, є те, що фактично відсутні клінічні симптоми геморагічного синдрому. Таких симптомів не було виявлено під час клінічного обстеження хворих, які перебували під спостереженням. У випадках системного тромбозу, спричиненого COVID‑19, найчастіше уражуються легені, нирки та судини мозку. Інструментальна візуалізація тромбозів не завжди можлива. Тому моніторинг рівня D-димеру у новонароджених як основного фактора COVID-19-індукованої коагулопатії є найбільше виправданим.
Висновки
У більшості новонароджених дітей, які перебували під спостереженням, перебіг коронавірусної хвороби, спричиненої SARS-CoV-2, визначався такими симптомами, як млявість, гіпертермія, утруднене дихання носом, діарея, і змінами, виявленими лише при лабораторних й інструментальних дослідженнях: анемією, порушенням у системі згортання крові, підвищеною щільністю паренхіми легень. Водночас перебіг недуги у немовлят цього віку може бути і дуже тяжким, з ураженням паренхіми легень, пневмонією, COVID-19-асоційованою коагулопатією, ускладнюватися генералізованою бактерійною інфекцією, що наведено у клінічному випадку. Нами встановлено, що усі діти інфікувалися SARS-CoV-2 від матерів, тому вважаємо, що найкращим способом запобігання в подальшому таким випадкам є вакцинація безпечними для вагітних м-РНК вакцинами — Comirnaty (Pfizer) і Moderna. Жінкам, яким проведено первинний курс вакцинації і введено бустерну дозу, МОЗ України рекомендує введення додаткової бустерної дози, якщо від попередньо введеної минуло 6 місяців і більше. Не вакцинованим перед початком вагітності майбутнім матерям слід ввести під час вагітності дві дози вакцини з інтервалом щонайменше 28 днів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Інформація про фінансування. Робота виконана в рамках планової НДР кафедри дитячих інфекційних хвороб ЛНМУ «Особливості клінічного перебігу інфекційних хвороб у дітей, сучасні методи їх діагностики і лікування у різні періоди епідемічного процесу SARS-CoV-2».
Внесок авторів. Надрага О.Б. — концепція і дизайн дослідження, аналіз отриманих даних; Литвин Г.О. — збирання й обробка матеріалів; Добрянський Д.О., Покровська Т.В. — аналіз отриманих даних, написання тексту статті; Хирівський А.Л. — написання тексту статті, аналіз результатів УЗД легень.
Подяки. Автори висловлюють подяку завідувачці відділу інтенсивної терапії новонароджених Львівської обласної дитячої клінічної лікарні «ОХМАТДИТ» Зарембі Галині Петрівні.
Отримано/Received 07.02.2024
Рецензовано/Revised 17.02.2024
Прийнято до друку/Accepted 26.02.2024

/24.jpg)
/25.jpg)
/26.jpg)
/27.jpg)