Международный эндокринологический журнал Том 20, №1, 2024
Вернуться к номеру
Інсулінорезистентність і мозковий інсульт: механізми та терапевтичні підходи
Авторы: Пашковська Н.В., Пашковський В.М.
Буковинський державний медичний університет, м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
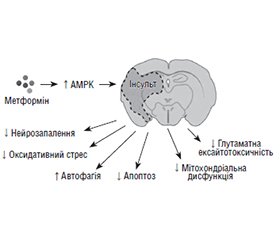
В огляді проведений аналіз даних літератури щодо епідеміології, чинників ризику і механізмів виникнення гострих порушень мозкового кровообігу (ГПМК) у хворих на цукровий діабет (ЦД). Розглянута роль інсулінорезистентності й ефективності терапевтичних підходів щодо її корекції при мозковому інсульті. ЦД визнаний незалежним модифікованим чинником ризику ГПМК. В осіб із ЦД різного віку ризик виникнення інсульту підвищений у 2–6 разів, причому показники є особливо високими в пацієнтів молодого працездатного віку. Наявність ЦД асоціюється з більш серйозними симптомами, підвищеним ризиком ускладнень, тривалою госпіталізацією та вищою смертністю. Результати досліджень показують, що інсулінорезистентність є одним з провідних тригерів, що спричиняє розвиток ішемічного інсульту через емболію, спровоковану оксидативним стресом, ендотеліальною дисфункцією та гіперактивацією тромбоцитів, а також унаслідок атеросклеротичних змін, зумовлених запаленням, проліферацією гладеньком’язових клітин судинної стінки, дисліпідемією та артеріальною гіпертензією на тлі гіперглікемії та гіперінсулінемії. Доведено, що інсулінорезистентність не тільки провокує ГПМК, але й негативно впливає на їх прогноз. Метформін є ключовим препаратом для підвищення чутливості до інсуліну і визнаний одним з найважливіших терапевтичних засобів першої лінії для досягнення й підтримки цілей лікування пацієнтів із ЦД 2-го типу. Результати експериментальних і клінічних досліджень довели, що препарат має цілий спектр нейропротекторних властивостей, які загалом запобігають розвитку церебральної ішемії та зменшують негативні наслідки в разі її виникнення. Тварини з експериментальною гострою церебральною ішемією, які отримували метформін, мали кращу загальну неврологічну оцінку, значно менший розмір інфаркту, кращі показники координації, більшу кількість нейронів і мікроглії. Нейропротекторний вплив метформіну при інсульті реалізується через сигнальний шлях AMPK (5'АМФ-активованої протеїнкінази) зі зменшенням окиснювального стресу, нейрозапалення, стимуляції ангіо- і нейрогенезу, автофагії та пригніченням апоптозу. За даними когортних і рандомізованих клінічних досліджень, використання метформіну пов’язане зі значно меншим ризиком розвитку ГПМК. Тривалий прийом препарату при ЦД 2-го типу сприяє більш легкому перебігу інсульту, асоціюється з кращим функціональним відновленням, зменшенням показників інвалідизації та смертності.
The review analyzed literature data on the epidemiology, risk factors, and mechanisms of acute cerebrovascular accident (ACVA) in patients with diabetes mellitus. The role of insulin resistance and the effectiveness of therapeutic approaches to its correction in cerebral stroke are considered. Diabetes mellitus is recognized as an independent modifiable risk factor for ACVA. In people with diabetes of different age, the risk of stroke is increased by 2–6 times, and the indicators are especially high in patients of young working age. The presence of diabetes mellitus is associated with more severe symptoms, increased risk of complications, longer hospitalization, and higher mortality. Research results show that insulin resistance is one of the main triggers for the development of ischemic stroke due to embolism caused by oxidative stress, endothelial dysfunction and platelet hyperactivation, as well as due to atherosclerotic changes caused by inflammation, proliferation of smooth muscle cells of the vascular wall, dyslipidemia and hypertension on the background of hyperglycemia and hyperinsulinemia. It has been proven that insulin resistance not only provokes ACVA, but also negatively affects their prognosis. Metformin is a key drug for improving insulin sensitivity and is recognized as one of the most important first-line therapeutic agents to achieve and maintain treatment goals in patients with type 2 diabetes. The results of experimental and clinical studies proved that this agent has a whole range of neuroprotective properties, which generally prevent the development of cerebral ischemia and reduce the negative consequences in case of its occurrence. Animals with experimental acute cerebral ischemia who have been treated with metformin had a better overall neurological score, significantly smaller infarct size, better coordination scores, and higher numbers of neurons and microglia. The neuroprotective effect of metformin in stroke is realized through the AMPK (5’AMP-activated protein kinase) signaling pathway with reduction of oxidative stress, neuroinflammation, stimulation of angiogenesis and neurogenesis, autophagy, and inhibition of apoptosis. According to data from cohort and randomized clinical trials, the use of metformin is associated with a significantly lower risk of developing ACVA. Long-term use of this drug in type 2 diabetes contributes to a milder course of stroke, is associated with better functional recovery, and a decrease in disability and mortality rates.
цукровий діабет; інсулінорезистентність; гострі порушення мозкового кровообігу; мозковий інсульт; метформін
diabetes mellitus; insulin resistance; acute cerebrovascular accidents; cerebral stroke; metformin
/66.jpg)
/68.jpg)
- Feigin V.L., Brainin M., Norrving B. et al. World Stroke Organization (WSO): Global Stroke Fact Sheet 2022. Int. J. Stroke. 2022 Jan. 17(1). 18-29. doi: 10.1177/17474930211065917. Erratum in: Int. J. Stroke. 2022 Apr. 17(4). 478.
- eClinicalMedicine. The rising global burden of stroke. EClinicalMedicine. 2023 May 23. 59. 102028. doi: 10.1016/j.eclinm.2023.102028.
- Fan J., Li X., Yu X. et al. Global Burden, Risk Factor Analysis, and Prediction Study of Ischemic Stroke, 1990-2030. Neurology. 2023 Jul 11. 101(2). e137-e150. doi: 10.1212/WNL.0000000000207387.
- Lau L.H., Lew J., Borschmann K., Thijs V., Ekinci E.I. Pre–valence of diabetes and its effects on stroke outcomes: A meta-analysis and literature review. J. Diabetes Investig. 2019 May. 10(3). 780-792. doi: 10.1111/jdi.12932.
- Tun N.N., Arunagirinathan G., Munshi S.K. et al. Diabetes mellitus and stroke: A clinical update. World Journal of Diabetes. 2017. 8(6). 235-248. doi: 10.4239/wjd.v8.i6.235
- Maida C.D., Daidone M., Pacinella G., Norrito R.L., Pinto A., Tuttolomondo A. Diabetes and Ischemic Stroke: An Old and New Relationship an Overview of the Close Interaction between These Diseases. Int. J. Mol. Sci. 2022 Feb 21. 23(4). 2397. doi: 10.3390/ijms23042397.
- You R.X., McNeil J.J., O’Malley H.M., Davis S.M., Thrift A.G., Donnan G.A. Risk Factors for Stroke Due to Cerebral Infarction in Young Adults. Stroke. 1997. 28. 1913-1918. doi: 10.1161/01.STR.28.10.1913.
- Jørgensen H., Nakayama H., Raaschou H.O. et al. Stroke in patients with diabetes. The Copenhagen Stroke Study. Stroke. 1994. 25. 1977-1984.
- Hankey G.J. Population Impact of Potentially Modifiable Risk Factors for Stroke. Stroke. 2020 Mar. 51(3). 719-728. doi: 10.1161/STROKEAHA.119.024154.
- Han Y., Xie H., Liu Y., Gao P., Yang X., Shen Z. Effect of metformin on all-cause and cardiovascular mortality in patients with coronary artery diseases: a systematic review and an updated meta-analysis. Cardiovasc. Diabetol. 2019 Jul 30. 18(1). 96. doi: 10.1186/s12933-019-0900-7.
- Desilles J.P., Meseguer E., Labreuche J. et al. Diabetes mellitus, admission glucose, and outcomes after stroke thrombolysis: a regi–stry and systematic review. Stroke. 2013 Jul. 44(7). 1915-23. doi: 10.1161/STROKEAHA.111.000813.
- Shang Y., Fratiglioni L., Marseglia A. et al. Association of diabetes with stroke and post-stroke dementia: A population-based cohort study. Alzheimers Dement. 2020 Jul. 16(7). 1003-1012. doi: 10.1002/alz.12101.
- Georgakis M.K., Harshfield E.L., Malik R. et al. Diabetes Mellitus, Glycemic Traits, and Cerebrovascular Disease: A Mendelian Randomization Study. Neurology. 2021 Mar 30. 96(13). e1732-e1742. doi: 10.1212/WNL.0000000000011555.
- Kernan W.N., Inzucchi S.E., Viscoli C.M., Brass L.M., Bra–vata D.M., Horwitz R.I. Insulin resistance and risk for stroke. Neuro–logy. 2002 Sep 24. 59(6). 809-15. doi: 10.1212/wnl.59.6.809.
- Ding P.F., Zhang H.S., Wang J. et al. Insulin resistance in ischemic stroke: Mechanisms and therapeutic approaches. Front. Endocrinol. (Lausanne). 2022 Dec 15. 13. 1092431. doi: 10.3389/fendo.2022.1092431.
- Chen R., Ovbiagele B., Feng W. Diabetes and Stroke: Epi–demiology, Pathophysiology, Pharmaceuticals and Outcomes. The American Journal of the Medical Sciences. 2016. 351(4). 380-386. doi:10.1016/j.amjms.2016.01.011.
- Giacco F., Brownlee M. Oxidative stress and diabetic complications. Circ. Res. 2010 Oct 29. 107(9). 1058-70. doi: 10.1161/CIRCRESAHA.110.223545.
- Takahashi S. Metabolic Contribution and Cerebral Blood Flow Regulation by Astrocytes in the Neurovascular Unit. Cells. 2022 Feb 25. 11(5). 813. doi: 10.3390/cells11050813.
- Pathak R., Sachan N., Chandra P. Mechanistic approach towards diabetic neuropathy screening techniques and future challenges: A review. Biomed. Pharmacother. 2022 Jun. 150. 113025. doi: 10.1016/j.biopha.2022.113025.
- Garg S.S., Gupta J. Polyol pathway and redox balance in diabetes. Pharmacol. Res. 2022 Aug. 182. 106326. doi: 10.1016/j.phrs.2022.106326.
- Khalid M., Petroianu G., Adem A. Advanced Glycation End Products and Diabetes Mellitus: Mechanisms and Perspectives. Biomolecules. 2022 Apr 4. 12(4). 542. doi: 10.3390/biom12040542.
- Shi Y., Vanhoutte P.M. Macro- and microvascular endothelial dysfunction in diabetes. J. Diabetes. 2017 May. 9(5). 434-449. doi: 10.1111/1753-0407.12521.
- Zheng D., Liu J., Piao H., Zhu Z., Wei R., Liu K. ROS-triggered endothelial cell death mechanisms: Focus on pyroptosis, parthanatos, and ferroptosis. Front. Immunol. 2022 Nov 1. 13. 1039241. doi: 10.3389/fimmu.2022.1039241.
- Athyros V.G., Doumas M., Imprialos K.P. et al. Diabetes and lipid metabolism. Hormones (Athens). 2018 Mar. 17(1). 61-67. doi: 10.1007/s42000-018-0014-8.
- Zhou M., Zhang J., Jia J. et al. Association between hemoglobin A1c and asymptomatic carotid intima-media thickness in middle-aged and elderly populations without diabetes. Nutr. Metab. Cardiovasc. Dis. 2022 Jun. 32(6). 463-1469. doi: 10.1016/j.numecd.2022.02.003.
- Li Y., Liu Y., Liu S. et al. Diabetic vascular diseases: mole–cular mechanisms and therapeutic strategies. Signal Transduct. Target Ther. 2023 Apr 10. 8(1). 152. doi: 10.1038/s41392-023-01400-z.
- van Sloten T.T., Sedaghat S., Carnethon M.R., Lau–ner L.J., Stehouwer C.D.A.. Cerebral microvascular complications of type 2 diabetes: stroke, cognitive dysfunction, and depression. Lancet Diabetes Endocrinol. 2020 Apr. 8(4). 325-336. doi: 10.1016/S2213-8587(19)30405-X.
- Fu W., Tang Y., Che X., Tan J., Ma Y., He Z. Neuropharmacological efficacy of metformin for stroke in rodents: A meta-analysis of preclinical trials. Front. Pharmacol. 2022 Nov 3. 13. 1009169. doi: 10.3389/fphar.2022.1009169.
- UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet. 1998. (352). 854-865.
- Dutta S., Shah R.B., Singhal S. et al. Metformin: A Review of Potential Mechanism and Therapeutic Utility Beyond Diabetes. Drug. Des. Devel. Ther. 2023 Jun 26. 17. 1907-1932. doi: 10.2147/DDDT.S409373.
- Markowicz-Piasecka M., Sadkowska A., Huttunen K.M., Podsiedlik M., Mikiciuk-Olasik E., Sikora J. An investigation into the pleiotropic activity of metformin. A glimpse of haemostasis. Eur. J. Pharmacol. 2020 Apr 5. 872. 172984. doi: 10.1016/j.ejphar.2020.172984.
- Sardu C., D’Onofrio N., Torella M. et al. Pericoronary fat inflammation and Major Adverse Cardiac Events (MACE) in predia–betic patients with acute myocardial infarction: effects of metformin. Cardiovasc. Diabetol. 2019 Sep 30. 18(1). 126. doi: 10.1186/s12933-019-0931-0.
- Foretz M., Guigas B., Viollet B. Understanding the glucoregulatory mechanisms of metformin in type 2 diabetes mellitus. Nat. Rev. Endocrinol. 2019 Oct. 15(10). 569-589. doi: 10.1038/s41574-019-0242-2.
- Pashkovska N. Cognitive Impairment in Type 2 Diabetes Mellitus: Prospects for the Use of Metformin. Mìžnarodnij endokrinologìčnij žurnal. 2023. 19. 215-224. https://doi.org/10.22141/2224-0721.19.3.2023.1274.
- American Diabetes Association Professional Practice Committee; 9. Pharmacologic Approaches to Glycemic Treatment: Standards of Care in Diabetes — 2024. Diabetes Care 1 January 2024. 47 (Supplement 1). S158-S178. https://doi.org/10.2337/dc24-S009.
- WHO Model List of Essential Medicines. 23rd list, 2023. https://www.iccp-portal.org/system/files/resources/WHO-MHP-HPS-EML-2023.02-eng.pdf.
- Akhtar N., Singh R., Kamran S. et al. Diabetes: Chronic Metformin Treatment and Outcome Following Acute Stroke. Front. Neurol. 2022 Apr 26. 13. 849607. doi: 10.3389/fneur.2022.849607.
- Matvieieva L.Ia. The effectiveness of metformin in reducing cerebrovascular complications in patients with type 2 diabetes mellitus. Ukrainskyi medychnyi chasopys. IX/X 2023. 5(157). DOI: 10.32471/umj.1680-3051.157.248308.
- Muoio V., Persson P.B., Sendeski M.M. The neurovascular unit — concept review. Acta. Physiol. (Oxf). 2014 Apr. 210(4). 790-8. doi: 10.1111/apha.12250.
- Sharma S., Nozohouri S., Vaidya B., Abbruscato T. Repurposing metformin to treat age-related neurodegenerative disorders and ischemic stroke. Life Sci. 2021 Jun 1. 274. 119343. doi: 10.1016/j.lfs.2021.119343.
- Szymczak-Pajor I., Wenclewska S., Śliwińska A. Metabolic Action of Metformin. Pharmaceuticals (Basel). 2022 Jun 30. 15(7). 810. doi: 10.3390/ph15070810.
- Jiang S., Li T., Ji T. et al. AMPK: Potential Therapeutic Target for Ischemic Stroke. Theranostics. 2018 Aug 10. 8(16). 4535-4551. doi: 10.7150/thno.25674.
- Liu Y., Tang G., Zhang Z., Wang Y., Yang G.Y. Metformin promotes focal angiogenesis and neurogenesis in mice following middle cerebral artery occlusion. Neurosci. Lett. 2014. 579. 46-51. doi: 10.1016/j.neulet.2014.07.006.
- Zhang L., Zhang J., Zhu X. et al. Metformin enhances neural precursor cells migration and functional recovery after ischemic stroke in mice. Exp. Brain Res. 2023 Feb. 241(2). 505-515. doi: 10.1007/s00221-023-06547-3.
- Yu H., Yang R.T., Wang S.Y. et al. [Metformin use and risk of ischemic stroke in patients with type 2 diabetes: A cohort study]. Beijing Da Xue Xue Bao Yi Xue Ban. 2023 Jun 18. 55(3). 456-464. Chinese. doi: 10.19723/j.issn.1671-167X.2023.03.011.
- Yu S.F., Hong C.T., Chen W.T., Chan L., Chien L.N. Metformin adherence and the risk of cardiovascular disease: a population-based cohort study. Ther. Adv. Chronic. Dis. 2023 Apr 4. 14. 20406223231163115. doi: 10.1177/20406223231163115.
- Kersten C.J.B.A., Knottnerus I.L.H., Heijmans E., Haalboom M., Zandbergen A.A.M., den Hertog H.M. Effect of metformin on outcome after acute ischemic stroke in patients with type 2 diabetes mellitus. J. Stroke Cerebrovasc. Dis. 2022 Sep. 31(9). 106648. doi: 10.1016/j.jstrokecerebrovasdis.2022.106648.
- Jian Y., Wang H., Zhao L. et al. Metformin treatment and acute ischemic stroke outcomes in patients with type 2 diabetes: a retrospective cohort study. Neurol. Sci. 2023 Mar. 44(3). 989-997. doi: 10.1007/s10072-022-06491-0.
- Westphal L.P., Widmer R., Held U. et al.; Thrombolysis in Ischemic Stroke Patients (TRISP) Study Group. Association of prestroke metformin use, stroke severity, and thrombolysis outcome. Neurology. 2020 Jul 28. 95(4). e362-e373. doi: 10.1212/WNL.0000000000009951.
- Wu T.Y., Campbell B.C., Strbian D., Yassi N., Putaala J., Tatlisumak T., Davis S.M., Meretoja A. VISTA-ICH Collaboration. Impact of pre-stroke sulphonylurea and metformin use on mortality of intracerebral haemorrhage. Eur. Stroke. J. 2016 Dec. 1(4). 302-309. doi: 10.1177/2396987316666617.
- Paridari P., Jabermoradi S., Gholamzadeh R. et al. Can metformin use reduce the risk of stroke in diabetic patients? A systematic review and meta-analysis. Diabetes Metab. Syndr. 2023 Feb. 17(2). 102721. doi: 10.1016/j.dsx.2023.102721.