Журнал «Почки» Том 12, №3, 2023
Вернуться к номеру
Ефективність застосування Lespedeza capitata у хворих на хронічну хворобу нирок ІІІ–ІV ст.
Авторы: Дудар І.О., Лобода О.М.
ДУ «Інститут нефрології НАМН України», м. Київ, Україна
Рубрики: Нефрология
Разделы: Клинические исследования
Версия для печати
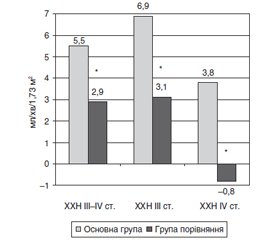
Метою нашої роботи було оцінити ефективність застосування Lespedeza capitata (Лібера) у пацієнтів із хронічною хворобою нирок (ХХН) ІІІ–ІV cт. Матеріали та методи. Було проведено порівняльне дослідження з тривалістю спостереження 2 міс. У дослідження було включено 45 пацієнтів із ХХН ІІІ–ІV cт. Хворі були розподілені на 2 групи. До першої групи (основна) увійшло 30 хворих (чоловіків — 16, жінок — 14, вік — 51 (40; 65) рік), які отримували додатково до стандартної терапії Lespedeza capitata (Лібера). Lespedeza capitata (Лібера) призначався за схемою: по 1 капсулі тричі на день перорально 2 міс. До другої групи (порівняння) було включено 15 хворих (чоловіків — 8, жінок — 7, вік — 49 (39; 63) років), які отримували тільки стандартну терапію. Не виявлено вірогідних відмінностей основних клініко-лабораторних показників у хворих основної групи та групи порівняння до початку лікування. Результати. При аналізі показника зниження протеїнурії за 2 міс. отримані такі результати: в основній групі зниження становило 0,05 (0; 0,16) г/добу, а в групі порівняння — 0,03 (0,2; 0,6) г/добу (р > 0,05). При аналізі показника зміни швидкості клубочкової фільтрації (ШКФ) за 2 міс. отримані такі результати: в основній групі збільшення становило 5,5 (2; 9) мл/хв/1,73 м2, а в групі порівняння — 2,9 (1; 6) мл/хв/1,73 м2 (р < 0,05). Також проведена оцінка впливу Lespedeza capitata (Лібера) на зміни ШКФ окремо для кожної стадії ХХН. У хворих з ІІІ стадією ХХН зміни ШКФ протягом 2 міс. становили: в основній групі — збільшення з 39 (34; 51) мл/хв/1,73 м2 до 46 (37; 64) мл/хв/1,73 м2 (р < 0,001); у групі порівняння — з 39 (35,5; 41) мл/хв/1,73 м2 до 41,5 (40; 45) мл/хв/1,73 м2 (р > 0,05) . Різниця в значеннях показників ШКФ у досліджуваних групах через 2 міс. була невірогідною (р > 0,05). При аналізі показника зміни ШКФ за 2 міс. отримані такі результати: в основній групі збільшення становило 6,9 (3; 14) мл/хв/1,73 м2, а в групі порівняння — 5 (2; 7,5) мл/хв/1,73 м2 (р < 0,001). У пацієнтів з ІV стадією ХХН відбулись такі зміни ШКФ протягом 2 міс.: в основній групі — з 27 (20; 29) мл/хв/1,73 м2 до 29 (26; 31) мл/хв/1,73 м2 (р > 0,05); у групі порівняння — з 29 (28; 29) мл/хв/1,73 м2 до 28 (28; 29) мл/хв/1,73 м2 (р > 0,05). Різниця в значеннях показників ШКФ у досліджуваних групах через 2 міс. була невірогідною (р > 0,05). При аналізі показника зміни ШКФ за 2 міс. отримані такі результати: в основній групі збільшення становило 3,1 (0,9; 6) мл/хв/1,73 м2, а в групі порівняння зменшення становило –0,8 (–2; 4) мл/хв/1,73 м2 (р < 0,05). Висновки. Застосування Lespedeza capitata (Лібера) є доцільним з огляду на перебіг і прогресування ХХН ІІІ–ІV ст. Про це свідчить вірогідно більше зростання ШКФ за 2 міс. в основній групі проти групи порівняння. Кращі результати щодо впливу на ШКФ були досягнуті за наявності ХХН ІІІ ст. порівняно з ХХН ІV ст.
Background. The purpose of our study was to evaluate the effectiveness of the Lespedeza capitata (Libera) in patients with chronic kidney disease (CKD) stage 3–4. Materials and methods. A comparative study was conducted with an observation period of 2 months. Forty-five patients with CKD stage 3–4 were included in the study. They were divided into 2 groups. The first group (main) included 30 patients (16 men, 14 women aged 51 (40; 65) years) who received Lespedeza capitata (Libera) in addition to standard therapy. Lespedeza capitata (Libera) was administered according to the scheme: 1 capsule three times a day orally for 2 months. The second group (comparison) included 15 patients (8 men, 7 women aged 49 (39; 63) years) who received only standard therapy. No significant differences in the main clinical and laboratory indicators were found in patients of the main and comparison groups before the start of treatment. Results. In the main group, a decrease in proteinuria for 2 months was 0.05 (0; 0.16) g/day, and in the comparison group, it was 0.03 (0.2; 0.6) g/day (p > 0.05). An increase in glomerular filtration rate (GFR) was 5.5 (2; 9) ml/min/1.73 m2 for 2 months, and in the comparison group, it was 2.9 (1; 6) ml/min/1.73 m2 (p < 0.05). An assessment of Lespedeza capitata (Libera) effect on changes in GFR separately for each stage of CKD was also carried out. In patients with CKD stage 3, changes in GFR within 2 months were as follows: in the main group, it increased from 39 (34; 51) ml/min/1.73 m2 to 46 (37; 64) ml/min/1.73 m2 (p < 0.001); in the comparison group, from 39 (35.5; 41) ml/min/1.73 m2 to 41.5 (40; 45) ml/min/1.73 m2 (p > 0.05). The difference in the GFR values after 2 months was insignificant (p > 0.05). In the main group, an increase in GFR for 2 months was 6.9 (3; 14) ml/min/1.73 m2, and in the comparison group, it was 5 (2; 7.5) ml/min/1.73 m2 (p < 0.001). In patients with CKD stage 4, a change in GFR within 2 months was as follows: in the main group, from 27 (20; 29) ml/min/1.73 m2 to 29 (26; 31) ml/min/1.73 m2 (p > 0.05); in the comparison group, from 29 (28; 29) ml/min/1.73 m2 to 28 (28; 29) ml/min/1.73 m2 (p > 0.05). The difference in the GFR values 2 months after was insignificant (p > 0.05). In the main group, an increase in GFR was 3.1 (0.9; 6) ml/min/1.73 m2 after 2 months, and in the comparison group, –0.8 (–2; 4) ml/min/1.73 m2 (p < 0.05). Conclusions. The use of Lespedeza capitata (Libera) is appropriate in view of the course and progression of CKD stage 3–4. This is evidenced by a significantly greater increase in GFR for 2 months in the main group versus the comparison group. The best results regarding the effect on GFR were achieved in the presence of CKD stage 3 compared to CKD stage 4.
хронічна хвороба нирок; прогресування; Lespedeza capitata; лікування
chronic kidney disease; progression; Lespedeza capitata; treatment
Вступ
Матеріали та методи
Результати та обговорення
/41.jpg)
Висновки
- Kovesdy C.P. Epidemiology of chronic kidney disease: an update 2022. Kidney Int. Suppl. (2011). 2022 Apr. 12(1). 7-11. doi: 10.1016/j.kisu.2021.11.003.
- GBD Chronic Kidney Disease Collaboration. Global, regio–nal, and national burden of chronic kidney disease, 1990–2017: a systematic analysis for the global Burden of disease study 2017. Lancet. 2020. 395. 709-33. doi: 10.1016/S0140-6736(20)30045-3.
- GBD 2017 Causes of Death Collaborators. Global, regional, and national age-sex-specific mortality for 282 causes of death in 195 countries and territories, 1980–2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2018. 392. 1736-88. doi: 10.1016/S0140-6736(18)32203-7.
- GBD 2017 DALYs and HALE Collaborators. Global, regional, and national disability-adjusted life-years (DALYs) for 359 diseases and injuries and healthy life expectancy (HALE) for 195 countries and territories, 1990–2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2018. 392. 1859-922. doi: 10.1016/S0140-6736(18)32335-3.
- Wen C.P., Cheng T.Y., Tsai M.K. et al. All-cause morta–lity attributable to chronic kidney disease: a prospective cohort study based on 462 293 adults in Taiwan. Lancet. 2008. 371. 2173-82. doi: 10.1016/S0140-6736(08)60952-6.
- Lim C.C., Teo B.W., Ong P.G. et al. Chronic kidney disease, cardiovascular disease and mortality: a prospective cohort study in a multi-ethnic Asian population. Eur. J. Prev. Cardiol. 2015. 22. 1018-26. doi: 10.1177/2047487314536873.
- Wang M., Li J., Li Y. et al. The effects of hypertension and diabetes on new-onset chronic kidney disease: a prospective cohort study. J. Clin. Hypertens. (Greenwich). 2020. 22. 39-46. doi: 10.1111/jch.13768.
- Ishigami J., Cowan L.T., Demmer R.T. et al. Incident hospitalization with major cardiovascular diseases and subsequent risk of ESKD: implications for Cardiorenal syndrome. J. Am. Soc. Nephrol. 2020. 31. 405-14. doi: 10.1681/ASN.2019060574.
- Parvathaneni K., Surapaneni A., Ballew S.H. et al. Association between midlife physical activity and incident kidney disease: the atherosclerosis risk in communities (ARIC) study. Am. J. Kidney Dis. 2021. 77. 74-81. doi: 10.1053/j.ajkd.2020.07.020.
- Nishikawa K., Takahashi K., Yamada R. et al. Influence of chronic kidney disease on hospitalization, chronic dialysis, and mortality in Japanese men: a longitudinal analysis. Clin. Exp. Nephrol. 2017. 21. 316-23. doi: 10.1007/s10157-016-1293-5.
- Wang J., Wang F., Saran R. et al. Mortality risk of chronic kidney disease: a comparison between the adult populations in urban China and the United States. PLoS One. 2018. 13. e0193734. doi: 10.1371/journal.pone.0193734.
- Kim H.J., Kim Y., Kim S. et al. Age, sex, and the association of chronic kidney disease with all-cause mortality in Buddhist priests: an analysis of the standardized mortality ratio from the Korean Buddhist priests cohort. Medicine (Baltimore). 2018. 97. e13099. doi: 10.1097/MD.0000000000013099.
- Stevens P.E., Levin A. Kidney Disease: Improving Global Outcomes Chronic Kidney Disease Guideline Development Work Group Members. Evaluation and management of chronic kidney disease: synopsis of the kidney disease: improving global outcomes 2012 clinical practice guideline. Ann. Intern. Med. 2013. Jun 4. 158(11). 825-30. doi: 10.7326/0003-4819-158-11-201306040-00007.
- Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases. Kidney Int. 2021 Oct. 100(4S). S1-S276. doi: 10.1016/j.kint.2021.05.021.
- Kidney Disease: Improving Global Outcomes (KDIGO) Blood Pressure Work Group. KDIGO 2021 Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease. Kidney Int. 2021 Mar. 99(3S). S1-S87. doi: 10.1016/j.kint.2020.11.003.
- Wanner C., Tonelli M.; Kidney Disease: Improving Global Outcomes Lipid Guideline Development Work Group Members. KDIGO Clinical Practice Guideline for Lipid Management in CKD: summary of recommendation statements and clinical approach to the patient. Kidney Int. 2014 Jun. 85(6). 1303-9. doi: 10.1038/ki.2014.31.
- Podestà M.A., Sabiu G., Galassi A., Ciceri P., Cozzolino M. SGLT2 Inhibitors in Diabetic and Non-Diabetic Chronic Kidney Disease. Biomedicines. 2023 Jan 19. 11(2). 279. doi: 10.3390/biomedicines11020279.
- Ma C., Li X., Li W., Li Y., Shui F., Zhu P. The efficacy and safety of SGLT2 inhibitors in patients with non-diabetic chro–nic kidney disease: a systematic review and meta-analysis. Int. Urol. Nephrol. 2023 Apr 13. doi: 10.1007/s11255-023-03586-1.
- Junhao L., Luying G., Rending W., Jianghua C. Efficacy and Safety of Sodium-Glucose Cotransporter-2 Inhibitors in Nondiabetic Patients with Chronic Kidney Disease: A Review of Recent Evidence. Kidney Dis. 2023. https://doi.org/10.1159/000530395
- Kim M.K. Treatment of diabetic kidney disease: current and future targets. Korean J. Intern. Med. 2017. 32(4). 622-30. doi: 10.3904/kjim.2016.219.
- Sugahara M., Pak W.L.W., Tanaka T., Tang S.C.W., Nangaku M. Update on diagnosis, pathophysiology, and management of diabetic kidney disease. Nephrology (Carlton). 2021. 26(6). 491-500. doi: 10.1111/nep.13860.
- Kidney Disease: Improving Global Outcomes (KDIGO) Diabetes Work Group. KDIGO 2022 Clinical Practice Guideline for Diabetes Management in Chronic Kidney Disease. Kidney Int. 2022 Nov. 102(5S). S1-S127. doi: 10.1016/j.kint.2022.06.008.
- Ninčević V., Omanović Kolarić T., Roguljić H., Kizivat T., Smolić M., Bilić Ć.I. Renal benefits of SGLT 2 inhibitors and GLP-1 receptor agonists: evidence supporting a paradigm shift in the medical management of type 2 diabetes. Int. J. Mol. Sci. 2019. 20(23). 5831. doi: 10.3390/ijms20235831.
- Ghosal S., Sinha B. Assessing the Effects of Modern Renoprotective Agents in Preventing Progression of Renal Composite Outcomes in Patients with Type 2 Diabetes: A Network Meta-analysis. Diabetes Ther. 2023. 14. 415-424. https://doi.org/10.1007/s13300-022-01359-0.
- Cha D.R. Mineralocorticoid receptor blockade for renoprotection. Kidney Res. Clin. Pract. 2018. 37(3). 183-4. doi: 10.23876/j.krcp.2018.37.3.183.
- Khan M.A., Kassianos A.J., Hoy W.E., Alam A.K., Healy H.G., Gobe G.C. Promoting Plant-Based Therapies for Chro–nic Kidney Disease. Journal of Evidence-Based Integrative Medicine. 2022. 27. doi: 10.1177/2515690X221079688.
- Zhong Y., Zhong Y., Deng Y., Chen Y., Chuang P.Y., Heet J.C. Therapeutic use of traditional Chinese herbal medications for chronic kidney diseases. Kidney Int. 2013. 84(6). 1108-1118. doi: 10.1038/ki.2013.276.
- Gobe G.C., Wojcikowski K. Nontraditional (non-Western pharmaceutical) treatments for chronic kidney disease. Clin. Nephrol. 2019. 93(1). 49-54. doi: 10.5414/CNP92S108.
- Yarnell E., Abascal K. Herbs for relieving chronic renal fai–lure. Altern. Complement Ther. 2007. 13(1). 18-23.
- Кушніренко С., Іванов Д., Ротова С., Кушніренко О. Ренопротекторні можливості Lespedeza capitata у хворих на хронічну хворобу нирок із цукровим діабетом 2-го типу. Нирки. 2022. 10(3). 162-168. https://doi.org/10.22141/2307-1257.10.3.2021.239594.

/39.jpg)
/40.jpg)