Журнал «Почки» Том 12, №2, 2023
Вернуться к номеру
Оцінка індексу резистентності та екскреції уромодуліну в пацієнтів з додіалізною хронічною хворобою нирок з урахуванням індексу коморбідності
Авторы: Денова Л.Д. (1), Іванов Д.Д. (2)
(1) — Національний університет охорони здоров’я імені П.Л. Шупика, м. Київ, Україна
(2) — Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Нефрология
Разделы: Клинические исследования
Версия для печати
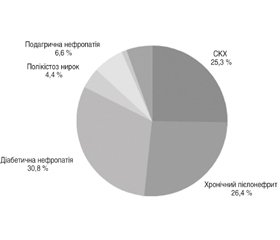
Метою роботи було дослідити екскрецію уромодуліну сечі (uUmod), реактивность вегетативної нервової системи і порушення ниркового кровообігу в пацієнтів з додіалізною хронічною хворобою нирок (ХХН), вплив антиоксидантної терапії на ці показники. Матеріали та методи. У дослідженні ROLUNT (UROmoduLin UbiquinoNe GlutaThione) взяли участь пацієнти з ХХН 1–5-ї ст. (n = 91), середній вік яких становив 47,00 ± 12,12 року. Тридцять (32,97 %) чоловіків і 61 (67,03 %) жінка були розподілені на дві групи, які були репрезентативними за віковим і гендерним складом: 1-ша група (n = 46) — пацієнти з ХХН 1–5-ї ст., які мали індекс коморбідності Чарлсона ≤ 2, 2-га група (n = 45) — пацієнти з ХХН 1–5-ї ст., які мали індекс коморбідності Чарлсона ≥ 3. Перша і друга групи поділялись на підгрупи А і Б. Підгрупи А включали пацієнтів з порушенням вегетативного статусу, підгрупи Б — без порушення вегетативного статусу. Підгрупи 1А і 2Б приймали глутатіон по 100 мг 2 рази на добу під час їди протягом 3 місяців; підгрупи 1Б і 2А приймали убіхінон по 100 мг 1 раз на добу під час їди протягом 3 місяців. У пацієнтів з ХХН 1–5-ї ст. визначено uUmod, співвідношення альбуміну і креатиніну (САК), швидкість клубочкової фільтрації (ШКФ). Було проведено 91 ультразвукове дуплексне кольорове сканування нирок і визначено індекс резистентності (IR) у пацієнтів з ХХН 1–5-ї ст. Результати. Результати парного t-тесту показали, що існує значна різниця між показниками на початку і в кінці дослідження, за винятком таких: у підгрупі 1А: гемоглобін (Hb) (T = –1,5863 [–2,0739; 2,0739], 95% довірчий інтервал (ДІ) [–2,4077; 0,3207], p = 0,127); у підгрупі 1Б: Hb (T = –0,382 [–2,0739; 2,0739], 95% ДІ [–1,3977; 0,963], p = 0,706); САК (T = –1,5899 [–2,0739; 2,0739], 95% ДІ [–16,7323; 2,2105], p = 0,126); систолічний артеріальний тиск (САТ) (T = –0,5625 [–2,0739; 2,0739], 95% ДІ [–2,2414; 1,2849], p = 0,579); діастолічний артеріальний тиск (ДАТ) (T = –1,7936 [–2,0739; 2,0739], 95% ДІ [–2,3437; 0,1698], p = 0,087); анкета Чернова (T = 1,5071 [–2,0739; 2,0739], 95% ДІ [–0,6083; 3,8431], p = 0,146); індекс Кердо (T = 0,9392 [–2,0739; 2,0739], 95% ДІ [–1,1083; 2,9431], p = 0,358); у підгрупі 2А: САК (T = –2,0147 [–2,0796; 2,0796], 95% ДІ [–39,1946; 0,6219], p = 0,057); у підгрупі 2Б: САК (T = –1,3328 [–2,0739; 2,0739], 95% ДІ [–17,4695; 3,7999], p = 0,196). Результати кореляції Пірсона показали, що в підгрупі 1А існує значущий середній позитивний зв’язок між показниками uUmod і рШКФ (r(21) = 0,418; p = 0,047); значущий дуже малий негативний зв’язок між показниками uUmod і віком (r(21) = 0,438; p = 0,037); у підгрупі 1Б існує значущий великий позитивний зв’язок між показниками uUmod і Hb (r(21) = 0,513; p = 0,012); значущий великий позитивний зв’язок між показниками uUmod і Morisky Medication Adherence Scale 8 (MMAS-8) (r(21) = 0,515; p = 0,012); значущий дуже малий негативний зв’язок між показниками uUmod і САК (r(21) = 0,441; p = 0,035); у підгрупі 2А існує значущий дуже малий негативний зв’язок між показниками uUmod та індексом Кердо (r(20) = 0,427; p = 0,048); у підгрупі 2Б існує значущий дуже малий негативний зв’язок між показниками uUmod і анкетою Чернова (r(21) = 0,421, p = 0,045); значущий дуже малий негативний зв’язок між показниками uUmod та індексом Чарлсона (r(21) = 0,481; p = 0,020); значущий дуже малий негативний зв’язок між показниками uUmod і віком (r(21) = 0,471; p = 0,023). У підгрупі 1А в кінці дослідження такі незалежні змінні не є значущими як предиктори для uUmod: IRd, IRs, САТ, ДАТ, Hb, САК, вік, анкети Вейна і Чернова, MMAS-8, індекси Чарлсона і Кердо. У підгрупі 1Б у кінці дослідження такі незалежні змінні не є значущими як предиктори для uUmod: рШКФ, IRs, САТ, ДАТ, Hb, анкети Вейна і Чернова, MMAS-8, індекси Чарлсона і Кердо. У підгрупі 2А в кінці дослідження такі незалежні змінні не є значущими як предиктори для uUmod: рШКФ, IRd, IRs, САТ, ДАТ, Hb, САК, вік, анкета Вейна, MMAS-8, індекс Чарлсона. У підгрупі 2Б у кінці дослідження такі незалежні змінні не є значущими як предиктори для uUmod: рШКФ, IRd, IRs, САТ, ДАТ, Hb, САК, вік, анкета Вейна, MMAS-8, індекс Кердо. Висновки. Антиоксидантна терапія глутатіоном і убіхіноном суттєво впливає на показники обстеження пацієнтів із ХХН. Враховуючи безпеку й ефективність антиоксидантної терапії, ми пропонуємо включити антиоксидантну терапію в протоколи лікування пацієнтів із ХХН. Для встановлення стандартного протоколу рекомендовано подальші дослідження.
Background. The purpose of this study was to investigate urinary uromodulin (uUmod) excretion, reactivity of the autonomic nervous system and impaired renal blood circulation in patients with predialysis chronic kidney disease (CKD), and the effect of antioxidant therapy on these parameters. Materials and methods. Ninety-one patients with CKD stage 1–5 took part in the ROLUNT (UROmoduLin UbiquinoNe GlutaThione) study, their average age was 47.00 ± 12.12 years. Thirty (32.97 %) men and 61 (67.03 %) women were divided into two groups, which were representative in terms of age and gender composition: the first one (n = 46) — patients with CKD stage1–5 who had Charlson Comorbidity Index ≤ 2, the second one (n = 45) — patients with CKD stage1–5 who had Charlson Comorbidity Index ≥ 3. The first and second groups were divided into subgroups A and B. Subgroup A included patients with impaired vegetative status, subgroup B — without impaired vegetative status. Subgroups 1A and 2B took glutathione 100 mg twice a day with food for 3 months; subgroups 1B and 2A received ubiquinone 100 mg once a day with food for 3 months. In patients with CKD stage1–5, uUmod, albumin to creatinine ratio (ACR), glomerular filtration rate (GFR) were evaluated. Ninety-one ultrasound duplex color scans of the kidneys were performed and the index of resistance (IR) was determined in patients with CKD stage1–5. Results. The results of the paired t-test showed that there is a significant difference between the indicators at the beginning and at the end of the study, with the exception of the following: in subgroup 1A: hemoglobin (Hb) (T = –1.5863 [–2.0739, 2.0739] 95% confidence interval (CI) [–2.4077, 0.3207], p = 0.127); in subgroup 1B: Hb (T = –0.382 [–2.0739, 2.0739], 95% CI [–1.3977, 0.963], p = 0.706); ACR (T = –1.5899 [–2.0739, 2.0739], 95% CI [–16.7323, 2.2105], p = 0.126); systolic blood pressure (SBP) (T = –0.5625 [–2.0739, 2.0739], 95% CI [–2.2414, 1.2849], p = 0.579); diastolic blood pressure (DBP) (T = –1.7936 [–2.0739, 2.0739], 95% CI [–2.3437, 0.1698], p = 0.087); Chernov questionnaire (T = 1.5071 [–2.0739, 2.0739], 95% CI [–0.6083, 3.8431], p = 0.146); Kérdö index (T = 0.9392 [–2.0739, 2.0739], 95% CI [–1.1083, 2.9431], p = 0.358); in subgroup 2A: ACR (T = –2.0147 [–2.0796, 2.0796], 95% CI [–39.1946, 0.6219], p = 0.057); in subgroup 2B: ACR (T = –1.3328 [–2.0739, 2.0739], 95% CI [–17.4695, 3.7999], p = 0.196). The Pearson correlation results showed that in subgroup 1A, there is a significant average positive relationship between uUmod and eGFR (r(21) = 0.418, p = 0.047); a significant very small negative relationship between uUmod indicators and age (r(21) = 0.438, p = 0.037); in subgroup 1B, there is a significant large positive relationship between uUmod and Hb indicators (r(21) = 0.513, p = 0.012); a significant positive relationship between uUmod and Morisky Medication Adherence Scale-8 (MMAS-8) indicators (r(21) = 0.515, p = 0.012); a significant very small negative relationship between uUmod and ACR indicators (r(21) = 0.441, p = 0.035); in subgroup 2A, there is a significant very small negative relationship between uUmod indicators and Kérdö index (r(20) = 0.427, p = 0.048); in subgroup 2B, there is a significant very small negative relationship between the uUmod indicators and Chernov questionnaire score (r(21) = 0.421, p = 0.045); a significant very small negative relationship between uUmod indicators and Charlson Comorbidity Index (r(21) = 0.481, p = 0.020); a significant very small negative relationship between uUmod and age (r(21) = 0.471, p = 0.023). In subgroup 1A at the end of the study, the following independent variables are not significant as predictors for uUmod: IRd, IRs, SBP, DBP, Hb, ACR, age, Vein and Chernov questionnaires score, MMAS-8, Charlson Comorbidity Index and Kérdö index. In subgroup 1B at the end of the study, the following independent variables are not significant as predictors for uUmod: eGFR, IRs, SBP, DBP, Hb, Vein and Chernov questionnaires score, MMAS-8, Charlson Comorbidity Index and Kérdö index. In subgroup 2A at the end of the study, the following independent variables are not significant as predictors for uUmod: eGFR, IRd, IRs, SBP, DBP, Hb, ACR, age, Vein questionnaire score, MMAS-8, Charlson Comorbidity Index. In subgroup 2B at the end of the study, the following independent variables are not significant as predictors for uUmod: eGFR, IRd, IRs, SBP, DBP, Hb, ACR, age, Vein questionnaire score, MMAS-8, Kérdö index. Conclusions. Antioxidant therapy with glutathione and ubiquinone significantly affects the examination parameters of patients with CKD. Considering the safety and effectiveness of antioxidant therapy, we suggest including antioxidant therapy into the treatment protocols for patients with CKD. Further research is recommended to establish a standard protocol.
хронічна хвороба нирок; кольорова дуплексна допплерографія; нирковий кровообіг; убіхінон; глутатіон; уромодулін; вегетативний статус
chronic kidney disease; color duplex dopplerography; renal circulation; ubiquinone; glutathione; uromodulin; vegetative status