Международный эндокринологический журнал Том 19, №3, 2023
Вернуться к номеру
Метаболічні передумови формування та прогресування стеатогепатитів різної етіології при супутньому ожирінні й анемічних станах
Авторы: T. Antofiichuk, O. Khukhlina, M. Antofiichuk, N. Kaspruk
Bukovinian State Medical University, Chernivtsi, Ukraine
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
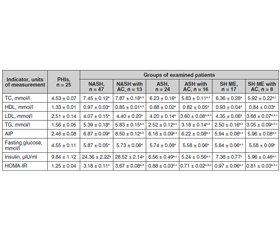
Актуальність. Актуальність проблеми коморбідності алкогольного стеатогепатиту (АСГ) і неалкогольного стеатогепатиту (НАСГ) з анемічними станами та необхідність їх диференційованої корекції визначається значною частотою цих патологій у світі та Україні, а також наявністю синдрому взаємообтяження. Анемія є маркером прогресування стеатогепатиту в цироз печінки, при якому анемічні стани часто є проявом гіперспленізму з посиленим руйнуванням еритроцитів у селезінці, а також частим ускладненням цирозу печінки, спричиненим постгеморагічною анемією, що виникає внаслідок кровотечі з варикозно розширених вен стравоходу, шлунка, портальної гіпертензії та зниження біосинтезу факторів згортання крові печінкою. Мета дослідження: встановити метаболічні передумови формування й прогресування стеатогепатиту алкогольної, змішаної і неалкогольної етіології та коморбідних анемічних станів. Матеріали та методи. Обстежено 125 хворих на стеатогепатит алкогольної, неалкогольної та змішаної етіології з анемічними станами й порушеннями ліпідного обміну і регуляції глікемії. Результати. Результати досліджень свідчать про гіперліпідемію (у 1,35–1,5 раза) у хворих на стеатогепатит змішаної етіології та АСГ, хоча за умов приєднання анемічних станів уміст загального холестерину (ХС) та холестерину ліпопротеїнів низької щільності (ЛПНЩ) у крові знизився (р < 0,05). Підвищення рівня тригліцеридів у крові (у межах 1,6–2,2 раза) і зниження рівня холестерину ліпопротеїнів високої щільності (у 1,45–1,55 раза) в усіх групах хворих зі стеатогепатитом та коморбідністю з анемічними станами ставали більш вираженими (р < 0,05). При НАСГ з анемічними станами спостерігається зростання в крові рівнів ХС ЛПНЩ та загального холестерину з підвищенням індексу атерогенності у 2,8 раза (р < 0,05). У пацієнтів із НАСГ й ожирінням високі значення глюкози, інсуліну та ступеня інсулінорезистентності (у 2,6 раза; p < 0,05), а при приєднанні анемічних станів посилюються інсулінемія та ступінь інсулінорезистентності (у 2,9 та 3,0 раза відповідно; р < 0,05). У хворих на АСГ і стеатогепатит змішаної етіології, пов’язані із вживанням алкоголю, формується дефіцит інсуліну (у 1,4 та 1,2 раза; p < 0,05), що відбувається на додаток до приєднання анемічних станів (уміст інсуліну в крові менше нижніх значень у 1,8 та 1,6 раза). Висновки. Наслідком метаболічної патології (гіперліпідемія, гіперглікемія, інсулінорезистентність), що розвинулася в умовах коморбідності стеатогепатиту з анемічними станами, стало підвищення ступеня стеатозу гепатоцитів (р < 0,05).
Background. The urgency of the problem of comorbidity of alcoholic steatohepatitis (ASH) and non-alcoholic steatohepatitis (NASH) with anaemic conditions and the need for their differentiated correction is determined by the significant frequency of these diseases in the world and Ukraine and the presence of the syndrome of the mutual burden. Anaemia is a marker for the progression of steatohepatitis to liver cirrhosis, in which anaemic conditions is often a manifestation of hypersplenism with the increased destruction of red blood cells in the spleen, as well as frequent complications of liver cirrhosis caused by posthemorrhagic anaemia, which occurs due to bleedings from the oesophageal and gastric varices, portal hypertension and decreased biosynthesis of coagulation factors by the liver. The purpose of the study was to find out metabolic prerequisites for the formation and progression of steatohepatitis of alcoholic, mixed and non-alcoholic aetiology and comorbid anaemic conditions. Materials and methods. One hundred and twenty-five patients with steatohepatitis of alcoholic, non-alcoholic and mixed aetiology were examined for comorbidities of anaemic conditions with lipid metabolism and glycemic regulation disorders. Results. The results of investigations demonstrate hyperlipidemia (by 1.35–1.5 times) in patients with steatohepatitis of mixed aetiology and ASH, although in anaemic conditions, the content of blood total cholesterol and low-density lipoprotein (LDL) cholesterol decreased (p < 0.05). Increased blood levels of triglycerides (in the range of 1.6–2.2 times) and decreased blood levels of high-density lipoprotein cholesterol (by 1.45–1.55 times) in all groups of patients with steatohepatitis and comorbidity with anaemic conditions deepened (p < 0.05). In NASH with anaemic conditions, there is an increase in the blood LDL cholesterol and total cholesterol levels, with the rise of the atherogenic index by 2.8 times (p < 0.05). Рatients with NASH and obesity have high values of glucose, insulin and degree of insulin resistance (by 2.6 times, p < 0.05), and with anaemic conditions, insulinemia and degree of insulin resistance are increased (by 2.9 and 3.0 times, respectively; p < 0.05). In patients with ASH and steatohepatitis of mixed aetiology associated with alcohol consumption, insulin deficiency is formed (by 1.4 and 1.2 times, p < 0.05), which develops in addition to anaemic conditions (blood insulin content is below the lower values by 1.8 and 1.6 times). Conclusions. The consequence of metabolic pathology (hyperlipidemia, hyperglycemia, insulin resistance), which developed under the comorbidity of steatohepatitis with anaemic conditions, was an increase in the degree of hepatocyte steatosis (p < 0.05).
алкогольний стеатогепатит; неалкогольний стеатогепатит; анемія; ліпідний спектр крові; глюкоза; інсулінорезистентність; стеатоз гепатоцитів
alcoholic steatohepatitis; non-alcoholic steatohepatitis; anaemia; blood lipids; glucose; insulin resistance; hepatocyte steatosis
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Bekri S., Gual P., Anty R., Luciani N., Dahman M., Ramesh B., Iannelli A. et al. Increased adipose tissue expression of hepcidin in severe obesity is independent from diabetes and NASH. Gastroenterology. 2006 Sep. 131(3). 788-96. doi: 10.1053/j.gastro.2006.07.007.
- Tkach S.M., Pankiv V.I., Yuzvenko T.Yu. Modern approaches to the management of patients with obesity (according to the materials of the Consensus of the American Gastroenterological Association in 2022). Clinical Endocrinology and Endocrine Surgery. 2023. 1(81). 47-57. doi: 10.30978/CEES-2023-1-47.
- Bergamaschi G., Di Sabatino A., Corazza G.R. Pathogenesis, diagnosis and treatment of anaemia in immune-mediated gastrointestinal disorders. Br. J. Haematol. 2018. 182. 319. doi: 10.1111/bjh.15254.
- Britton L.J., Subramaniam V.N., Crawford D.H. Iron and non-alcoholic fatty liver disease. World J. Gastroenterol. 2016. 22. 8112-8122. doi: 10.3748/wjg.v22.i36.8112.
- Hernandez Roman J., Siddiqui M.S. The role of noninvasive biomarkers in diagnosis and risk stratification in nonalcoholic fatty liver disease. Endocrinol. Diabetes Metab. 2020 Apr 5. 3(4). e00127. doi: 10.1002/edm2.127.
- Hutchinson C. A review of iron studies in overweight and obese children and adolescents: a double burden in the young? Eur. J. Nutr. 2016. 55. 2179. doi: 10.1007/s00394-016-1155-7.
- Ntandja Wandji L.C., Gnemmi V., Mathurin P., Louvet A. Combined alcoholic and non-alcoholic steatohepatitis. JHEP Rep. 2020 May 22. 2(3). 100101. doi: 10.1016/j.jhepr.2020.100101.
- Camaschella C. Iron-deficiency anemia. N. Engl. J. Med. 2015. 372. 1832. doi: 10.1056/NEJMra1401038.
- Cappellini M.D., Comin-Colet J., de Francisco A., Dignass A., Doehner W., Lam C.S., Macdougall I.C. et al.; IRON CORE Group. Iron deficiency across chronic inflammatory conditions: International expert opinion on definition, diagnosis, and management. Am. J. Hematol. 2017 Oct. 92(10). 1068-1078. doi: 10.1002/ajh.24820.
- Docherty A.B., Turgeon A.F., Walsh T.S. Best practice in cri–tical care: anaemia in acute and critical illness. Transfus. Med. 2018. 28. 181. doi: 10.1111/tme.12505.
- Fraenkel P.G. Anemia of inflammation: a review. The Medical Clinics of North America. 2017. 101(2). 285-296. doi: 10.1016/j.mcna.2016.09.005.
- Gangat N., Wolanskyj A.P. Anemia of chronic disease. Semin. Hematol. 2013. 50. 232. doi: 10.1053/j.seminhematol.2013.06.006.
- Pankiv V. Features of prediabetes management in adolescents with excessive body weight and obesity. International Journal of Endocrinology (Ukraine). 2022. 18(8). 436-439. doi: 10.22141/2224-0721.18.8.2022.1222.
- Ganz T. Erythropoietic regulators of iron metabolism. Free Radic. Biol. Med. 2019. 133. 69. doi: 10.1016/j.freeradbiomed.2018.07.003.
- Gerjevic L.N., Liu N., Lu S., Harrison-Findik D.D. Alcohol activates TGF-beta but inhibits BMP receptor-mediated SMAD signaling and SMAD4 binding to hepcidin promoter in the liver. Int. J. Hepatol. 2012. 2012. 459278. doi: 10.1155/2012/459278.
- Yefimenko T., Mykytyuk M. Non-alcoholic fatty liver disease: time for changes. International Journal of Endocrinology (Ukraine). 2021. 17(4). 334-345. doi: 10.22141/2224-0721.17.4.2021.237350.
- Malfertheiner P., Megraud F., O’Morain C.A., Gisbert J.P., Kuipers E.J., Axon A.T., Bazzoli F. et al.; European Helicobacter and Microbiota Study Group and Consensus panel. Management of Helicobacter pylori infection — the Maastricht V/Florence Consensus Report. Gut. 2017 Jan. 66(1). 6-30. doi: 10.1136/gutjnl-2016-312288.
- Milic S., Mikolasevic I., Orlic L., Devcic E., Starce–vic-Cizmarevic N., Stimac D. et al. The role of iron and iron overload in chronic liver disease. Med. Sci. Monit. 2016. 22. 2144-2151. doi: 10.12659/MSM.896494.
- Nemeth E., Ganz T. Anemia of inflammation. Hematology/Oncology Clinics of North America. 2014. 28(4). 671-681. doi: 10.1016/j.hoc.2014.04.005.