Журнал "Гастроэнтерология" Том 57, №2, 2023
Вернуться к номеру
Застосування неінвазивних методів оцінки стеатозу та фіброзу при хронічних дифузних захворюваннях печінки різної етіології
Авторы: Yu.M. Stepanov, V.I. Didenko, O.P. Petishko, A.M. Galinska
SI “Institute of Gastroenterology of the NAMS of Ukraine”, Dnipro, Ukraine
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
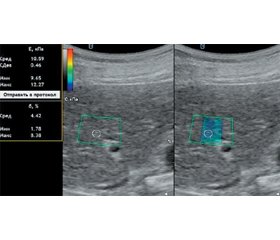
Мета дослідження: проаналізувати показники стеатозу та фіброзу печінки за даними зсувнохвильової еластографії (ЗХЕ) та стеатометрії в пацієнтів із хронічними дифузними захворюваннями печінки з урахуванням етіологічного чинника й визначити діагностичну цінність ЗХЕ в діагностиці фіброзу печінки. Матеріали та методи. Обстежено 364 пацієнти з хронічними дифузними захворюваннями печінки віком (48,00 ± 1,84) року: 159 (43,7 %) чоловіків та 205 (56,3 %) жінок. Хворі були розподілені на групи: 108 пацієнтів із неалкогольною жировою хворобою печінки (НАЖХП), 143 — з хронічним гепатитом С (ХГС), 56 — з алкогольною хворобою печінки (АХП) та 57 осіб із токсичним гепатитом медикаментозного генезу. Усім хворим проводили ЗХЕ на апараті Soneus P7 (Харків, Україна) з визначенням показників жорсткості паренхіми печінки та стеатометрію з розрахуванням коефіцієнта затухання ультразвуку. Результати. Загалом у 270 (74,2 %) пацієнтів із хронічними дифузними захворюваннями печінки спостерігалися фіброзні зміни за даними ЗХЕ. Установлено суттєве зростання жорсткості паренхіми печінки за показником модуля Юнга при ХГС в 1,9 раза (р < 0,05) та при АХП в 1,4 раза (р < 0,05) порівняно з групою здорових осіб, в 1,7 (р < 0,05) та 1,3 раза (р < 0,05) відповідно порівняно з групою пацієнтів із НАЖХП. За даними стеатометрії відмічено збільшення коефіцієнта затухання ультразвуку на 30,2 % (р < 0,05) у пацієнтів із НАЖХП, на 27,5 % (р < 0,05) — з АХП і на 22 % (р < 0,05) — із токсичним гепатитом порівняно з групою здорових осіб. У хворих із фіброзними змінами печінки медіана жорсткості паренхіми становила 6,70 кПа (6,35; 7,56), тоді як у пацієнтів без фіброзу печінки цей показник був вірогідно нижчий у 1,2 раза (р < 0,01). З метою визначення діагностичної цінності показника жорсткості паренхіми печінки за даними ЗХЕ для оцінки фіброзної трансформації проведено гістологічну оцінку зразків печінки, отриманих в результаті черезшкірної трепан-біопсії у 75 осіб із хронічними дифузними захворюваннями печінки, з яких у 14 (18,7 %) пацієнтів за морфологічними даними фіброз був відсутній. За результатами ROC-аналізу, показник жорсткості паренхіми печінки, визначений за допомогою ЗХЕ, що перевищує 5,79 кПа, підтверджує наявність фіброзу печінки в осіб із хронічними дифузними захворюваннями печінки незалежно від етіології (AUC = 0,901, р < 0,001). Висновки. При ХГС та АХП середній показник жорсткості паренхіми печінки, визначений за допомогою ЗХЕ, вищий, ніж при НАЖХП (р < 0,05), що підтверджує й вища частота реєстрації фіброзу печінки F3–4 стадій (р < 0,05). Розраховано порогове значення жорсткості паренхіми печінки при хронічних дифузних захворюваннях печінки — 5,79 кПа (чутливість 100,0 %, специфічність 85,7 %), що дозволяє сімейному лікарю сформувати групу ризику пацієнтів, яким рекомендовано динамічний моніторинг із подальшою можливістю дослідження для з’ясування етіологічного фактору фіброзу печінки.
Background. The aim of the study is to analyze the parameters of liver steatosis and fibrosis based on shear wave elastography (SWE) and steatometry data in patients with chronic diffuse liver diseases, taking into account the etiological factor, and determine the diagnostic accuracy of SWE in the diagnosis of liver fibrosis. Materials and methods. Three hundred and sixty-four patients with chronic diffuse liver disease aged (48.00 ± 1.84) years were examined, 159 (43.7 %) were male, and 205 (56.3 %) female. The patients were divided into groups: 108 people with non-alcoholic fatty liver disease (NAFLD), 143 with chronic hepatitis C (HCV), 56 with alcoholic liver disease (ALD), and 57 with drug-induced toxic hepatitis. In all patients, SWE and steatometry were performed by Soneus P7 device (Kharkiv, Ukraine) with the liver stiffness and ultrasound attenuation coefficient measurement. Results. According to SWE data, 270 (74.2 %) patients with chronic liver disease had fibrotic changes in the liver. A significant increase in liver stiffness by 1.9 times (p < 0.05) according to Young’s modulus was found in HCV patients and by 1.4 times (p < 0.05) in ALD patients compared to the control group, by 1.7 (p < 0.05) and 1.3 times (p < 0.05), respectively, compared to the group of patients with NAFLD. According to steatometry data, an increase in ultrasound attenuation coefficient by 30.2 % (p < 0.05) in patients with NAFLD, by 27.5 % (p < 0.05) in those with ALD and by 22 % (p < 0.05) in people with toxic hepatitis was found compared to the control group. In patients with liver fibrosis, the median liver stiffness was 6.70 kPa (6.35, 7.56), while in those without liver fibrosis, this parameter was 1.2 times lower (p < 0.01). Histological evaluation of liver samples obtained through percutaneous biopsy in 75 patients with chronic liver disease demonstrated the absence of fibrosis in 14 (18.7 %) cases. According to the results of the ROC analysis, the cut-off value of the liver stiffness determined by SWE was 5.79 kPa, confirming the presence of liver fibrosis in patients with chronic liver disease regardless of etiology (AUC = 0.901, p < 0.001). Conclusions. The liver stiffness determined by SWE in HCV and ALD patients was higher than in NAFLD patients (p < 0.05), as well as the frequency of F3–4 stages of liver fibrosis (p < 0.05). The threshold value of the liver stiffness for liver fibrosis diagnosis in chronic liver disease regardless of etiology was 5.79 kPa (sensitivity 100.0 %, specificity 85.7 %), which allows the family doctor to form a risk group of patients who needed dynamic monitoring with a further investigation of the etiological factor of liver fibrosis.
неалкогольна жирова хвороба печінки; алкогольна хвороба печінки; хронічний гепатит С; токсичний гепатит медикаментозного генезу; фіброз печінки; діагностика; зсувнохвильова еластографія
non-alcoholic fatty liver disease; alcoholic liver disease, chronic hepatitis C; toxic drug-induced hepatitis; liver fibrosis; diagnosis; shear wave elastography
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Epidemiology of chronic liver diseases in the USA in the past three decades / Z.M. Younossi et al. Gut. 2020. Vol. 69(3). P. 564-568.
- Changes in the Global Burden of Chronic Liver Diseases From 2012 to 2017: The Growing Impact of NAFLD / J.M. Paik et al. Hepatology (Baltimore, Md.). 2020. Vol. 72(5). P. 1605-1616.
- Sirchak Y., Griga V., Petrichko O., Рichkar Y. Efficiency of –using Bifidobacterium infantis 35624 in patients with non-alcoholic fatty liver disease. Gastroenterology. 2021. Vol. 54(1). P. 8-17.
- Roehlen N., Crouchet E., Baumert T.F. Liver Fibrosis: Mechanistic Concepts and Therapeutic Perspectives. Cells. 2020. Vol. 9(4). 875.
- New concepts on the clinical course and stratification of compensated and decompensated cirrhosis / G. D’Amico et al. Hepatology International. 2018. Vol. 12 (suppl. 1). P. 34-43.
- Aydın M.M., Akçalı K.C. Liver fibrosis. The Turkish Journal of Gastroenterology. 2018. Vol. 29(1). P. 14-21.
- Rockey D.C., Friedman S.L. Fibrosis Regression After Eradication of Hepatitis C Virus: From Bench to Bedside. Gastroenterology. 2021. Vol. 160(5). P. 1502-1520.e1.
- Вірусний гепатит С. Клінічна настанова, заснована на доказах. Державний експертний центр Міністерства охорони здоров’я України, ДУ «Центр громадського здоров’я МОЗ України», 2020. 132 c.
- Bortolotti F., Sorio D., Bertaso A., Tagliaro F. Analytical and diagnostic aspects of carbohydrate deficient transferrin (CDT): a critical review over years 2007–2017. Journal of Pharmaceutical and Biomedical Analysis. 2018. Vol. 147. P. 2-12.
- Moreno C., Mueller S., Szabo G. Non-invasive diagnosis and biomarkers in alcohol-related liver disease. Journal of Hepatology. 2019. Vol. 70(2). P. 273-283.
- EFSUMB Guidelines and Recommendations on the Clinical Use of Liver Ultrasound Elastography, Update 2017 (Long Version) / C.F. Dietrich et al. Ultraschall Med. 2017. Vol. 38(4). P. e16-e47.
- Quantitative elastography of liver fibrosis and spleen stiffness in chronic hepatitis B carriers: comparison of shear-wave elastography and transient elastography with liver biopsy correlation / V. Leung et al. Radiology. 2013. Vol. 269. P. 910-918. doi: 10.1148/radiol.13130128.
- Acoustic radiation force impulse imaging for assessing liver fibrosis in alcoholic liver disease / A. Kiani et al. World Journal of Gastroenterology. 2016. Vol. 22(20). P. 4926-4935.
- Riabokon Yu.Yu., Kalashnik K.V., Riabokon O.V. Influence of interleukin-6 gene polymorphism on the efficacy of antiviral treatment in patients with chronic hepatitis C. Zaporozhye Medical Journal. 2019. Vol. 21(1). P. 84-89.
- Рябоконь О.В., Ялова Г.В., Сіянова Л.Ю., Рябоконь Ю.Ю. Сучасні можливості противірусної терапії та власний досвід застосування 3D-режиму в лікуванні хворих на хронічний гепатит С з коморбідною хронічною нирковою недостатністю. Гепатологія. 2019. Т. 45. № 3. С. 22-30.
- Targeted lipidomics reveals extensive changes in circula–ting lipid mediators in patients with acutely decompensated cirrhosis / C. López-Vicario et al. Journal of hepatology. 2020. Vol. 73(4). P. 817-828.
- Blood metabolomics uncovers inflammation-associated mitochondrial dysfunction as a potential mechanism underlying ACLF / R. Moreau et al. Journal of hepatology. 2020. Vol. 72(4). P. 688-701.
- Simvastatin Prevents Progression of Acute on Chronic Liver Failure in Rats With Cirrhosis and Portal Hypertension / D.M. Tripathi et al. Gastroenterology. 2018. Vol. 155(5). P. 1564-1577.
- Treatment With Simvastatin and Rifaximin Restores the Plasma Metabolomic Profile in Patients With Decompensated Cirrhosis / E. Pose et al. Hepatology communications. 2022. Vol. 6(5). P. 1100-1112.